新型冠状病毒核酸检测试剂盒中酶的性能比较研究
2021-12-01杨镇州李妍杨雪刘刚梁文
杨镇州,李妍,杨雪,刘刚,梁文
上海市计量测试技术研究院化学与电离辐射所生物计量实验室,上海201203
PCR作为分子生物学的核心技术,已逐渐发展为最普遍的核酸定性及定量的研究手段,广泛用于研究生物体基因表达水平、生长发育、疾病控制等领域[1−6]。逆转录聚合酶链式反应(reverse transcription,RT-PCR)是将RNA的逆转录和cDNA的聚合酶链式扩增相结合的技术[7−9]。由于两个反应之间无需额外的开盖和缓冲液更换操作,实现了核糖核酸的一步法检测,具有可降低污染风险、提高检测速度、节省耗材、适用于高通量测定等优点,进一步推动了PCR技术基础的革新。
2019年,新型冠状病毒肺炎(coronavius disease 2019,COVID-19)疫情爆发后,我国卫生健康委员会发布的“新型冠状病毒感染的肺炎诊疗方案”[10]、美国疾病控制与预防中心发布的“实时荧光逆转录-聚合酶链反应检测2019新型冠状病毒”使用说明[11]、欧盟疾病控制与预防中心发布的“新型冠状病毒检测方法和目标”12]等,均以RTPCR检测阳性作为确诊的“金标准”。截至2020年11月3日,获国家药监局应急审批通过的新冠病毒核酸检测试剂盒主要为RT-qPCR检测试剂盒。但是在实际应用中,对于确诊患者的核酸检测,仍然出现了假阴性的问题,该结果一定程度上与核酸检测试剂盒的质量有关。在生产和保存环节中,酶易受保存温度、抑制剂等影响,因此,酶的质量是影响试剂盒性能的主要原因。
在RT-PCR反应过程中,涉及两种作用的酶,即逆转录作用的逆转录酶和聚合形成双链DNA的DNA聚合酶,如图1所示。本研究针对新冠病毒检测试剂盒中逆转录酶和DNA聚合酶两种酶的作用进行研究,以新型冠状病毒体外转录RNA标准物质为模板,采用相同的引物探针,考察不同新冠核酸检测试剂盒或原料酶的逆转录酶性能和PCR反应中的DNA聚合酶性能、热稳定性能等,最终形成客观有效的新型冠状病毒核酸检测试剂盒中酶的质量评价方法,旨在为核酸试剂盒的检测准确性提供质量控制支撑。

图1 RT-PCR反应原理及考察方法Fig.1 RT-PCR reaction principle and investigation methods
1 材料与方法
1.1 试剂及仪器
新型冠状病毒体外转录RNA标准物质[GBW(E)091111,GBW(E)091112,上海市计量测试技术研究院];A:新型冠状病毒核酸检测试剂盒(AgPath-IDTM一步法RT-PCR预混液,Thermo Fisher);B:One Step PrimeScriptTMIII RT-qPCR Mix(Takara);C:一步法反转录荧光定量试剂盒(生工生物工程(上海)股份有限公司);D:TOROIVD Probe 1-step RT-qPCR 5G Premix(Toroivd);E:新型冠状病毒(SARS-CoV-2)双重核酸检测试剂盒(荧光PCR法,武汉生之源生物科技股份有限公司);F:新型冠状病毒2019-nCoV核酸检测试剂盒(荧光PCR法,之江生物);DNA聚合酶(TOROIVD 5G qPCR Premix);实时荧光PCR仪(QuantStudio12KFlex,ThermoFisher)。引物探针序列由上海百力格生物技术有限公司合成。
1.2 引物探针序列
针对SARS-CoV-2的核壳蛋白(nucleoprotein,N)基因,选用我国疾病控制与预防中心推荐使用的引物及荧光探针序列(表1)。

表1 N基因的引物探针序列Table 1 The sequences of primers and probe of the N gene
1.3 实验方法
1.3.1 试剂盒中酶的逆转录性能考察以相同的新型冠状病毒RNA标准物质为检测靶标,进行逆转录实验,其中逆转录过程采用不同的逆转录酶,不同的逆转录酶产生不同浓度的cDNA。使用相同的DNA聚合酶(TOROIVD 5G qPCR Premix)进行实时荧光PCR扩增,每组实验进行3次重复,计算Ct值。将扩增后的Ct值代入以一个数字PCR准确定量的cDNA梯度稀释建立的qPCR工作曲线,得到不同逆转录产物cDNA的浓度,分析cDNA产物与目标RNA浓度的比值,从而比较逆转录效率。
1.3.2 试剂盒中酶的PCR性能考察使用1.3.1
中最优的逆转录酶,逆转录得到相同cDNA,进行10倍系列梯度稀释后(以降低缓冲液对下一步PCR酶的影响),使用6种不同新冠病毒检测试剂盒中的DNA聚合酶进行实时荧光PCR扩增,每组实验进行3次重复,计算Ct值并绘制相应的标准曲线,并比较PCR扩增效率。
1.3.3 试剂盒的RT-PCR性能考察使用6种不同试剂盒中的酶和缓冲液,以10倍梯度稀释的RNA标准物质为模板,进行RT-PCR实验,每组实验进行3次重复,计算Ct值并绘制标准曲线,对试剂盒的RT-PCR性能进行比较。
1.3.4 试剂盒中酶的热稳定考察分别将6种不同核酸检测试剂盒中的酶放置于37℃条件下1、3、5、7 d后,将低浓度的RNA标准物质(11 copies·μL−1)进行逆转录−实时荧光PCR扩增,比较实验结果,考察不同酶的热稳定性。
2 结果与分析
2.1 试剂盒中逆转录酶的性能评价
本实验以相同的RNA标准物质为检测靶标,进行逆转录实验,其中逆转录过程采用不同的逆转录酶,不同的逆转录酶将会产生不同浓度的cDNA,采用实时荧光定量PCR对cDNA浓度进行定量分析,在PCR扩增效率相同的情况下,逆转录产物(cDNA)含量越高,说明逆转录效率越高,比较逆转录效率。
实验过程中,首先建立实时荧光定量PCR的标准曲线(标准样品是经微滴式数字PCR定量的DNA):y=−3.39 lg(x)+32.75。代入6个不同逆转录产物cDNA的Ct值,计算出6种酶产生的cDNA的浓度,与靶标RNA标准物质浓度(11 copies·μL−1)相比,得到不同酶的相对逆转录效率。如图2所示,6种酶的相对逆转录效率为6.5%~80.7%。通过逆转录性能考察实验,发现所有试剂盒中的酶均能对RNA标准物质的N基因进行有效的逆转录,但F试剂盒逆转录效率计算值最低;F试剂检测相同RNA浓度水平下的Ct值均高于其他试剂盒,在逆转录效率极低的情况下,会导致Ct值升至太高从而有未检出的结果。
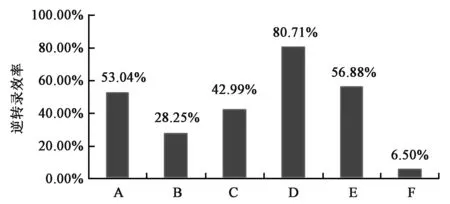
图2 不同酶的逆转录评价Fig.2 Evaluation of reverse transcription of different enzymes
2.2 试剂盒中酶的PCR扩增性能评价
本实验使用相同的cDNA样品,进行10倍梯度稀释,再使用6种新冠核酸检测试剂盒中的DNA聚合酶以梯度稀释的cDNA为模板进行PCR扩增,PCR扩增效率计算的经典公式如下。

其中k为标准曲线方程的斜率[14]。
如图3所示,以相同浓度的cDNA为模板进行扩增检测,6种酶的线性系数均超过0.99,扩增效率为90.4%~119.7%,其中试剂盒D扩增效率最接近100%,且对低浓度cDNA扩增的Ct值也较小,PCR扩增效率相对最优。而试剂盒E扩增后的Ct值大,扩增能力较差。试剂盒E计算的扩增效率高达119.7%,分析原因为酶的活性低或酶的活性易受到抑制剂的影响,当样品浓度过高,PCR扩增时DNA模板不能翻倍复制,导致Ct值增加;当浓度逐渐降低时,酶的活性可使DNA模板翻倍复制,或者抑制剂的浓度降低对酶的活性影响变小,因此,低浓度10倍稀释模板的Ct值差值较小,计算出的扩增效率较高,但其在整个浓度范围的DNA聚合酶功能较差。

图3 不同DNA聚合酶的PCR性能评价Fig.3 PCR performance evaluation of different DNA polymerases
2.3 试剂盒2种酶的整体RT-PCR性能评价
新冠病毒核酸检测试剂盒是将逆转录酶和DNA聚合酶2种功能整合于一个检测体系中,本研究中,使用RNA标准物质为检测目标,整体评价检测试剂盒的RT-PCR性能。使用6种RT-PCR试剂盒中的2种酶,用相同的引物探针,进行RT-PCR扩增,建立标准曲线方程,根据扩增效率和低浓度扩增效果,从整体评判这6种试剂盒中酶的性能。6种试剂盒的整体逆转录PCR效率均符合线性的标准曲线R2>0.980,扩增效率为90%~105%。说明所选RT-PCR试剂盒均可以针对新冠N基因进行RT-PCR扩增,但整体的逆转录扩增效率和R2仍有一定差异。如图4所示,本实验所用的6种酶均能对RNA标准物质进行有效扩增。其中试剂盒E和试剂盒F的扩增效率较低,与实验2.1、2.2中结果一致:F试剂盒的逆转录效率相对最低,E试剂盒的PCR扩增能力最低。

图4 不同试剂盒的RT-PCR评价Fig.4 RT-PCR evaluation of different enzymes
2.4 酶的热稳定性研究
除了逆转录效率及PCR效率外,酶本身的保存温度、热稳定性等性能也会影响试剂盒的检测结果。本研究选用的酶储存温度均为−20℃,有效期均大于6个月。然而考虑到试剂盒运输过程中的实际温度可能大于20℃,本实验采用热稳定加速实验,将试剂置于37℃恒温条件进行考察。如图5所示,不同酶的37℃热稳定性不同。低浓度的RNA标准物质进行RT-PCR后测得的Ct值随着天数的增加而增大,表明在37℃恒温条件下,6种酶的活性均下降,其中C、D试剂盒在37℃恒温条件下放置3 d后,样品无法正常扩增。A、B、F试剂盒在37℃恒温条件下放置7 d后,阳性样品能扩增,但扩增Ct值增大。结果表明,试剂盒中的酶经过长时间的高温运输或者由于操作不当暴露于较高温度环境时,有可能造成最后实验结果的假阴性等不良后果,因此,需对酶的热稳定性进行控制,并保证试剂盒低温运输。
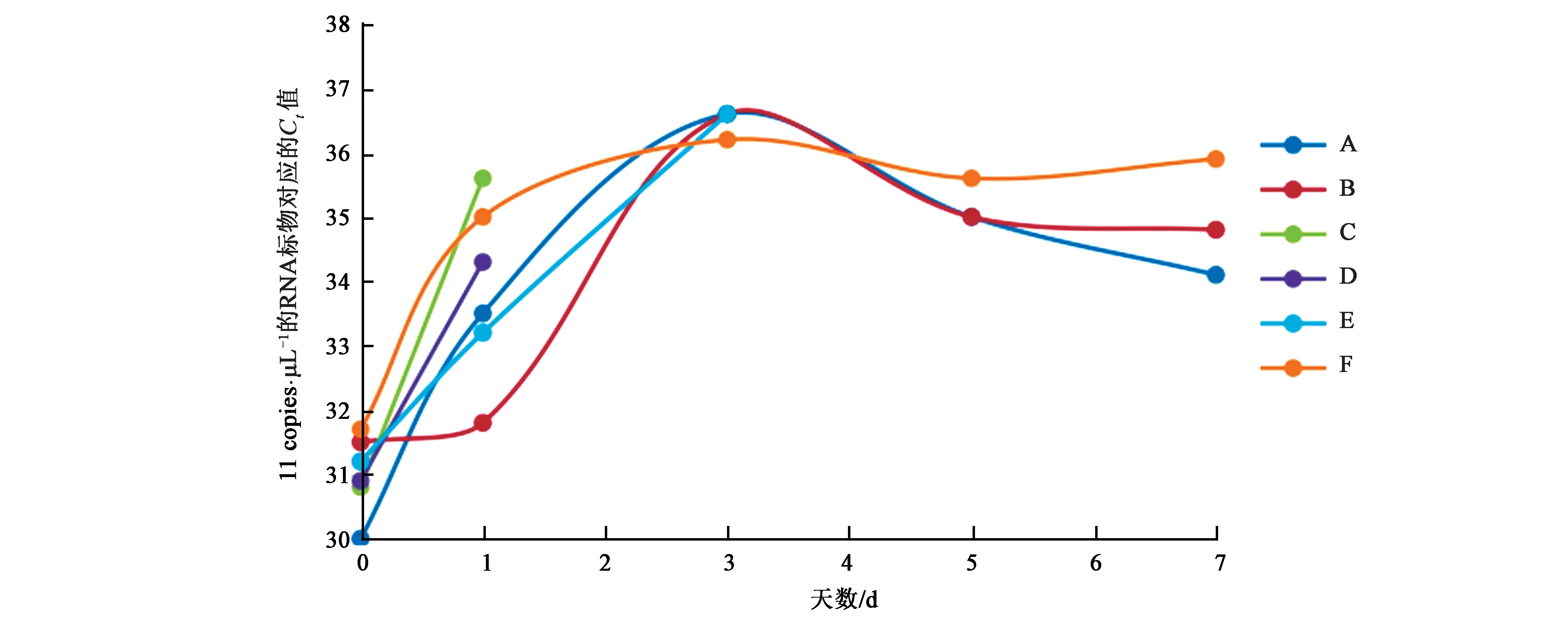
图5 不同酶的热稳定性评价Fig.5 Thermal stability evaluations of different RT-PCR enzymes.
3 讨论
《2019新型冠状病毒核酸检测试剂注册技术审评要点》中明确指出,制备厂家需提供主要原材料的选择、来源、制备过程、质量标准等相关研究资料,主要原料包括引物、探针、酶、dNTP等。其中最主要的是对酶活性、功能性等进行评价和验证。也有文献[15]研究表明,核酸检测试剂盒的质量问题是导致检测结果假阴性的重要原因之一。因此,本实验采用中国疾病预防控制中心推荐的N基因的引物及荧光探针序列,以新型冠状病毒体外转录RNA标准物质为模板,解决了质控这一关键问题[15],从6种核酸检测试剂盒中逆转录酶的逆转录效率、PCR反应中的DNA聚合酶性能、整体RT-PCR性能、热稳定性等方面进行探讨,旨在建立核酸检测试剂盒中关键酶的质量控制评价方法,确保试剂盒核心原料的质量,为生产合格的病毒核酸检测试剂盒提供技术保障。
结合3个实验,可得出以下结论:RT-PCR试剂盒的RT-PCR整体效率,可通过逆转录效率和PCR效率2个方面进行判断,三者有显著相关性。如A、C试剂盒的整体扩增效率,相关系数良好,而其逆转录和PCR扩增的效率和相关系数也较理想。而E、F试剂盒的整体扩增效率,相关系数相对较差。分别评价其逆转录酶和DNA聚合酶活性,发现F试剂盒逆转录效率较低,导致其Ct值比其他试剂盒高2~3个循环,且PCR酶活性也较低。而试剂E的问题主要在DNA聚合酶上,可重点通过优化聚合酶的活性提高整个反应体系的扩增性能。
除逆转录效率及PCR效率外,酶热稳定性也是其重要特性之一。本实验数据显示,随着加热时间的延长,低浓度(11 copie·μL−1)RNA标物的测得Ct值升高甚至检测不出,说明温度对RT-PCR的性能影响较大。RT-PCR整体性能相对较好的A、B试剂盒和相对不理想的F试剂盒,在热稳定性方面均较佳,这说明RT-PCR整体性能与热稳定性无明显相关性,但热稳定性差的酶经过长时间的高温运输,或者由于操作不当暴露于较高温度环境时,可能造成最后实验结果的假阴性等不良后果。
本研究从酶的逆转录效率、PCR扩增效率、热稳定性的性能进行实验和探讨,最终得到RT-PCR试剂盒中酶的质量评价方法,结果显示,该方法有助于提高基于RT-PCR原理的核酸检测试剂盒质量,降低经济成本和检测时间,有效地保证人民群众的身体健康和生命安全。
