苯磺酸左旋氨氯地平对肾大部切除自发性高血压模型大鼠肾脏的保护作用*
2021-12-01王玉洁
侯 静,蔺 艳,刘 勇,王玉洁
(1.西南医科大学附属医院,四川 泸州 646000; 2.西南医科大学肿瘤研究所,四川 泸州 646000)
自发性高血压(SH)是以体循环动脉压升高为特征的综合征[1],若不及时干预,会影响心、脑、肾等重要脏器的功能,甚至引发器官功能衰竭,需尽早治疗,以减少终末事件的发生,保护靶器官,促使血压长期达标[2]。目前常用药物为钙离子拮抗剂,苯磺酸左旋氨氯地平属长效二氢吡啶类钙离子拮抗剂,钙拮抗活性是消旋体的2倍、右旋体的1000倍,能通过改变细胞膜电位,减少钙离子内流,扩张外周小动脉,舒张血管平滑肌,降低外周血管阻力,促使血压下降[3]。有学者发现,钙拮抗剂在降低血压的同时,还可减轻对肾小球的损害,在一定程度上降低缺血带来的危险和减少局部自由基形成,缓解软组织钙化[4],但有待进一步证实。本研究中对比了常规剂量、大剂量用药对肾大部(5/6)切除SH模型大鼠肾脏功能的影响,为后期临床保护残余肾功能提供参考。现报道如下。
1 材料与方法
1.1 仪器、试药与动物
仪器:FinePointe NAM型无创实验动物测试仪(美国Buxco公司);7170A型全自动生化分析仪(日本Hitachi公司);Olympus CX33型显微镜(南京贝登医疗股份有限公司);TG18KR型离心机(上海舜制仪器制造公司);DN20-600型三通管-电极-生命信息处理系统(河北鼎航管道制造有限公司)。
试药:苯磺酸左旋氨氯地平片(施慧达药业集团,批号为180131,规格为每片2.5 mg)、10%水合氯醛(上海山浦化工有限公司,批号121004);肿瘤坏死因子-α(TNF-α)试剂盒(解放军总医院放免研究所,批号20080820),白 细 胞 介 素6(IL-6)试 剂 盒(批 号 为170894)、超敏C反应蛋白(hs-CRP)试剂盒(批号为171094),均购自北京晶美公司;丙二醛(MDA)试剂盒(中山生物工程公司,批号为2000427),超氧化物歧化酶(SOD)试剂盒(英科新创科技有限公司,批号为2010015113),血清肌酐(SCr)试剂盒(上海华科生物工程股份有限公司,批号为20100112),血尿素氮(BUN)试剂盒(珠海珠厦药集团股份有限公司,批号为20100205)。PAS,苏木素-伊红(HE)染色试剂盒。
动物:选取2018年2月至2019年5月福州医科大学实验动物中心生产的雄性SH大鼠40只,均为16周龄,平均体质量(204.56±15.45)g。实验动物使用许可证号SYXK(闽)2016-0006;适应性喂养7 d,饲养笼相对湿度(65.2±8.1)%、温度(22.5±2.13)℃,保持良好通风和12 h黑暗/光照周期交替。每周更换1次高压消毒垫料,自由饮水(饮用水需高温高压消毒)、摄食。严格按国家科学技术委员会《实验动物管理条例》进行实验。
1.2 建模、分组与给药
将40只大鼠随机分为手术组(30只)和假手术组(A组,等体积蒸馏水,10只)。A组剥离肾包膜,暴露肾脏,关腹。手术组大鼠予10%水合氯醛麻醉后行背左侧切口,充分暴露左肾,将肾周围脂肪囊分离,结扎、离断上下极肾组织(如出血明显,用明胶海绵压迫片刻),最后复位肾脏后缝合切口,使结扎的肾脏因缺血而梗死;14 d后,采取同样麻醉方式,切开右侧背部,结扎肾蒂,切除右肾,2次手术需保证切除5/6肾脏。术后2周将手术组大鼠按体质量分层随机分为模型组(B组,等体积蒸馏水,10只),低剂量组[C1组,2.5 mg/(kg·d)苯磺酸左旋氨氯地平,10只],高剂量组[C2组,5.0 mg/(kg·d)苯磺酸左旋氨氯地平,10只]。各组大鼠均于每日上午9:00灌胃给药1次,持续6周。
1.3 观察指标
尾动脉收缩压:分别在干预前(0周)及干预后1,2,4,6周上午8:00-10:30监测。将大鼠固定于仪器配套的鼠笼内,提前预热15 min,待大鼠安静后,将其尾巴根部放于套袖中,按压,以每次20~30 mmHg(1 mmHg=0.133 kPa)的速率自动加压至脉搏波消失,维持5 s松气,收缩压为第1次波型,连续监测5次,每次间隔3 min,取平均值。
颈动脉压:术前禁饮8 h。测定前腹腔注射10%水合氯醛(0.35%/100 g),大鼠麻醉后固定于解剖台上,保持平卧位,剪去颈部正中范围毛发,逐层钝性分离组织直至颈总动脉,用手术缝线结扎远端血管,夹住近端血管,挑起血管,在血管上剪一斜口,肝素冲管,再连接三通管-电极-生命信息处理系统,缝线固定,松开动脉夹,待血压稳定后记录颈动脉压。
24 h尿蛋白定量:干预前后分别收集代谢笼中大鼠24 h尿量,采用双缩脲法检测尿蛋白定量。
血生化指标和残余肾功能:测定颈动脉压后,打开腹腔,行腹主动脉采血,将收集的血清静置30 min后3000r/min离心15min,收集上清液,置-80℃冰箱保存。检测IL-6,hs-CRP,TNF-α,MDA,SOD,SCr,BUN水平。
肾组织形态学变化:迅速摘取各组大鼠肾脏,剥离筋膜,肉眼观察大体肾脏形态。并处理好肾脏组织后,纵向切开,取1/2组织放入甲醛内固定,用于病理切片PAS染色及HE染色。
1.4 统计学处理
2 结果
2.1 尾动脉收缩压
与A组干预后比较,B组大鼠同时段的尾动脉收缩压明显升高(P<0.05);与B组同时段比较,C1组和C2组大鼠尾动脉收缩压明显降低(P<0.05)。详见表1。
表1 各组大鼠尾动脉收缩压比较(±s,mmHg,n=10)Tab.1 Comparison of SBP of rat′s caudal artery in each group(±s,mmHg,n=10)

表1 各组大鼠尾动脉收缩压比较(±s,mmHg,n=10)Tab.1 Comparison of SBP of rat′s caudal artery in each group(±s,mmHg,n=10)
注:与A组比较,*P<0.05;与B组比较,#P<0.05。下表同。Note:Compared with those in group A,*P<0.05;Compared with those in group B,#P<0.05;as well as the following tables.
组别剂量(mg/kg)给药前给药后1周给药后2周给药后4周给药后6周A组B组C1组C2组2.55.0151.22±7.16162.58±8.46162.29±8.31162.37±8.32151.23±6.65157.63±7.49*130.65±5.46#126.39±6.35#150.45±6.35157.23±6.65*127.65±6.65#121.41±6.32#150.36±5.42157.46±7.65*124.46±5.36#120.49±6.32#150.62±5.68157.63±8.46*120.13±5.14#117.45±5.26#
2.2 颈动脉压
与A组干预后比较,B组大鼠颈动脉压明显升高(P<0.05);与B组干预后比较,C1组和C2组大鼠颈动脉压明显降低(P<0.05)。详见表2。
表2 各组大鼠颈动脉压比较(±s,mmHg,n=10)Tab.2 Comparison of rat′s carotid pressure in each group(±s,mmHg,n=10)

表2 各组大鼠颈动脉压比较(±s,mmHg,n=10)Tab.2 Comparison of rat′s carotid pressure in each group(±s,mmHg,n=10)
组别A组B组C1组C2组剂量(mg/kg)2.55.0给药前142.96±5.32153.36±10.23153.39±10.41153.87±10.56给药后6周142.23±6.65155.13±11.65*110.13±10.14#99.45±5.26#
2.3 血生化指标
与A组干预后比较,B组大鼠血清hs-CRP,IL-6,TNF-α,MDA水平均明显升高,SOD水平明显降低(P<0.05);与B组干预后比较,C1组、C2组大鼠血清hs-CRP,IL-6,TNF-α,MDA水平均明显降低,SOD明显升高(P<0.05)。详见表3。
表3 各组大鼠血生化指标比较(±s,n=10)Tab.3 Comparison of blood biochemical indexes of rats in each group(±s,n=10)
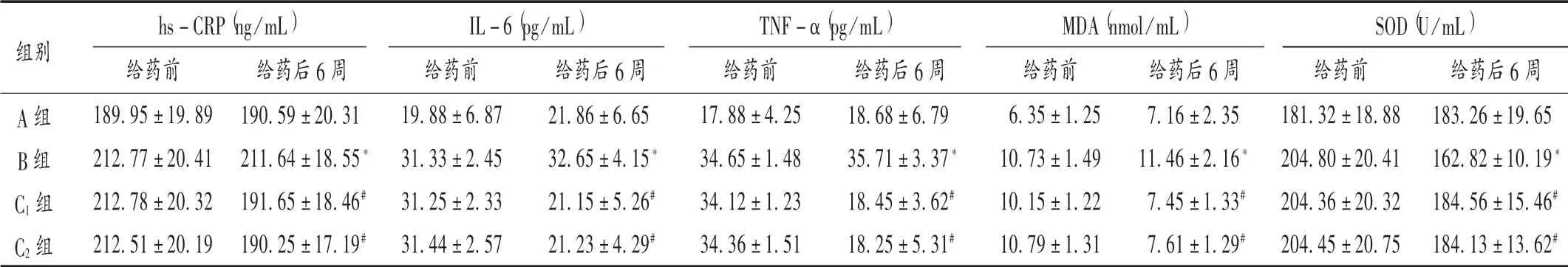
表3 各组大鼠血生化指标比较(±s,n=10)Tab.3 Comparison of blood biochemical indexes of rats in each group(±s,n=10)
hs-CRP(ng/mL) IL-6(pg/mL) TNF-α(pg/mL) MDA(nmol/mL) SOD(U/mL)组别A组B组C1组C2组给药前189.95±19.89212.77±20.41212.78±20.32212.51±20.19给药后6周190.59±20.31211.64±18.55*191.65±18.46#190.25±17.19#给药前19.88±6.8731.33±2.4531.25±2.3331.44±2.57给药后6周21.86±6.6532.65±4.15*21.15±5.26#21.23±4.29#给药前17.88±4.2534.65±1.4834.12±1.2334.36±1.51给药后6周18.68±6.7935.71±3.37*18.45±3.62#18.25±5.31#给药前6.35±1.2510.73±1.4910.15±1.2210.79±1.31给药后6周7.16±2.3511.46±2.16*7.45±1.33#7.61±1.29#给药前181.32±18.88204.80±20.41204.36±20.32204.45±20.75给药后6周183.26±19.65162.82±10.19*184.56±15.46#184.13±13.62#
2.4 残余肾功能
与A组干预后比较,B组大鼠SCr,BUN,24 h蛋白定量均明显升高(P<0.05);与B组干预后比较,C1组、C2组大鼠SCr,BUN,24 h蛋白定量均明显降低(P<0.05)。详见表4。
表4 各组大鼠残余肾功能比较(n=10)Tab.4 Comparison of residual renal function of rats in each group(±s,n=10)

表4 各组大鼠残余肾功能比较(n=10)Tab.4 Comparison of residual renal function of rats in each group(±s,n=10)
SCr(μmol/L) BUN(mg/dl) 24 h蛋白定量(mg)组别剂量(mg/kg)A组B组C1组C2组2.55.0给药前120.95±10.52133.13±7.29133.52±7.86133.73±7.66给药后6周120.01±8.15155.51±7.49*121.25±7.86#121.68±9.74#给药前25.53±5.4532.35±6.5532.69±6.5332.27±6.41给药后6周25.46±6.5437.55±3.35*26.69±6.53#25.45±7.19#给药前25.58±7.2435.49±5.1935.63±5.1935.32±5.22给药后6周25.58±7.2438.14±5.56*26.63±4.19#26.26±8.44#
2.5 肾组织形态学观察
由图1可见,HE染色下,A组、C1组、C2组的残肾病理切片镜下可见肾小球节段性硬化,且增生程度不一,属基质增生。PAS染色下,A组残肾病理切片镜下可见肾小球内微小血栓形成,全球硬化,周围炎性细胞浸润,偶见球囊粘连;C1组可见肾小管-间质呈慢性病理改变,肾小管上皮细胞空泡变性及蛋白管型,肾间质纤维化及炎性细胞浸润,多灶状的肾小管萎缩;C2组可见肾小球硬化呈局灶节段性,囊腔变大或消失。

图1 大鼠肾脏组织病理图(×400)a.group A b.group B c.group C1 d.group C2 A.HE staining B.PAS stainingFig.1 Histopathology of rat′s kidney(×400)
3 讨论
SH危害性较大,若血压长期不达标,可造成靶器官损害,甚至致残、致死[5]。SH已成为终末期肾功能衰竭的主要病因之一,且我国高血压患者常合并肾功能损害,血压控制不佳将加剧肾功能损害,需合理用药以减少靶器官损害[6-7]。本研究中肾大部切除SH模型大鼠为实验对象,建模过程与人类慢性肾脏疾病的进展过程类似,操作相对简单、经济[8]。
肾间质纤维化与肾脏细胞凋亡增多相关,而钙离子拮抗剂能抑制肾脏细胞凋亡[9]。苯磺酸左旋氨氯地平作用于肾出球小动脉和入球小动脉,能改善残余肾单位高代谢状态时,但不会改变肾小球膜通透性,还可阻止钙离子进入肾细胞内引起肾功能损害,有效降低去甲肾上腺素和血管紧张素Ⅱ对肾内的损害,有保护肾功能的作用[10-11]。本研究结果显示,C1组、C2组大鼠的SCr,BUN,24 h蛋白定量高于A组、B组,且C2组明显高于C1组,说明用药干预后模型大鼠肾功能明显改善。主要因为苯磺酸左旋氨氯地平在降压期间并不会减少肾脏血流量,即便在达到降压目标值时,也不会影响血流动力学,可减轻对肾功能的影响[12-13];其大剂量使用可更好地消除氧自由基,在一定程度上减少肾实质缺血危险,阻止局部自由基形成,缓解软组织钙化,有效保护肾脏功能[14-15]。
高血压肾损伤表现为系膜基质增生、肾小球硬化,血管活性物质平衡失调,炎性因子水平增加,血压升高[16]。本研究结果显示,C1组、C2组大鼠尾动脉收缩压、颈动脉压,以及hs-CRP,IL-6,TNF-α,MDA的降低幅度均明显大于A组和B组,说明苯磺酸左旋氨氯地平在抑制血管平滑肌细胞迁移、稳定血压、改善炎性因子水平中有一定作用。推测可能是该药中左旋体成分能在蛋白及转录水平中降低炎性反应,有效保护靶器官[17]。C1组、C2组血压、血生化指标比较无显著差异,表明苯磺酸左旋氨氯地平降压效果不受剂量影响。
综上所述,苯磺酸左旋氨氯地平可保护5/6肾切除SH模型大鼠的残余肾功能。但由于本研究样本量少,无法反映总体趋势,故需后期扩大样本进一步研究。
