Runx2在下颌髁突软骨发育、改建中的作用研究进展
2021-12-01杜昳阳冯剑颖
杜昳阳,冯剑颖
下颌髁突软骨(mandibular condylar cartilage,MCC)来源于未分化的间充质干细胞,属继发性纤维软骨,具有独特的生物学特征[1]。MCC的正常生长发育、改建受多种因子的作用,其中Runt相关转录因子2(Runx2)就是关键调控因子之一。Runx2,也称AML3、Cbfa1 或Pep2αA,是Runt家族的一份子,位于人类6号染色体(6p21)和小鼠17号染色体上,通过与启动区域结合来影响靶基因,已知的成骨特异性基因有Ⅰ型胶原、骨钙素、骨唾液蛋白或骨桥蛋白等[2]。目前,Runx2在骨和软骨中的作用已有广泛的研究,但对Runx2在MCC中的作用及机制仍有待深入开展。现通过回顾文献,围绕Runx2在MCC生长发育、改建中的作用及Runx2的临床应用前景进行综述。
1 Runx2与髁突软骨的生长发育
1.1 Runx2在髁突软骨发育中的时空表达
MCC的生长发育受基因和关节局部理化因素调控,Runx2就是关键调控因子之一。张渊岫等[3]研究Runx2在不同时期小鼠髁突中的表达,发现胚胎14.5 d(E14.5)~胚胎15.5 d(E15.5)Runx2开始表达,出生后下降,出生1.5 d(P1.5)上升,后复下降,表达曲线表明Runx2在髁突生长发育过程中的不同阶段发挥不同的调节作用。
Runx2的表达有时间依从性。通过大鼠胚胎研究发现,Runx2 mRNA首先在E11.5的下颌血管中表达,随后在E13.5的髁突后缘检测到[4]。Shimizu等[5]发现在E14、E15软骨细胞的胞质中出现Runx2 mRNA,E16~E18几乎所有的胞质中都能检测到Runx2 mRNA。Runx2在软骨细胞中的表达随着软骨细胞的成熟而增加,在E13.5肥大软骨细胞中检测到,E14.5~E16.5表达最突出[6],并在终末肥大软骨细胞中广泛表达。在出生后4~12周龄兔髁突明显增大,Runx2的蛋白质表达也维持在高水平[7]。以上都提示Runx2在MCC发育特定时期发挥作用。Rabie等[8]也发现在MCC的自然发育过程中,Runx2表达水平峰值与软骨细胞肥大和基质矿化相吻合。
Runx2的分布也有一定的空间依从性。在大鼠出生后一周,在髁突增殖层、前肥大软骨细胞层及肥大层细胞都能观察到Runx2阳性信号[3],这表明Runx2在髁突早期生长过程中发挥作用。Runx2在髁突前、后部的表达较上部高[9],正常情况下髁突前斜面不断吸收,后斜面增生,前、后部的生长发育活动活跃,这表明Runx2的分布规律与髁突的正常生长发育规律相符合。
1.2 Runx2在髁突软骨发育中的作用
Runx2对MCC软骨细胞增殖、成熟和分化至关重要。Runx2直接诱导印度刺猬蛋白(Indianhedgehog,Ihh)表达,从而促进软骨细胞增殖。Ihh是调控软骨细胞活跃的机械反应性因子,是软骨细胞增殖、肥大、分化和凋亡的关键性因子,也是MCC机械力学传导的重要蛋白[10]。Ihh对下颌髁突生长和关节盘形成至关重要,缺乏会引起髁突紊乱和生长迟缓[11],幼年小鼠剔除Ihh会损害MCC形成与功能[12]。
高表达的Ihh有效诱导软骨细胞分泌甲状旁腺激素相关蛋白(parathyroid hormone-related protein, PTHrP),形成Ihh-PTHrP负反馈环路[13],Ihh位于环路上游,PTHrP位于环路下游[14]。PTHrP进而抑制Runx2的表达,并将软骨细胞维持在增殖状态[15],减少软骨细胞向肥大软骨细胞的分化,负反馈环路控制着生长板中增殖软骨细胞和肥大软骨细胞的相对比例[16],从而影响软骨细胞成熟、分化过程。此外,Runx2调节肥大软骨细胞Col10a1、 Spp1、IBSP和VEGF-A的表达[13],从而影响软骨细胞成熟分化和血管侵入过程。(图1)
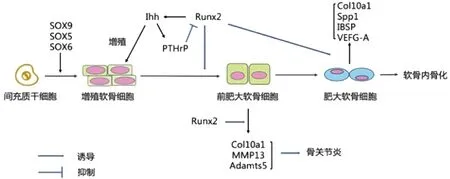
图1 Runx2对软骨细胞的调节Fig.1 Regulation of Runx2 on chondrocytes
Runx2也参与了Wnt/β-catenin 信号通路,该通路激活Runx2介导软骨细胞肥大,进而诱导Col10a1的表达[17],也通过抑制PTHrP信号传导活性来调节软骨细胞肥大过程[18]。软骨细胞肥大是由Wnt/β-catenin和Ihh/PTHrP信号通路差异调节,肥大软骨细胞的终末成熟由Wnt/β-catenin信号传导控制。
此外,在成年大鼠髁突软骨骨化区成骨细胞、内皮细胞、血管周细胞中均可发现Runx2的阳性信号,这说明Runx2在髁突软骨内骨化过程中的钙化和血管侵入发挥作用[9]。 Runx2是软骨内骨化过程中成骨细胞分化和骨沉积必不可少因素[19]。MCC软骨细胞可在生长发育过程中直接转化为骨细胞从而参与软骨内骨化[20],Runx2可以正向调节软骨细胞成熟分化和软骨内骨化进程[21],体外实验表明,Runx2的过表达会导致软骨细胞过早成熟而引起软骨内骨化的加速,相反Runx2功能的干扰会抑制软骨细胞的成熟并延迟软骨内骨化[22]。
1.3 Runx2缺陷对髁突软骨生长发育的影响
Runx2缺陷小鼠,MCC完全消失而原发性软骨未受明显影响[23]。Runx2缺陷小鼠的整个骨骼由软骨组成,软骨细胞成熟紊乱,且也未能通过Runx2诱导软骨血管形成和浸润。肥大软骨细胞依旧表达Col10a1、BMP6和Ihh,但未见骨桥蛋白、骨唾液蛋白和MMP13表达[6],说明以上因子在终末肥大软骨细胞中直接受Runx2调控。使用骨形态发生蛋白2(BMP2)在Runx2缺陷小鼠的下颌外植体进行器官培养,并未发现MCC软骨细胞肥大[24]。剔除产后小鼠软骨细胞中的Runx2,评估其对MCC生长和重塑的影响,结果显示Runx2缺乏会引起髁突组织紊乱,包括肥大软骨细胞缺乏、增殖软骨细胞减少和软骨基质生成减少,Col10a1、MMP13、Col2a1和Ihh的表达也明显降低[25]。以上均表明Runx2是MCC中软骨细胞增殖、肥大以及产后颞下颌关节(TMJ)生长和体内稳态所必需的。
2 Runx2与髁突软骨改建、病变
MCC通过提供抗张强度和抗压强度[26],表现出对生物力学刺激较强的适应性能力[1]。下颌前移会导致MCC胞外基质中的细胞发生应变排列,Tang等[27]在大鼠口内安装功能矫治器模拟下颌前移,实验发现Runx2介导其髁突软骨内成骨过程。下颌前移上调MCC中Runx2的表达,促进软骨细胞肥大和终末成熟,促进Col10a1的合成和VEGF的表达,从而介导软骨内成骨过程。不同作用方式及作用时间的下颌前伸力也可以差异性调节MCC软骨细胞Runx2的表达水平[28]。Runx2是机械信号的靶标,机械负荷通过诱导软骨下成骨细胞中Runx2的表达来发生应变反应[29]。MCC软骨细胞在100 kPa静压力下暴露3至4 h,可检测到Runx2显著增加,激活Ihh和PTHrP的表达[30],这表明关节内压力负荷可通过Runx2信号通路调节MCC软骨分化和软骨内成骨进程。
Runx2对 MCC具有双重作用,Runx2会通过调控细胞粘合素的表达影响病理性软骨细胞的增生,诱导软骨细胞中Col10a1,MMP13和Adamts5的表达降解关节软骨基质,参与骨关节炎(osteoarthritis,OA)进程[13]。机械不稳定性也会诱导Runx2表达从而引起MCC软骨细胞的病理性肥厚,激活MMP13,引起OA[31]。MMP13在OA软骨中表达增强,而且在活动状态时MMP13的过表达会导致OA样改变,下调MMP13可以延迟实验性OA的发展[32]。此外,Runx2基因中的两位点也已被证实为OA发展的易感位点[32]。
3 Runx2的应用与前景
Runx2在髁突增生和髁突软骨瘤标本的鉴别诊断中很有价值,尽管两者都可以检测到Runx2的高度表达,但在髁突增生标本中表达明显更高[33]。研究发现Ihh信号与异常机械负荷相结合可加速TMJ病理进展[34]。对Runx2介导信号通路的研究有助于为髁突发育、改建和软骨瘤诊治提供新的思路。
在椎间盘(IVD)变性的小鼠模型中可检测到Runx2的过表达,IVD变性的人类患者中Runx2的表达也明显上调,这证实了Runx2通过诱导软骨细胞肥大而有助于IVD变性的发病机制[21],考虑到IVD变性的发病率,对Runx2或其下游基因的活性、表达进行控制可能可以作为针对此类型疾病的新型疗法[21]。目前也有研究成功通过抑制软骨细胞中的Runx2表达来挽救成年小鼠内侧半月板诱导的OA样缺陷[35],Runx2慢病毒转染间充质干细胞也能促进OA关节损伤修复[36],这都为临床治疗提供新的方向。
4 结 语
综上所述 ,Runx2调节软骨细胞增殖、成熟分化和软骨内骨化过程,是MCC生长发育、改建的关键转录因子。Runx2也是参与下颌髁突软骨病理改建中的重要因子,和Ihh、PTHrP、Wnt、TGF-β、MMP13等一起发挥作用,影响颞下颌关节病的病程转归。但Runx2应用于临床髁突软骨修复的相关研究还有待深入。
