不同光照强度对糜子叶色黄化突变体幼苗的影响
2021-12-01靳丰璐陈利青张晋丽王俊杰李红英韩渊怀张彬
靳丰璐,陈利青,张晋丽,王俊杰,李红英,韩渊怀,张彬
(山西农业大学 农学院,山西 太谷 030801)
糜子(Panicum miliaceumL.)为一年生禾本科黍属植物,是西北地区重要的粮食和经济作物[1]。作为起源于中国最古老的农作物之一,糜子具有耐旱、耐瘠和生育期短等优点,有稳定的生产力和良好的经济效益,在旱作农业和抗灾救灾中具有不可替代的作用[2]。糜子脱壳后称黍米,富含多种营养元素,食用价值高,还具有较高药用价值,可以预防癌症、心脏病和糖尿病等疾病[3]。作为典型的高光合C4作物,糜子更适应干旱的环境,是干旱半干旱地区的优质主粮替代作物之一[4],因此,筛选并培育优质糜子品种已逐渐进入科学家的视野。
变异是生物进化的重要推动力,突变体可以为基因功能的研究提供材料[5]。植物变异包括自然变异和人工诱变2 大类。自然诱变的发生频率极低,人工理化诱变是目前种质资源创新的常用方法[6]。其中,甲基磺酸乙酯(EMS)化学诱变因其价格低廉、操作简单、诱变率高、染色体畸变少和突变稳定等优点,已被广泛应用于谷子[7]、高粱[8]及小麦[9]等多种作物的诱变育种中,并取得显著成效。
叶色突变是植物界发生频率较高、变异来源广泛、表型直观明显的性状突变,叶色突变表现形式多样,常表现在叶片颜色的变化,如白化、黄化、黄绿、条纹等类型[10],其中叶片黄化最常见。植物叶色黄化突变体又称叶绿素缺乏突变体,通常因叶绿素的合成或降解途径被破坏造成[11],目前已在水稻[12]、番茄[13]和油菜[14]等作物中发现了黄化突变体。叶片是植物光合作用中重要的组织器官,叶片中叶绿素含量一定程度上决定了植物的光合效率。叶色突变基因可以直接或间接影响叶绿素合成或降解途径,不同程度的降低叶绿素含量,从而影响植物的光合作用,进而使植物发育减缓、长势减弱,最终造成植株减产甚至死亡[12]。叶色突变与光合色素变化有直接关系。多数研究表明,叶色突变会导致叶绿素和类胡萝卜素含量降低,总叶绿素含量下降[15]。光合色素代谢中酶的活性变化会影响光合色素合成,人们在叶绿素合成代谢方面进行了更深层次的探索。叶绿素前体物质是叶绿素合成过程的中间产物。高等植物叶绿素的合成共需15 步,其中任何一步受阻都会影响叶绿素含量[16]。在水稻黄化突变体W1中,胆色素原到尿卟啉原Ⅲ过程受阻,阻碍了叶绿素的合成[17]。根据光调控突变体发育可以将其分为依赖光诱导型和非依赖光诱导型[18]。光是光合作用的能量来源,光照强度是决定光合速率的关键因素之一。光照强度较弱时,随着光照强度的增强,植物的生长加快;光照强度较强时,随着光照强度的增强,植物的生长受到抑制。光照强度强弱都会影响叶绿素的合成,而光照过强可能导致光抑制和光氧化[19]。缺乏叶绿素时,光照过强对植物影响更大。
本研究选用野生型“伊选大红糜”和对其进行EMS 化学诱变得到的黄化突变体为试验材料,对不同光照条件下糜子苗期的农艺性状、光合色素以及叶绿素前体物质进行比较分析,探究糜子黄化突变体与野生型糜子的差异,旨在为糜子叶片叶绿素的合成研究提供参考,从生理生化水平明确突变体叶片的黄化机制,加快筛选优质糜子种质资源。
1 材料和方法
1. 1 试验材料
野生型“伊选大红糜”YX⁃0和黄化突变体YX⁃yl,由山西农业大学生物工程研究所提供,黄化突变体YX⁃yl为野生型“伊选大红糜”经甲基磺酸乙酯诱变,连续自交多代稳定遗传而来。
1. 2 试验方法
以野生型“伊选大红糜”YX⁃0为对照组,黄化突变体YX⁃yl为试验组,种植于育苗盘中。每个育苗盘野生型和突变体材料各一半,共种植9 盆。植株出苗时,将育苗盘转移到不同光照强度(9 600、12 000、14 400 lx)的人工气候培养箱中。待植株到苗期时进行农艺性状调查,测定光合色素含量和叶绿素前体物质含量。
1. 2. 1 农艺性状调查
以野生型“伊选大红糜”为对照材料,对黄化突变体的生长变异进行田间观察。出苗后14 d,分别选取各材料不同处理下长势一致的3 株,游标卡尺测量植株高度,软尺测量叶片长度和叶片宽度。
1. 2. 2 光合色素测定
出苗后14 d,分别在不同光照强度下选取长势一致的糜子野生型和黄化突变体进行取样,参考乙醇浸提法[20]测定叶片光合色素的含量。取样时选择倒二叶的叶片中部,去掉叶片中脉,称取0. 1 g,液氮充分研磨后,加入10 mL95% 乙醇,在摇床上充分摇匀至组织变白(注意避光)。光合色素含量测定时,离心取上清液作提取液,用95% 的乙醇为参照,分别在470、649、665 nm 波长下测定对应叶绿素提取液的吸光值。 计算叶绿素a(Chla)、叶绿素b(Chlb)、总叶绿素(Chl)、类胡萝卜素(Caro)的含量及叶绿素a/b 的值。每组设置3 个生物重复,每份提取液测定3 次作技术重复,下同。

1. 2. 3 叶绿素前体物质的测定
出苗后14 d,分别选取不同光照处理下长势一致的糜子野生型和黄化突变体,取倒二叶测定叶绿素前体物质。具体的测定方法如下。
(1) 胆色素原(PBG)的测定
参考Bogorad 等的方法[21],避开叶脉称取0. 5 g叶片,液氮充分研磨后加入5 mL 提取缓冲液(0. 1 mol·L-1EDTA,0. 6 mol·L-1Tris,盐酸调节pH 至8. 2)。离心后取2 mL 上清液与2 mL Ehrlich-Hg 显色液混合,黑暗条件下反应15 min。以提取缓冲液为参比,在553 nm 波长下测定样品的吸光值。PBG的含量以553 nm 的摩尔消光系数6. 1×104L·mol-1·cm-1计算。
A(PBG)=εCL(A:吸光值;ε:摩尔消光系数;C:摩尔浓度;L:测试液液层厚度)
(2) 5-氨基酮戊酸(ALA)的测定
参考Dei 等的方法[22],避开叶脉称取1 g 叶片,液氮充分研磨后加入三氯乙酸,定容至20 mL。离心后取5 mL 上清液,加入2. 35 mL 醋酸钠(1 mol·L-1)和0. 15 mL 乙酰丙酮混合液。 沸水浴加热10 min,冷却至室温,取2 mL 液体与2 mL Ehrlich-Hg显色液混合,黑暗条件下反应15 min。以三氯乙酸为参比,在553 nm 波长下测定样品的吸光值。ALA 的含量以553 nm 的摩尔消光系数7. 2×104L·mol-1·cm-1计算。
A(ALA)=εCL(A:吸光值;ε:摩尔消光系数;C:摩尔浓度;L:测试液液层厚度)
(3) 原卟啉Ⅸ(Proto Ⅸ)、镁原卟啉(Mg-Pro⁃to Ⅸ)和原脱植基叶绿素(Pchlide)的测定
参考Hodgins 等的方法[23],避开叶脉称取0. 5 g叶片,加入5 mL 80% 碱性丙酮于冰上充分研磨。离心后取3 mL 上清液加入80% 碱性丙酮,定容至25 mL。以80% 碱性丙酮为参比,分别在575、590、628 nm 波长下测定样品的吸光值。Proto Ⅸ、Mg-Proto Ⅸ和Pchlide 浓度的计算公式如下:

1. 3 统计分析
所有数据均使用Microsoft Excel 和SPSS 统计软件进行统计分析及作图,并对相关数据进行单因素方差分析(ANOVA)、Duncan 检验和Pearson 相关性检验。
2 结果与分析
2. 1 不同光照强度下野生型和黄化突变体幼苗农艺性状的分析
同一光照强度下,与野生型相比,黄化突变体幼苗叶片颜色明显变黄,叶长叶宽变窄,植株矮小,生长发育受到一定程度的抑制(图1)。 对出苗后14 d 的野生型和黄化突变体糜子农艺性状测量表明(表1),同一光照强度下突变体YX⁃yl的株高显著低于野生型YX ⁃ 0。 当光照强度为12 000 lx 和14 400 lx 时,突变体YX⁃yl的叶长显著高于9 600 lx光照条件下的叶长,而突变体YX⁃yl的叶宽显著变窄。这说明,与野生型相比,黄化突变体苗期的生长发育受到抑制,适当增加光照强度,可以促进黄化突变体的生长。

表1 不同光照强度农艺性状统计Table 1 Statistics of agronomic traits under different illumination intensities

图1 野生型和突变体糜子表型比较(左:野生型;右:黄化突变体)Fig.1 Comparison of phenotype between wild type YX⁃0 and mutant YX⁃yl(left:wild type YX⁃0;right:mutant YX⁃yl)
2. 2 不同光照强度下野生型糜子和黄化突变体幼苗叶片光合色素含量的分析
谷子叶片光合色素的含量直接影响叶片颜色[15],对出苗后14 d 的野生型和黄化突变体糜子的叶绿素a、叶绿素b 和类胡萝卜素含量进行测定发现,同一光照强度下,突变体YX⁃yl叶片中的叶绿素a 含量显著低于野生型YX⁃0(图2A)。 在9 600、12 000、14 400 lx 光照强度下,突变体YX⁃y1叶片中叶绿素a 的含量分别比野生型YX⁃0减少了20. 7%、18. 8% 和24. 5%,推测叶绿素a 含量的减少是黄化突变体叶色变化的原因之一。不同光照强度下叶绿素b 含量分析结果表明,在同一光照强度下,突变体YX ⁃ yl叶片中叶绿素b 的含量均低于野生型YX⁃0。在9 600、12 000、14 400 lx 光照强度下,突变体YX ⁃ yl叶片中叶绿素b 的含量分别比野生型YX⁃0减少了37. 3%、30. 1% 和32. 3%,差异不显著,但叶绿素b 含量的降低幅度更大,推测叶绿素b含量的减少对黄化突变体叶色变化的影响更大。叶绿素a/b 可以反映植物对光能利用的多少[24],分析结果表明(图2B),同一光照强度下,野生型YX⁃0和突变体YX⁃yl的叶绿素a/b 值均无显著差异。在9 600、12 000、14400 lx 光照强度下,突变体YX⁃yl的叶绿素a/b 分别比野生型YX ⁃0增加了9. 5%、17. 1% 和11. 4%,黄化突变体叶绿素b 的下降幅度大于叶绿素a。
光保护色素类胡萝卜素可以保护叶绿素免受氧自由基的破坏[25]。野生型和黄化突变体糜子出苗后14 d 的类胡萝卜素含量检测结果显示(图2C),同一光照强度下,突变体YX⁃yl叶片中类胡萝卜素含量均低于野生型YX⁃0,在12 000、14400 lx 光照强度下显著降低。与野生型YX ⁃0相比,9 600、12 000、14 400 lx 光照强度下,突变体YX⁃y1叶片类胡萝卜素的含量分别比野生型YX ⁃ 0减少了20. 0%、14. 2% 和23. 7%。结果说明,黄化突变体中类胡萝卜素的降低也是其叶色变化的原因之一。黄化突变体可能是一个总叶绿素缺乏突变体,其中叶绿素b 的降幅变化更大。
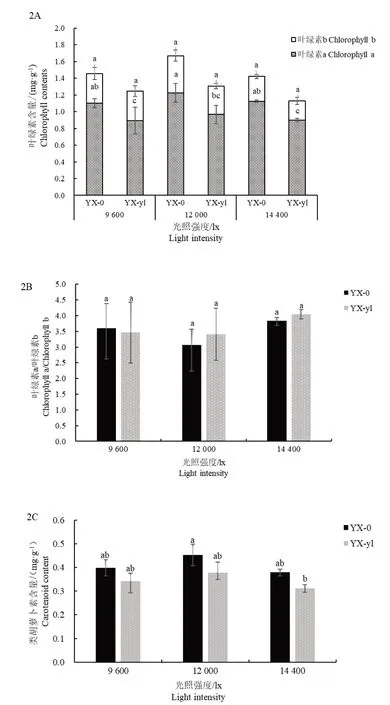
图2 不同光照下突变体YX⁃yl 与野生型YX⁃0 幼苗叶片光合色素比较Fig.2 Comparison of photosynthetic pigments in seedlings between mutant YX ⁃ yl and wild type YX ⁃ 0 under different illumination conditions
类胡萝卜素和叶绿素b 可以吸收光能并传递给叶绿素a,促进光能转化为有机物[25]。对野生型和黄化突变体糜子不同光照强度下的类胡萝卜素含量与叶绿素含量进一步分析发现,以12 000 lx 为对照,当光照强度增加或减弱时,野生型YX⁃0和突变体YX⁃yl的叶绿素a、叶绿素b 和类胡萝卜素含量均降低,且存在显著差异。光照强度减弱时,相较于野生型YX⁃0,突变体YX⁃yl的类胡萝卜素、叶绿素a、叶绿素b 含量的变化幅度更大。 其中,野生型YX⁃0的叶绿素a、叶绿素b 和类胡萝卜素含量分别下降了10. 0%、9. 5% 和7. 9%,突变体YX⁃yl的叶绿素a、叶绿素b 和类胡萝卜素含量分别下降了11. 7%、17. 3% 和16. 1%。由此,我们推测黄化突变体对光照强度的敏感性高于野生型,光合色素的合成受损促进了植株幼苗叶片的黄化。
2. 3 不同光照强度下野生型糜子和黄化突变体幼苗叶片叶绿体前体物质的分析
对出苗后14 d 几个关键叶绿素前体物质(ALA、PBG、Mg-Proto Ⅸ、Proto Ⅸ和Pchlide)含量的测定结果表明(图3~图5),在同一光照强度下,突变体YX⁃yl叶片的ALA、Mg-Proto Ⅸ、Proto Ⅸ和Pchlide 含量与野生型均有显著差异,而PBG 含量无显著差异。因此推测,黄化突变体叶绿素含量的减少不是某一特定中间产物合成受阻引起的,是整个叶绿素生物合成阶段合成能力降低导致的。
2. 3. 1 ALA 含量的测定
不同光照强度下,野生型YX⁃0和突变体YX⁃yl的ALA 含量均有显著差异(图3)。以12 000 lx 为对照,光照强度增加到14 400 lx 时,野生型YX⁃0和突变体YX⁃yl的ALA 含量分别减少了63. 3% 和16. 9%;光照强度减弱到9 600 lx 时,野生型YX⁃0的ALA 含量减少了60. 6%,而突变体YX ⁃ yl的ALA 含量增加了23. 5%。这说明,光照强度较弱时有利于突变体YX⁃ylALA 合成能力的增强。

图3 不同光照下突变体YX⁃yl 与野生型YX⁃0 幼苗叶片ALA 含量比较Fig.3 Comparison of ALA contents in seedlings between mutant YX⁃yl and wild type YX⁃0 under different il⁃lumination conditions
2. 3. 2 幼苗叶片PBG 含量的测定
不同光照强度下,野生型YX⁃0和突变体YX⁃yl的PBG 含量均差异显著(图4)。以12 000 lx 为对照,光照强度增加到14 400 lx 时,野生型YX⁃0和突变体YX⁃yl的PBG 含量均显著降低;而光照强度减弱到9 600 lx 时,野生型YX⁃0和突变体YX⁃yl的PBG 含量均显著增加。可见光照强度较弱时,野生型YX ⁃ 0和突变体YX ⁃ yl的PBG 合成能力均有提高。

图4 不同光照下突变体YX⁃yl 与野生型YX⁃0 幼苗叶片PBG 含量比较Fig.4 Comparison of PBG contents in seedlings between mutant YX⁃yl and wild type YX⁃0 under different il⁃lumination conditions
2. 3. 3 幼苗叶片Mg⁃Proto Ⅸ、Proto Ⅸ和Pchlide含量的测定
以12 000 lx 为对照,光照强度减弱时,野生型YX⁃0和突变体YX⁃yl的Mg-Proto Ⅸ、Proto Ⅸ和Pchlide 含量均显著增加;而光照强度增加时,野生型YX⁃0和突变体YX⁃yl的Mg-Proto Ⅸ、Proto Ⅸ和Pchlide 含量无显著差异(图5)。在光照强度为9 600 lx 时,突变体YX⁃yl的Mg-Proto Ⅸ、Proto Ⅸ和Pchlide 含量均显著高于野生型YX⁃0,随着光照强度的增强,两者Mg-Proto Ⅸ、Proto Ⅸ和Pchlide含量的差异逐渐减小。不难看出,光照强度的增强可以促进突变体YX ⁃ylMg-Proto Ⅸ、Proto Ⅸ和Pchlide 的合成,同时缩小二者间的合成差异。

图5 不同光照下突变体YX⁃yl 与野生型YX⁃0 幼苗叶片Mg-Proto Ⅸ,Proto Ⅸ和Pchlide 含量比较Fig.5 Comparison of Mg-Proto Ⅸ,Proto Ⅸand Pchlide contents in seedlings between mutant YX⁃yl and wild type YX⁃0 under different illu⁃mination conditions
3 讨论
EMS 是一种高效稳定的化学诱变剂,利用EMS 诱变获得突变体是植物育种中的一种重要方法[26]。近年来,叶色突变体逐渐受到研究学者的关注,已成为研究高等植物叶绿素生物合成降解途径、叶绿体发育、核质基因互作及光合作用分子机制等的一种宝贵资源。叶色突变体相关机制的研究能够提高对植物光合作用的认知和利用水平,不仅有利于揭示叶绿素的代谢机理,也为筛选和培育高光效种质资源奠定了基础[8]。同时,叶色突变还可以作为标记辅助育种,在杂交育种和良种繁育中发挥关键作用[26]。叶片黄化是叶色突变的常见类型,多出现在苗期,通过影响植物的光合作用,导致其生长发育迟缓和产量减少[27]。本试验发现在同一光照强度下,突变体YX⁃yl较野生型YX⁃0的长势较差,表明黄化突变体的生长受到了抑制。适当降低光照强度,野生型YX⁃0和突变体YX⁃yl的农艺性状差别不大,由此推测,较弱的光照强度可能会削弱黄化突变体对生长发育的抑制作用。
叶色突变体是研究叶绿素生物合成相关途径的优良材料,其中叶绿素含量和叶绿体结构是其表型发生变化的主要原因[28]。叶片黄化突变体和叶绿素的含量有直接关系。大量研究表明,与野生型相比,叶色黄化突变体中叶绿素的含量显著降低,不同突变体间叶绿素a和叶绿素b含量的降低幅度不同,通常黄化突变体植株中叶绿素a与叶绿素b含量的比值高于野生型。例如,董遵等人[29]发现甘蓝型油菜中叶绿素含量表现为黄叶<黄绿叶<绿叶,而叶绿素a 与叶绿素b 含量的比值表现为黄叶>黄绿叶>绿叶。此外,作为辅助捕光色素,类胡萝卜素能够扩大吸收光的范围,传递光能,还能清除叶绿体中的氧自由基,起到光保护作用[25],因此,叶绿体内的类胡萝卜素代谢也可以影响叶绿素含量的变化。综上,植株体内叶绿素a、叶绿素b和类胡萝卜素等光合色素的含量异常均可能导致其叶色发生改变。
本研究中,突变体YX⁃yl表现为黄叶表型,同一光照强度下叶绿素a、叶绿素b 和类胡萝卜素含量均降低。糜子黄化突变体植株的叶绿素含量显著低于野生型植株,这与多数植物的黄化突变体研究结果类似[28]。叶绿素的含量与突变体叶色的表型相一致。且本试验中突变体YX⁃yl的叶绿素b含量下降幅度均高于同一光照强度下叶绿素a含量的下降幅度,而对照的野生型YX⁃0植株叶绿素a/b均小于突变体YX⁃yl,这与水稻yg11突变体叶绿素a生物合成部分阻断,导致总叶绿素积累减少,且叶绿素a 和叶绿素b 的比值增加的情况相同[29]。本试验结果说明,在引起突变体苗期叶片黄化表型变化的光合色素中,叶绿素b 的降幅变化更大。
叶片是植物进行光合作用的主要场所,作为光合作用中重要的色素分子,不同的光照强度都会影响叶绿素的生物合成[30]。光照是影响植物叶绿素合成和叶绿体发育的重要环境因子之一,光照不足会导致酶活性发生变化,进而影响叶绿素的生物合成;光照过强会导致叶绿素合成受阻或叶绿素溶解,甚至对植物产生光氧化和光抑制[19]。 研究发现,黑暗或长期遮光可以限制植物的光合碳同化力和光合作用关键酶的活力,导致叶绿素的合成减少,最终引起叶片褪绿[31]。同时,李汉生等人[32]发现镁离子螯合酶在光照后活性增强,植物的叶绿素合成增加。本试验发现苗期突变体YX⁃yl更易受低光强影响,光合色素含量显著降低,叶片黄化现象加剧;随着光照强度的增强,野生型YX⁃0和突变体YX⁃yl的光合色素含量无显著差异,表明苗期黄化突变体对光照的敏感度更高,且光照强度的增强有利于黄化突变体中叶绿素的生物合成。
叶绿素生物合成途径受阻是叶色黄化突变体中叶绿素含量降低的主要原因[33]。高等植物叶绿素的生物合成是多种酶共同参与催化的复杂过程。即由叶绿素前体物质L-谷氨酰-tRNA 合成ALA,随后缩合成PBG,经过一系列酶促反应生成具有卟啉环结构的Proto Ⅸ,再与镁结合成Mg-Proto Ⅸ,通过甲基化、环化、光还原和酯化等步骤,最终合成叶绿素a 和叶绿素b 的生化过程[34]。其中,任意一步受阻或发生突变都可能影响叶绿素的合成,导致叶片失绿黄化[33]。叶绿体前体物质的分析有利于确定叶绿体生物合成中的代谢异常,当合成叶绿素的某一过程受抑制时,受阻位点前的前体物质将显著积累,而受阻位点后的前体物质将显著减少。拟南芥gun5突变体中Proto Ⅸ向Mg-Proto Ⅸ转化的过程被阻断,导致叶绿素的生物合成受到抑制,叶绿素合成减少[35]。番茄黄化突变体中ALA、PBG、Urogen Ⅲ、Coprogen Ⅲ、Mg-Proto Ⅸ、Proto Ⅸ和Pchlide 的含量均显著低于野生型,说明叶绿素整个合成途径的合成能力降低会降低突变体中的叶绿素含量。随后又发现后面4 种前体物质的降低幅度较大,分析发现可能是Coprogen Ⅲ(粪卟啉原Ⅲ)的合成水平受影响最大导致的,推断Coprogen Ⅲ的合成受阻可能是黄化突变体中叶绿素含量下降的主要原因[15]。本试验发现苗期突变体YX⁃yl的几种关键叶绿素前体物质ALA、Mg-Proto Ⅸ、Proto Ⅸ和Pchlide 的含量与野生型YX⁃0相比有显著差异。在12 000 lx 时,突变体YX⁃ylALA 含量显著低于野生型YX⁃0。ALA 的合成是叶绿素合成的关键步骤,控制ALA 合成的酶是叶绿素生物合成中的限速酶,ALA 的合成决定了叶绿素合成的总量[36]。据研究结果推测,ALA 合成的减少可能是导致叶绿素合成总量降低,造成叶片黄化的主要原因。进一步分析发现,光照强度的增强有利于突变体YX⁃ylMg-Proto Ⅸ、Proto Ⅸ和Pchlided 的生物合成,这是由于在叶绿素合成中Proto Ⅸ向Pchlide 转化时,需要借助原叶绿素酯氧还酶利用光能驱动NADPH 还原D环的双键,促使叶绿素E 环形成,因此合成原叶绿素酯的这一步骤会受到光照强度的影响。光照强度的增强可以促进后续反应进行,进而缩小突变体YX⁃yl和野生型YX⁃0Proto Ⅸ、Mg-Proto Ⅸ和Pch⁃lide 含量之间的差异。
4 结论
本试验通过对苗期的野生型和叶片黄化突变体糜子不同光照强度下的农艺性状、光合色素含量和关键叶绿素前体物质含量的变化进行对比和分析,发现突变体叶片黄化可能是叶绿素整个合成途径合成能力降低,在胆色素原与原卟啉转化阶段受阻,造成黄化突变体中叶绿素含量降低导致的。而适当的增强光照强度,可能提高突变体YX⁃yl中叶绿素前体物质Mg-Proto Ⅸ、Proto Ⅸ和Pchlided 的合成,从而减缓叶绿素合成通路受阻,促进叶绿素和类胡萝卜素的积累,有助于突变体的生长。
