霉菌酵母快速检测测试片的优化
2021-12-01贾倩倩李宏铎白福军于宏双
贾倩倩,李宏铎,白福军,于宏双,张 静,周 琦,贾 晨*
(1.北京美正生物科技有限公司,北京,102200;2.西安市食品药品检验所,陕西西安 710054;3.中储粮承德粮油质监中心有限公司,河北承德 067000;4.雨润集团马鞍山百瑞食品有限公司,安徽马鞍山 243100)
霉菌和酵母使用广泛,与人们日常生活联系十分密切。霉菌不仅应用于传统的酿酒制酱和发酵食品中,在农业、纺织、食品、医药和皮革制造等领域都有极为重要的作用[1-3]。霉菌和酵母菌的污染会导致食品营养价值下降,甚至腐败变质。若食用被霉菌、酵母菌污染的食品,会造成肠胃不适,引发疾病[4]。因此,人们愈来愈重视食品中霉菌和酵母菌污染对人体造成的危害[5-6]。
霉菌和酵母菌的数量表明食品被污染的程度,是评价食品卫生质量必不可少的指标[7]。在我国饮料、坚果制品、米面制品、糕点类等食品中,把霉菌和酵母菌作为食品污染的指示菌进行监测,被列入国标GB 4789系列食品安全微生物常规检测项目之一[8]。目前,国内外对霉菌的检查方法主要有平板计数法、显色培养基计数法、WKJ-Ⅱ型微生物快速检测系统、流式细胞仪计数法和测试片法[9-10]。其中,测试片法是一项微生物快速的检测方法,该方法操作简便,检测时间短,极大地提高了检测效率。而霉菌和酵母菌落在上呈不同形态,容易判断观察和直接计数。戴昌芳[11]、余淑冰[12]、王明[13]和赵红阳[14]等将测试片与国标方法检测效果进行了评价,研究结果表明两种方法的检出结果无显著性差异。
测试片法虽然成本低、检测性能好,但也存在霉菌菌丝的蔓延和显色效果的不稳定影响计数准确性等问题。因此,本研究同过添加不同浓度的抑制剂,探究其对霉菌和酵母菌落形态和颜色的影响,以此优化霉酵测试片检测效果。
1 材料和方法
1.1 材料与试剂
霉菌酵母测试片:北京美正生物科技有限公司;抑制剂与其他试剂均为国药分析纯试剂。实验中选取不同品牌和口味的糕点、面包、坚果样品共5种,均购自超市。标准菌株:1株酵母菌(10231)和11株霉菌(M-1 至 M-11)。
1.2 仪器与设备
SHP-80型生化培养箱,上海森信实验仪器有限公司;YXQ-70A立式压力蒸汽灭菌器,上海博迅实业有限公司医疗设厂;SW-CJ-2FD双人单面垂直净化台,苏州智净净化设备有限公司。
1.3 实验方法
1.3.1 菌液制备
从甘油管中活化酵母至马铃薯葡萄糖液体培养基,28 ℃培养2 d,平板计数备用。
1.3.2 测试片培养基单因素实验
将3株霉菌与酵母分别用无菌水进行梯度稀释,配置成一定浓度的菌悬液,振荡器混匀,制成最终浓度为10~100 CFU/mL的稀释液。分别添加霉菌抑制剂的浓度为 1 μL/L、2 μL/L、3 μL/L,每个稀释梯度设置两个平行,分别吸取菌液1.0 mL接种于霉酵测试片上,培养测定酵母菌和霉菌的菌落总数,考察抑制剂浓度对霉菌和酵母菌落总数的影响。
1.3.3 测试片培养基验证实验
(1)最佳计数范围的测定。选用12株菌株,用无菌水稀释成 1×10-7、2×10-7、4×10-7和 8×10-7CFU/mL的4个浓度梯度,进行试验,分别吸取各个浓度梯度的菌悬液1.0 mL接种测试片,每个梯度设置2个平行,培养计数。
(2)食品样品的检测。从市场上采购不同品牌和口味的糕点、面包、坚果和蜂蜜样品共5份。称取25 g/mL样品放入盛有225 mL无菌水的无菌均质袋内,均质器混匀,制成1∶10的样品匀液。选取一株霉菌,做加标实验。将霉菌进行梯度稀释,配置成一定浓度的菌悬液,向样品匀液中添加菌悬液,混匀,制成最终浓度为10~100 CFU/mL的加标样品,吸取的样品菌悬液1.0 mL接种测试片,每个梯度设置2个平行,培养计数。
1.3.4 霉菌和酵母计数
培养后,酵母菌落较小,边界清晰,颜色均一,菌落显示紫红色。霉菌菌落较大,边缘模糊,呈浅粉色到紫红色,颜色不均一。
1.3.5 数据分析
本实验用SPSS、excel对实验进行设计及数据分析处理。
2 结果与分析
2.1 抑制剂对酵母与霉菌的生长率与形态的影响
由表1可知,随着抑制剂浓度的升高,霉菌的菌落的生长率没有显著性差异,但霉菌菌落大小具有显著差异,具体见图1。与对照相比,添加抑制剂后霉菌菌落变小;当抑制剂的浓度≥3 μL/L时,霉菌菌落的大小没有显著变化。同时,添加抑制剂对酵母的生长率和形态没有显著影响。因此,测试片添加抑制剂的浓度在2 μL/L时效果最佳。

表1 不同浓度抑制剂对霉菌和酵母生长率的影响(单位:log10 CFU/mL)

图1 3株霉菌和1株酵母在测试片上的形态
2.2 测试片培养基准确度测试结果
为了测定优化后测试片的最佳计数范围,使用12株菌株,浓度依次递增,设置了4个梯度。由表2可知,优化后的测试片,大部分霉菌的计数范围在0~80 CFU,与对照霉菌计数范围相比(计数范围<30 CFU),提高了50 CFU。当菌落数大于86 CFU时,测试片结果显示均不可计数。
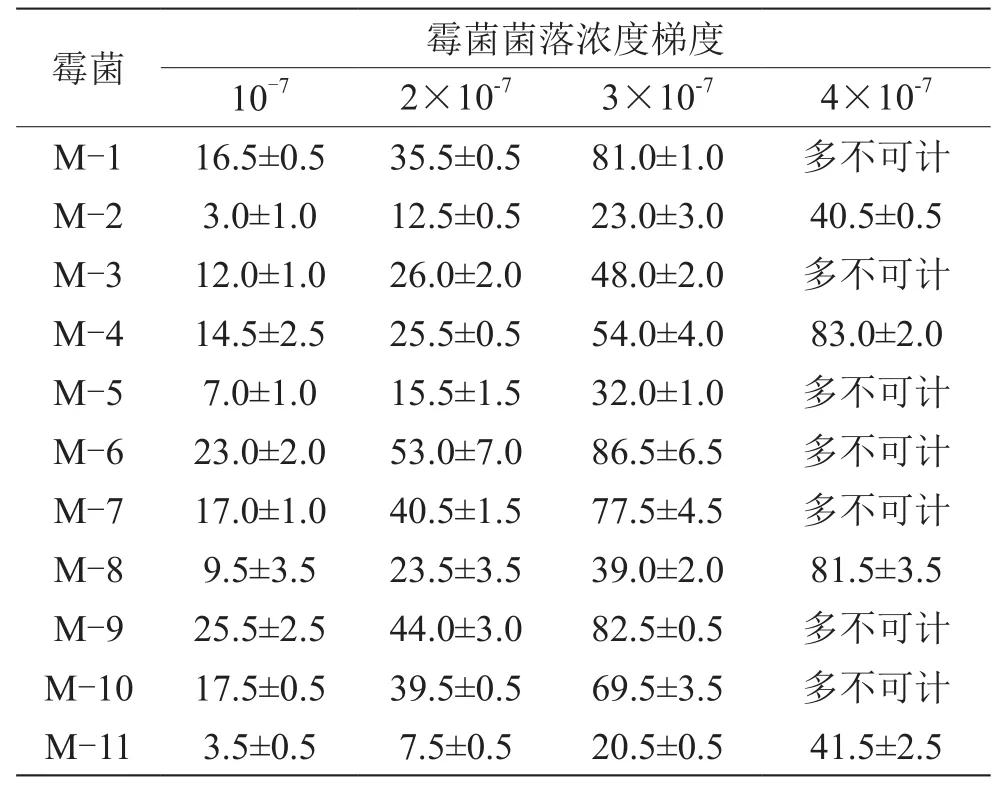
表2 不同浓度梯度霉菌的菌落数(单位:CFU/mL)
2.3 食品样品检测结果
表3为检测6种食品样品的测试结果。其中,所有样品原样中均未检出霉菌。加标样品检测的结果表明,有5种食品样品中检出霉菌并计数,1个核桃样品使测试片整体变色,不能计数。优化后测试片霉菌的计数范围明显大于对照组,不同食品样品的基质会影响测试片霉酵的计数结果,但影响较小。因此,优化后的测试片可以用于部分食品中霉菌菌落计数。

表3 各个食品样品的霉菌生长率(单位:CFU/mL)
3 结论
本实验以霉菌酵母测试片为基础,通过添加抑制剂探究对霉菌酵母生长率和形态的影响。实验结果表明,抑制剂能够抑制霉菌菌丝蔓延,减小霉菌菌落,从而提高了霉酵测试片的计数范围。在检测面包、蜜饯和坚果等食品样品时,优化后的测试片霉菌计数范围明显大于对照组。因此,优化后的霉酵测试片能够满足食品样品中的霉菌酵母计数的快速检测需求。
