MAC技术在降低颈椎金属内固定术后CT扫描金属伪影的临床价值
2021-11-30潘雪琳洪静袁元杨帆邵强李真林
潘雪琳,洪静,袁元,杨帆,邵强,李真林
1. 四川大学华西医院 放射科,四川 成都 610041;2. 重庆医科大学附属永川医院 放射科,重庆 402160;3. 上海联影医科科技股份有限公司,上海 201100
引言
颈椎金属内固定物置入手术广泛应用于椎间盘突出、膨出、颈椎结核、退行性改变、滑脱、占位性病变、椎体骨折等病变。其影像学检查主要目的是为临床医生手术疗效评估和术后复查提供依据,利用多层螺旋CT对置入的金属材料具体位置、骨质肌肉的解剖毗邻关系进行精确评估,但在进行CT检查时金属植入物会产生放射状的硬化束伪影,严重的伪影会对邻近重要结构或者病变产生影响,影响诊断准确性及延误治疗[1-2]。虽然减少金属伪影的方法较多,如采用能谱单能量成像方式提高局部空间分辨率[3],高keV的单能量图像有效改善硬化伪影[4],利用双能CT进行虚拟单能谱图像成像[5],去金属伪影技术[6]、双源 CT 双能量成像技术[7]、迭代去金属伪影算法技术[8]等,但是,目前关于金属伪影校正(Metal Artifact Correction,MAC)技术在颈椎金属内固定术后降低金属伪影的报道较少。本研究通过对颈椎金属内固定术后患者行CT复查,对原始数据分别行KARL迭代重建和MAC技术重建,探讨MAC技术在降低金属伪影方面的临床应用价值。
1 材料与方法
1.1 一般资料
随机收集四川大学华西医院2019年11月至2020年6月颈椎金属内固定植入术后行颈椎CT复查的患者106例,其中男66例、女40例,年龄32~73岁,平均年龄(55.6±15.3)岁。本研究均取得患者及其家属同意并签订知情同意书。研究对象选择标准:① 患者均行颈椎CT普通扫描,并且影像学资料完整;② 患者均为颈椎金属内固定植入术后;③ 颈椎图像包括整个内固定材料,并且至少超出内固定材料上下缘一个椎体。排除标准:① 妊娠期及哺乳期患者;② 患者合作欠佳、图像质量不清晰等。
1.2 检查方法和后处理
采用联影u780 80排CT设备对所有患者进行颈椎检查,具体扫描方法为患者取仰卧位,扫描范围应该包全所有颈椎(C1~C7椎体)。扫描参数:球管电压为120 kV,管电流180 mAs,螺距0.9750 mm,准直宽度20 mm,层厚1 mm,机架转速0.8 s/r。
图像后处理技术:对所有原始数据均用两种方式重建,A组为对照组,采用KARL迭代重建;B组为实验组,采用MAC技术重建(图1)。
每组图像均选取相同的5个点(图1,a点:金属伪影高密度区伪影最重点;b点:金属伪影低密度区伪影最重点;c点:相同层面伪影较重的脊髓;d点:相同层面伪影影响较大的骨质;e点:软组织)进行测量,测量时感兴趣区(Region of Interest,ROI)面积均为0.11 cm2,对两组图像进行观察、测量和分析。

图1 A、B两组重建方式对金属伪影的显示
1.3 图像质量评价
1.3.1 客观评价
分别对A、B两组图像a、b、c、d、e共5点的CT值、噪声值标准差(Standard Deviation,SD)进行测量,并以颈椎周围软组织e点为背景计算出a、b、c、d共4点相对于e点的信噪比(Signal to Noise Ratio,SNR)、对比噪声比(Contrast to Noise Ratio,CNR)。根据公式计算SNR和CNR,SNR=CT/SD,CNR = (CT-CT软组织)/SD软组织[9]。其中,CT软组织为观测点a、b、c、d点各自的CT值,CT软组织为软组织e点的CT值,SD软组织为软组织e点的SD值。
1.3.2 主观评价
由2名有经验的放射科医师采用双盲法对A、B两组图像质量分别进行评判,按照5分Likert量表[10]对图像质量进行主观评价[11]:5分:图像中没有金属伪影,诊断明确;4分:图像较好,只在最大伪影层面有很少的伪影,诊断明确;3分:图像中存在小面积伪影,周围组织结构受到影响,可以诊断;2分:图像有明显的金属伪影,周围组织模糊不清,诊断有困难;1分:图像有严重的金属伪影,无法诊断。放射科医生进行观察记录,结论不同时经讨论后达成一致。
1.4 统计学分析
应用SPSS 23.0软件进行统计学分析。对两组计量资料进行正态检验;对于不服从正态分布的计量资料,使用中位数(上四分位数,下四分位数)进行描述,并使用非参数检验进行差异性分析;2名放射科医师对A、B两组图像的主观评分一致性采用Kappa分析进行检验,Kappa值≥0.75为一致性较好,0.40~0.74为一致性中等,<0.40为一致性较差。此研究认为P<0.05为差异有统计学意义,本次检验均为双侧检验。
2 结果
因本研究样本量小于2000例,因此使用夏皮洛-威尔克检验结果,针对所有指标,P值均<0.05,说明均不服从正态分布,后续检验需做非参数检验(符号秩和检验)。
2.1 图像质量客观评价指标
图像质量客观评价结果如表1所示。其中,a点为金属伪影高密度区伪影最重的点,根据表中CT值、SD值的中位数及其上下四分位数可以推断A组高于B组;b点为金属伪影低密度区伪影最重点,根据表中CT值中位数及其上下四分位数可以推断A组低于B组,根据表中SD值中位数及其上下四分位数可以推断A组高于B组;而c点、d点的统计结果,根据表中CT值、SD值的中位数及其上下四分位数可以推断A组均高于B组,其差异均具有统计学意义(P<0.05);e点A组和B组CT值、及SD值P值大于0.05,说明二者差异无统计学意义。

表1 A、B两组图像CT值、SD值比较
以软组织e点为背景计算A、B两组a、b、c、d共4点的SNR和CNR值,根据表中SNR和CNR值的中位数及其上下四分位数可以推断A组低于B组,差异检验P值小于0.05,说明二者差异有统计学意义,见表2。
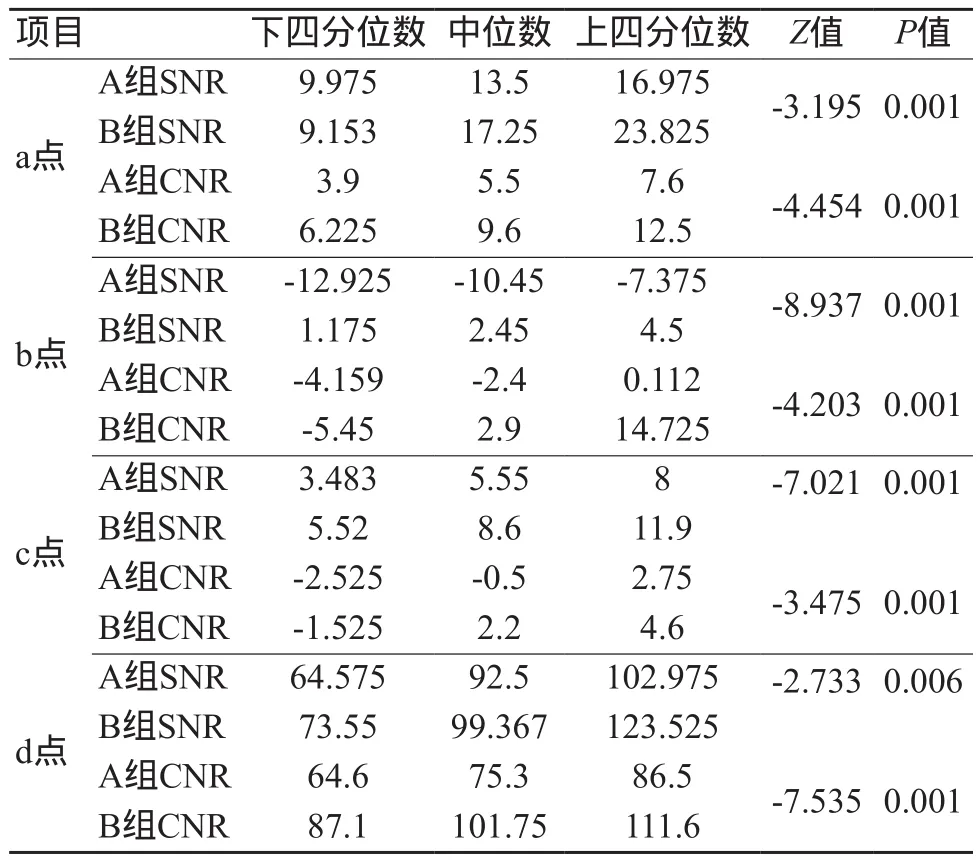
表2 两组图像质量客观评价指标SNR、CNR比较
2.2 图像质量主观评价
对A组的两位医生评分一致性检验中,Kappa值=0.936,对B组的两位医生评分一致性检验中,Kappa值=0.930,检验P值两组均小于0.05,说明二者一致性检验结果具有统计学意义,且一致性较好(表3),评分比较B组的主观评分中位数为4分,高于A组中位数3.5分(P<0.05),见表4。A组的CT图像(图2a~2b)和B组图像(图2c~2d)相比,B组的图像金属伪影面积减小,周围骨性和软组织结构更清晰,能够较好地观察金属植入物周围的骨质、脊髓、软组织情况。

表3 A、B组两医生主观评分一致性检验

表4 两组CT图像质量主观评价评分情况

图2 FBP和MAC重建图像
3 讨论
随着脊柱外科金属植入手术的增多,为了解术后金属植入物是否在位、松动或断裂,金属植入物对邻近结构是否存在压迫,金属植入物有无继发感染,术后疼痛是否和金属植入物有关联等,越来越多的金属植入物患者会采用CT术后复查以达到疗效监测和远期随访的目的。但是CT检查时金属植入物会产生金属伪影,对CT扫描结果产生影响、甚至会影响临床判断。金属伪影的产生主要是由于金属与人体组织的厚度、密度差异过大[12-13],导致相应投影数据缺失[14-15]。CT金属伪影主要包括射束硬化伪影、光子饥饿伪影和散射伪影[16-18]。而这些金属伪影会遮挡金属周围组织器官,对临床诊断和治疗带来影响。
目前,联影设备常采用KARL迭代重建技术,是在图像原始数据的投影空间和图像空间中运算的模型。该技术根据噪声模型对选定的噪声数据进行校对,可以对投影数据进行迭代处理。其迭代过程快速收敛到目标值,加快了重建速度,从而减少了图像重建所需的迭代步骤。因此,KARL的重建速度与常规FBP相当,可以达到30~40幅图/s,但它在对金属植入物扫描时,也忽略了X射线光子的统计学与系统光学波动,没有考虑投影数据被量子噪声和电子噪声的污染,导致图像噪声增大、伪影出现,分辨率降低,会覆盖病变和有价值的诊断信息[19-21]。
CT去金属伪影的方法较多,如何能最方便有效、最大限度地减少金属伪影的影响、改善对金属植入物及其周围解剖结构的观察效果,在临床工作中显得尤为重要[22-23]。总的来说去金属伪影的方法可以在扫描前阶段、扫描阶段及图像后处理阶段起到作用。在扫描前阶段,手术时采用低衰减材料如钛合金;在扫描阶段,使用较高的管电压、自适应管电流、较窄的准直,薄层扫描图像,扩大扫描范围,并尽量将金属植入物长轴垂直于扫描平面,使之产生最小的横断面积,采用双能量、能谱序列进行扫描;在图像后处理阶段,使用较厚层厚、去伪影算法重组及拓展CT值范围可以减少金属伪影[24]。常用的去伪影算法包括投影插值算法、迭代重建算法及混合算法[25-28]。
本研究运用的MAC重建算法,是联影公司最新研发的金属伪影校正技术,是在图像后处理阶段起作用。MAC技术基本原理是先通过图像域分割从原始图像中提取产生伪影的金属物体,再对金属图像进行正投影,找到被金属干扰及破坏的投影数据,结合插值、迭代算法的优势,通过插值和加权的方法尽可能地修复投影数据,最后通过矫正后对该投影数据进行反投影,得到校正图像。MAC通过考虑金属物体的密度和形状设计算法,以充分保留金属边缘信息,同时抑制伪影和噪声。
金属植入术后CT复查时MAC技术的应用使得金属与骨质的界面、金属与软组织的界面、颈椎间盘、椎弓根与椎体、脊髓等显示有明显的改善,尤其是金属伪影影响较重的骨质、脊髓等的显示。金属植入物在CT成像中的伪影常表现为放射状的高密度影和条状的低密度区,高密度伪影产生的主要原因是光子饥饿效应和散射效应,低密度伪影产生的主要原因是严重衰减的结构之间产生的光束硬化效应[29]。然而在CT成像过程中形成的金属伪影区域,金属植入物相邻的低对比度结构很容易被伪影遮挡,MAC通过数据校准、去噪,能减少光子饥饿引起的细小条纹伪影,使金属高密度伪影区CT值降低,图像噪声降低。同时,利用原始数据进行插值补偿,消除了大部分阴影,提高金属低密度伪影区的CT值。因此,本文通过对测量金属伪影的高低密度区、脊髓、骨质层面来量化评估MAC对金属伪影的影响。
本研究通过将常规KARL迭代重建的图像和MAC重建的图像进行对照比较,结果发现,金属高密度伪影区MAC重建后CT值、噪声均较KARL迭代重建降低;金属低密度伪影区MAC重建后CT值较KARL迭代重建增加,噪声却降低;受金属伪影干扰的骨质和脊髓区域MAC重建后CT值、噪声均较KARL迭代重建降低,而参照的肌肉组织MAC重建后CT值、噪声和KARL迭代重建后差异不大。因此,MAC图像中金属高密度伪影区和金属低密度伪影区的CT值均有改善,图像中噪声明显降低,此结果与刘颖等[30]、Li等[31]的研究结果相似。通过对金属伪影的去除,医生结合原始图像和去金属伪影的图像,能最大限度地减少误诊和误治。
本研究通过对MAC组、KARL重建组所测量组织的CT值进行比较,MAC组骨骼和软组织的CT值(骨骼CT值在1000 HU,软组织CT值范围30~70 HU)更接近于实际的CT值,能够更为真实地反映组织状态,对于术后可能发生的植入物周围组织的水肿、出血、炎症及坏死等情况,能够更早期及时发现,为临床提供具有更多诊断信息的图像。并且MAC重建后颈椎金属植入物邻近的骨组织、脊髓以及软组织的SNR和CNR均高于KARL重建组,差异具有统计学意义,表明通过抑制伪影和噪声,MAC能够保护和恢复颈椎金属植入物相邻的骨组织、脊髓及软组织的对比度,使得整体图像质量得到改善。MAC组的图像质量主观评分优于KARL重建组,也进一步印证了MAC重建后SNR、CNR得到改善(P<0.05)。
本研究存在一些不足:① 颈椎金属植入物的材料较多,该文章未考虑材料的因素、材料的分类等;② 颈椎金属物植入方式和方向较多,未对金属植入物的长径、断面进行单独分析;③ 该研究纳入的样本量较少。
综上所述,MAC技术是一种后处理算法,和其他去金属伪影的方法不同的是数据采集的过程和常规扫描序列相同,但不需要使用特殊序列或者特殊硬件设备支持,也不会增加患者检查的辐射剂量。即使在扫描前未能准确了解患者有无金属植入物,或者无法评估该金属植入物对周围组织结果的影响,也可以在后处理时对原始图像采用MAC技术进行回顾性地去金属伪影重建,这个优势可以大大地提高CT影像检查的流通量。在颈椎金属植入术后的CT复查中可以有效去除金属植入物的伪影,使金属植入物周围的骨质、脊髓、软组织显示清晰,改善整体图像质量,在评估术后并发症方面具有重要的临床价值,在临床工作中值得进一步推广。
