CCLG-ALL2014方案治疗儿童急性淋巴细胞白血病的生存分析
2021-11-30黄婷婷王菊香周海霞李原陈敏胡玲珑王瑶黄珍
黄婷婷,王菊香,周海霞,李原,陈敏,胡玲珑,王瑶,黄珍
温州医科大学附属第二医院育英儿童医院 儿童血液肿瘤科,浙江 温州 325027
急性淋巴细胞白血病(acute lymphoblastic leukemia, ALL)是儿童最常见的恶性疾病[1-2]。近几年,儿童ALL治疗在基于危险度分层及危险度调整下的治疗方案下取得了显著进展,许多发达国家的5年总生存(overall survival, OS)率接近甚至超过90%[3-4]。国内多个多中心临床研究的长期无事件生存(event free survival, EFS)率达到70%~80%,接近国际先进水平[5]。现回顾性分析温州医科大学附属第二医院育英儿童医院儿童血液肿瘤科2015年1月至2019年12月按照中国儿童急性淋巴细胞白血病诊疗建议2014(Chinese Children’s Leukemia Group in China-Acute Lymphoblastic Leukemia 2014, CCLG-ALL2014)进行规范化疗的108例ALL患儿的临床资料,分析其治疗效果和长期生存情况。
1 对象和方法
1.1 对象 回顾性分析2015年1月至2019年12月于温州医科大学附属第二医院育英儿童医院儿童血液肿瘤科确诊的112例ALL患儿,其中4例患儿因经济或其他非医学原因治疗2周内放弃治疗,最终共纳入108例接受CCLG-ALL2014方案规范化化疗的ALL患儿,女53例,男55例,年龄5.3(1.0~15.2)岁,随访时间3.3(1.0~5.9)年,1例失访,另2例复发后接受造血干细胞移植(hematpietic stem cell transplantatin, HSCT),1例复发后接受嵌合抗原受体T细胞(chimeric antigen receptor T-cell, CAR-T)治疗,均存活。低危组44例,中危组36例,高危组27例。高危组中1例在第1次完全缓解后接受HSCT。初诊白细胞计数>100×109/L有11例 (10%),>10岁者10例(9%)。检测到白血病融合基因者35例,包括15例TEL-AML1、9例E2A-PBX1、3例BCR-ABL、2例ETV6/RUNX1、2例TCF3/PBX1、2例JAK1 Exon15同义变异、1例SIL-TAL1、1例MLL-AF4。本研究资料信息由专人采集,中国儿童白血病诊疗登记管理线上系统登记,每6个月更新一次随访结果。最后一次随访时间为2020年12月31日。纳入标准:年龄满1个月到不满18岁,符合2008年世界卫生组织白血病诊断标准,睾丸白血病、中枢神经系统白血病的诊断参考国际通用标准。排除标准:慢性髓细胞白血病急淋变、其他继发白血病。分层标准:参照CCLG-ALL2014方案[6]。
1.2 治疗方案 由泼尼松敏感试验、诱导缓解、早期强化、巩固治疗、延迟强化、维持治疗组成(方案中的左旋门冬酰胺酶,本研究中心用培门冬酶取代)[6]。高危组在第一次完全缓解即建议HSCT。总疗程为低危组2年,高危组2.5年,中危组2年(女)或2.5年(男)。
1.3 微小残留病(minimal residual disease, MRD)监测 采用流式细胞仪检测,评估点(time point, TP)包括TP1,即诱导缓解第15天;TP2,即诱导缓解第33天;TP3,即巩固治疗前。评估方法包括FCM法和白血病融合基因定量反转录法(初诊时存在白血病融合基因者)。
1.4 统计学处理方法 采用SPSS25.0统计学软件进行数据分析。计数资料用例表示,组间比较采用χ2检验。OS率和EFS率分析运用Kaplan-Meier生存分析法,组间生存情况比较采用对数秩检验。MRD值分别以0.01%、0.1%、1%、5%、10%为截点进行OS和EFS分析,筛选出差异有统计学意义的截点值。P<0.05为差异有统计学意义。
2 结果
2.1 早期治疗反应 泼尼松治疗第8天外周血幼稚细胞<1×109/L即泼尼松反应良好(prednisone good response, PGR)共96例(89%),≥1×109/L即泼尼松反应不良(prednisone poor response, PPR)者共11例(10%)。1例患儿在泼尼松治疗期间死亡。
107例(99%)患儿完全缓解,其中103例在诱导缓解第15天完全缓解,还有4例患儿在诱导缓解治疗结束后完全缓解。
TP1时67例(62%)患儿MRD转阴(MRD<0.01%),40例(37%)患儿MRD>1%,其中MRD>10%者有19例(17%)。TP2时98例(91%)患儿MRD<1%,仅有4例(3%)患儿MRD>10%。TP3时仅7例(6%)患儿MRD>1%,其中2例复发并死亡。
2.2 不良事件分析 108例患儿发生骨髓复发共10例,早期(<6个月)复发1例,中期(6个月~3年)复发8例,晚期(>3年)复发1例,复发时间为诊断后17(4~42)个月。诱导期死亡1例,诱导期后死亡6例,共计死亡7例。未发生第二肿瘤。治疗相关不良反应包括曲霉菌肺炎6例,培门冬过敏性休克4例,急性胰腺炎12例,深静脉血栓形成2例,消化道出血2例,肿瘤溶解综合征1例,脑白质脱髓鞘病变1例。
2.3 长期生存分析 3年EFS率和OS率分别为(73.4±4.3)%和(92.9±2.6)%。年龄、性别对患儿的长期生存无明显影响,而初诊时白细胞计数、泼尼松敏感实验结果、危险度分级等均影响患儿的长期生存。与初诊时白细胞计数<100×109/L、PGR相比,初诊时白细胞计数≥100×109/L、PPR的3年OS率明显低下(P<0.05),见表1。TP1时MRD>5%者生存率明显低于MRD≤5%者,3年OS率分别为(79.9±8.3)%和(98.7±1.3)%(χ2=10.547,P=0.001),见图1A,3年EFS率分别为(58.6±9.1)%和(79.4±4.6)%(χ2=5.049,P=0.025),见图1B。TP2时MRD<0.01%、0.01%~10%和>10%的患儿3年OS率组间比较差异有统计学意义(χ2=32.338,P< 0.001),3年EFS率组间比较差异有统计学意义(χ2=25.589,P<0.001),但是由于MRD>10%的病例仅4例,需进一步积累病例后再分析,见图1C、图1D。有复发患儿生存率明显小于无复发患儿(χ2=44.884,P<0.001)。高危组患儿生存率明显小于低危组患儿(χ2=4.262,P=0.039)。见表1。
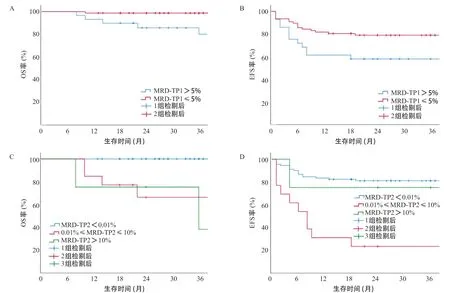
图1 不同MRD儿童ALL长期生存分析
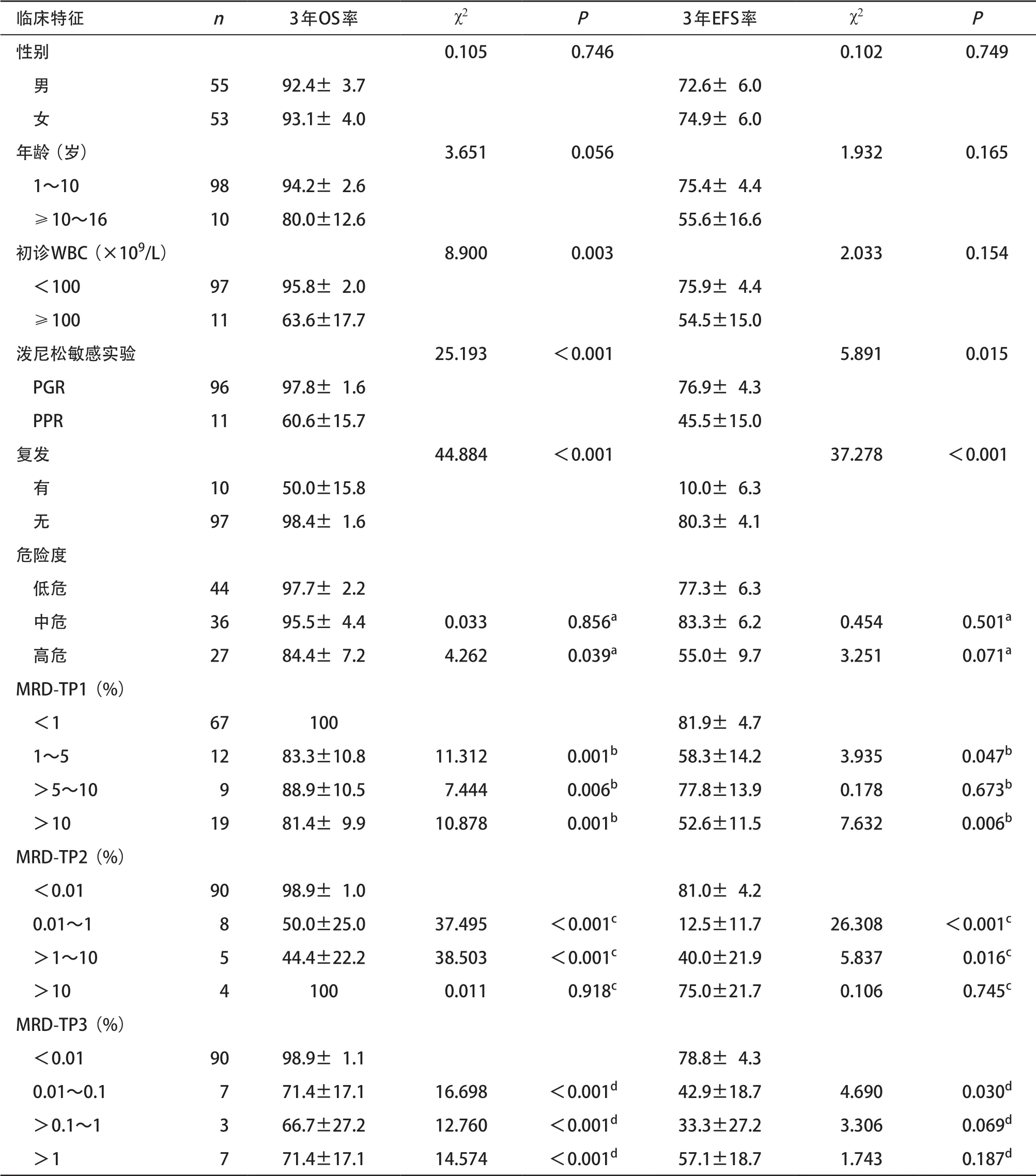
表1 108例儿童ALL的生存分析(%)
3 讨论
儿童ALL发生发展的遗传异质性决定其危险度分层以及分级治疗[7-9]。根据基因组学特点区分的儿童ALL不同亚型的预后差异巨大,如BCR-ABL阳性、MLL基因重排及Ph+ALL等的长期生存率低,复发率高。高通量测序等技术发现部分难治复发的儿童ALL存在异常激活的酪氨酸激酶信号通路,这为临床治疗提供新的思路—靶向分子治疗。在繁多的临床危险度因素中,早期治疗反应仍是最强、最可靠的提示儿童ALL预后不良的独立因素,它能够更加客观准确地反映宿主、疾病和疗效之间的关 系[10-11]。目前国际上评估ALL患儿对早期治疗的反应主要根据泼尼松敏感试验、诱导治疗早期骨髓反应以及诱导治疗结束时骨髓的缓解情况[12-13]。作为ALL长期生存预后的最强预测指标,现MRD已被广泛用于ALL危险度分层调整、化疗方案疗效的评估、早期预测复发以及移植前的肿瘤负荷评估[14-15]。 相同危险分层的ALL患儿预后不同,目前公认的参考因素是MRD。本研究结果显示,MRD-TP1>5%者生存率明显降低,MRD-TP2和MRD-TP3<0.01%者3年OS率和EFS率明显提高,这与李红等[16]研究儿童白血病多临床治疗中心数据相一致,但该数据仅分析MRD持续阳性与MRD转阴组间的生存情况,而本中心将临床不同评估点的MRD进行分层分析,更有利于临床分层治疗。影响ALL患儿预后的独立危险因素是复发,复发患儿的预后极差,本研究中有复发的患儿3年OS率仅50%,明显低于无复发患儿(98.4%)。
本研究108例ALL患儿3年OS率和EFS率分别为(92.9±2.6)%和(73.4±4.3)%。与其他多临床中心治疗数据相比,本次研究OS率偏高,考虑与下列因素有关:①温州地区经济发达,同时由于温州的地域性,较多中、高危组患者选择赴外院如上海、杭州等医院治疗,低危组患者比例较高;②本治疗中心仅进行化疗,高危及复发患儿,均赴外院行骨髓移植、CART等治疗后当前仍存活;③本次研究总病例数较少且随访时间尚短。
与欧美等发达国家相比,我国儿童ALL的生存率仍有差距,故需进一步完善且细化危险度分层,尽早识别筛选早期治疗反应不良病例。通过大队列及多中心的临床研究,根据危险度分层调整其化疗强度,实现精准治疗,从而提高儿童ALL疗效,改善患儿预后[17]。本中心将加入上海儿童医学中心CCCG-ALL-2020方案,以危险度适应性为基础为ALL患儿提供治疗方案,进一步提高ALL患儿的疗效。同时将开展骨髓移植,期望能够提高本中心儿童ALL的长期生存率,改善其预后。
