N′-取代苯磺酰基-N-樟脑磺酰乙二胺化合物的合成及抑菌活性
2021-11-30岑波吴光燧范钟天段文贵林桂汕张文静
岑波,吴光燧,范钟天,段文贵,林桂汕,张文静
(广西大学化学化工学院,南宁 530004)
樟脑是一种双环单萜酮类化合物,是我国重要的天然产物,主产于我国台湾、福建、江西等省份,其生产总量居世界首位[1]。樟脑也可通过松节油主成分α-蒎烯经异构化、酯化、皂化和脱氢等反应制得[2]。我国已成为合成樟脑的主要生产国和供应国[3]。樟脑具有兴奋、强心、镇痛、消炎、抗菌、驱虫和杀虫等多种生物活性, 在医药、日化、轻工等行业有着广泛的应用[4-5]。此外,樟脑衍生物还表现出抗肿瘤、抗菌和除草等多种生物活性[6-8]。磺酰胺类化合物分子结构中含有—SO2—NH—结构,具有良好的抗菌、抗病毒、抗肿瘤和除草等生物活性[9-11],长期以来受到国内外化学家和药学家广泛的关注和研究。
植物病害是严重危害农业生产的自然灾害之一,农药作为防治病虫草害、保护作物的重要手段,在农业生产中起着不可替代的重要作用。黄瓜枯萎病菌、苹果轮纹病菌、番茄早疫病菌、花生褐斑病菌和小麦赤霉病菌等是农作物生长中常见的病原菌,传统的化学农药如百菌清、嘧菌酯等长期使用存在耐药性问题,研发新型农药可为农业增产增收及可持续发展提供重要的保障。研制樟脑基型新型植物病菌抑菌剂,对天然产物樟脑的深加工和开发农药新品种都有积极意义。
近年来,笔者所在团队在天然产物基生物活性化合物的合成方面做了大量的研究工作,合成了樟脑基、松香和松节油基等生物活性化合物,取得了系列研究成果[8,12-17]。在已有研究基础上,根据生物活性叠加原理,进一步开展樟脑的改性和功能化研究。以D-(+)-樟脑磺酸为原料,通过对磺酸基的改性反应,设计将双磺酰胺活性基团引入到D-(+)-樟脑磺酸的骨架中去,合成具有潜在生物活性的N′-取代苯磺酰基-N-樟脑磺酰乙二胺化合物(樟脑基双磺酰胺化合物)。初步探索目标化合物的合成条件,利用傅里叶红外光谱(FT-IR)、核磁共振氢谱(1H NMR)、核磁共振碳谱(13C NMR)和电喷雾电离质谱(ESI-MS)等多种波谱技术对目标产物进行结构表征,并测试目标化合物的抗真菌活性,旨在为樟脑的深度开发利用提供新的途径。N′-取代苯磺酰基-N-樟脑磺酰乙二胺化合物的合成线路见图1。
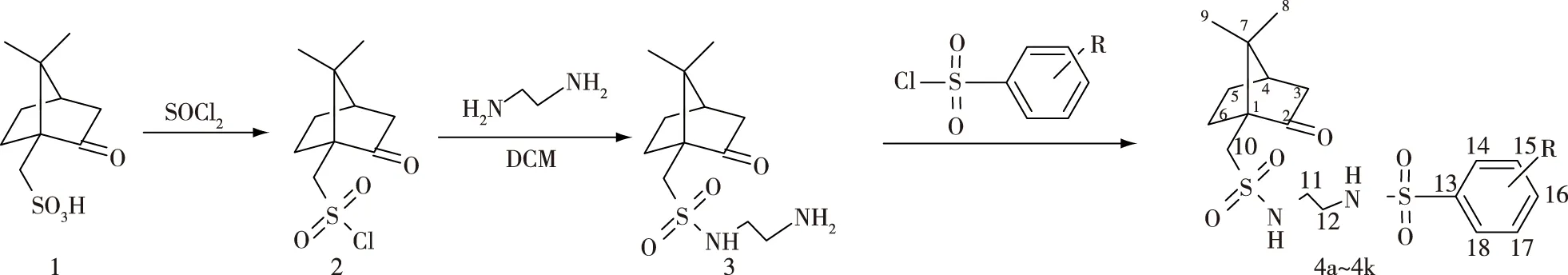
4a为R=H; 4b为R=p-OCH3; 4c为R=m-OCH3; 4d为R=m-CH3; 4e为R=o-NO2; 4f为R=m-NO2; 4g为R=p-NO2; 4h为R=o-F; 4i为R=p-F; 4j为R=p-Br; 4k为R=p-Cl。图1 N′-取代苯磺酰基-N-樟脑磺酰乙二胺化合物的合成路线Fig. 1 Synthetic route of N′-substituted benzenesulfonyl-N-camphorsulfonyl-ethylenediamine compounds
1 材料与方法
1.1 试剂及仪器
试剂:D-(+)-樟脑磺酸(分析纯,上海晶纯实业有限公司);二氯亚砜、乙二胺、四氢呋喃、浓盐酸、氢氧化钠、取代苯磺酰氯等均为市售分析纯试剂。
仪器:Avance Ⅲ HD 600 MHz超导核磁共振仪(瑞士Bruker);Nicolet iS50红外光谱仪、TSQ Quantum Access MAX 液相色谱-质谱联用仪(HPLC-ESI/MS,美国Thermo Scientific);海能MP420全自动熔点仪(济南海能仪器股份有限公司)。
1.2 中间体N-樟脑磺酰乙二胺的制备
N-樟脑磺酰乙二胺的合成参见文献[18]。以4.64 g(19.97 mmol)D-(+)-樟脑磺酸为原料与二氯亚砜反应制得樟脑磺酰氯;樟脑磺酰氯溶于30 mL二氯甲烷中;在100 mL两口圆底烧瓶中,分别加入12.00 g(199.60 mmol)乙二胺和二氯甲烷15 mL,在冰浴条件下,缓慢滴加樟脑磺酰氯的二氯甲烷溶液,滴加完毕后反应1 h,将反应液用饱和食盐水洗涤,再用10%的盐酸调节pH至3~4,取上层水溶液,用2 mol/L NaOH溶液调节pH至9~10,用二氯甲烷萃取,无水硫酸钠干燥,旋干二氯甲烷中,得到2.50 g(9.11 mmol)N-樟脑磺酰乙二胺,为浅棕色液体,收率45.7%。
1.3 N′-取代苯磺酰基-N-樟脑磺酰乙二胺的合成
将制得的N-樟脑磺酰乙二胺溶于10 mL二氯甲烷中,滴加1.3 mL(9.32 mmol)三乙胺,在搅拌和66 ℃水浴条件下缓慢滴加取代苯磺酰氯(9.11 mmol)的20 mL 四氢呋喃溶液,用薄层色谱(TLC)跟踪反应,反应结束后,滤出反应液,得黄色黏稠液粗品;用柱层析提纯,洗脱剂为石油醚和乙酸乙酯(V石油醚∶V乙酸乙酯=1∶1),得到11个N′-取代苯磺酰基-N-樟脑磺酰乙二胺化合物4a~4k。
1.4 目标化合物的结构表征
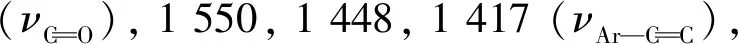
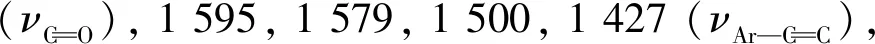
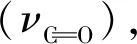
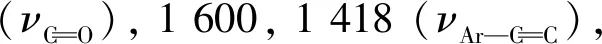
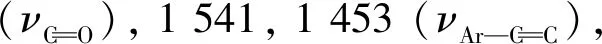
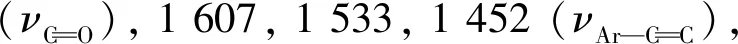
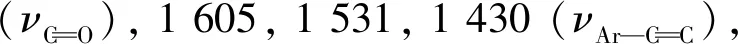
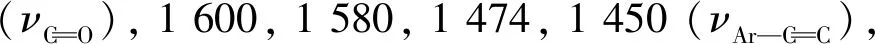
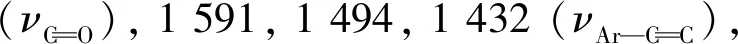
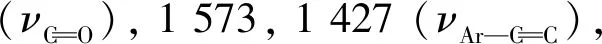
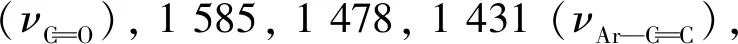
1.5 抑菌活性测试
采用离体法(又称琼脂稀释法)测试所有目标化合物对番茄早疫病菌、黄瓜枯萎病菌、花生褐斑病菌、小麦赤霉病菌和苹果轮纹病菌等5种植物病原菌的抑菌活性。具体测试方法为:将供试药剂溶于丙酮,再用200 μg/mLsorporl-144乳化剂稀释至500 μg/mL;取药液1 mL,注入培养皿内,然后加入9 mL马铃薯蔗糖琼脂(PSA)培养基,制成最终质量浓度为50 μg/mL的含药平板。将培养好的供试菌种用打孔器取直径5 mm菌饼,置于含药平板内,每皿三块呈等边三角形摆放,于(24±1) ℃培养箱内培养48 h后,计量各种处理的菌丝扩展直径,并与空白对照相比较以计算相对抑菌率(x)。计算公式如下:
活性分级指标:A级(x≥90%)、B级(70%≤x<90%)、C级(50%≤x<70%)、D级(x<50%)。
2 结果与分析
2.1 目标化合物的波谱分析


2.2 抑菌活性
目标化合物对供测菌的相对抑制率测试结果见表1。由表1可知,在50 μg/mL质量浓度下,所合成的N′-取代苯磺酰基-N-樟脑磺酰乙二胺化合物对黄瓜枯萎病菌、苹果轮纹病菌、番茄早疫病菌、花生褐斑病菌和小麦赤霉病菌等5种植物病原菌有一定的抑制活性,其中对番茄早疫病菌的抑制活性较好。总体上苯环上带有推电子基团比带有拉电子基团时的抑菌活性要好,苯环上带有卤素时的抑菌活性最差。化合物4a、b、c和d对番茄早疫病菌的抑制率分别为83.9%,91.3%,83.9%和83.9%(4b为A级,其余三者均为B级活性水平),均优于阳性对照百菌清(73.9%)。化合物4b、c对花生褐斑病菌的抑制率均为82.2%(B级活性水平),优于阳性对照百菌清(73.3%)。此外,化合物4b对黄瓜枯萎病菌的抑制率为90.8%(A级活性水平)。显然,化合物4b对5种供试植物病原菌均显示最好的抑制活性,是值得进一步研究的先导化合物。
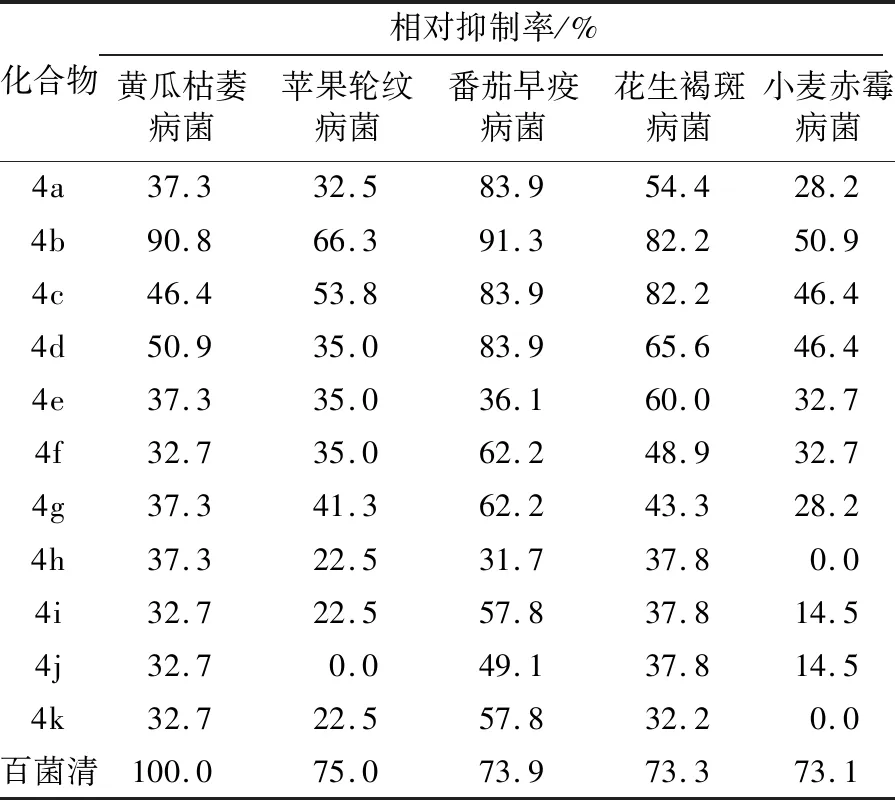
表1 N′-取代苯磺酰基-N-樟脑磺酰乙二胺化合物的抑菌活性Table 1 Antifungal activity of N′-substituted benzenesulfonyl-N-camphorsulfonyl-ethylenediamine compounds
3 结 论
1)以D-(+)-樟脑磺酸为原料,合成得到11个鲜见文献报道的N′-取代苯磺酰基-N-樟脑磺酰乙二胺化合物(樟脑基双磺酰胺化合物),其结构均经FT-IR、ESI-MS、1H NMR和13C NMR确认。
2)采用离体法测试了目标产物对黄瓜枯萎病菌、苹果轮纹病菌、番茄早疫病菌、花生褐斑病菌和小麦赤霉病菌等5种植物病原菌的抑菌活性,发现化合物4b(R=p-OCH3)、4a(R=H)、4c(R=m-OCH3)和4d(R=m-CH3)对番茄早疫病菌的抑制率分别为91.3%,83.9%,83.9%和83.9%,均优于阳性对照百菌清(73.9%);化合物4b和4c对花生褐斑病菌的抑制率均为82.2%,优于阳性对照百菌清(73.3%),化合物4b对黄瓜枯萎病菌的抑制率达到90.8%。其中化合物4b对5种供试植物病原菌均显示最好的抑制活性,具有广谱抑菌活性,且对番茄早疫病菌、黄瓜枯萎病菌和花生褐斑病菌的抑制活性优于或接近阳性对照百菌清,是值得进一步研究的先导化合物。
致谢:抑菌活性测试由南开大学元素有机化学国家重点实验室生物活性测试室完成。
