鹿药抗真菌有效部位筛选及其作用机制研究
2021-11-30赵然然张梦莎罗凯英庞廷松赵鹏帅周翼鹏
刘 伟,赵然然,张梦莎,罗凯英,庞廷松,赵鹏帅,周翼鹏
(1.陕西科技大学 食品与生物工程学院 药学系,陕西 西安 710021;2.空军军医大学 药学院 药化和药分教研室,陕西 西安 710032)
0 引言
鹿药(SmilacinajaponicaA.Gray)为百合科(Liliaceae)鹿药属(Smilacina Desf)多年生草本植物,广泛分布于我国西北、西南、东北和华北等地,生于林下阴湿处或岩缝中,资源较丰富.鹿药地上部分是可食用的山野菜,其干燥根茎及根为我国民间常用中药[1-3].据《千金·食治》记载,鹿药性味“甘苦温,无毒,具有补气益肾、祛风除湿和活血调经的功效,可用于治疗风湿骨痛、神经性头痛、乳腺炎、月经不调、痈疖肿毒和跌打损伤等病症.鹿药还有润肺养阴、健脾、祛痰止血和清肿解毒的作用,也可治疗咳嗽、崩漏、体虚、吐血、咽喉肿痛和疮毒等症”[4].
现代药理研究表明,鹿药具有抗细菌、抗肿瘤和抗氧化等作用[4-8].前期本课题组首次研究报道鹿药的乙醇粗提物对各种真菌表现较好的广谱、杀真菌活性,初步的机制探索研究发现鹿药粗提物的抗真菌活性可能与增加细胞膜通透性,破坏真菌细胞壁超微结构有关[9].但鹿药抗真菌的具体有效部位或成分还不清楚,其作用机制亦不明确,因此本文研究了鹿药不同极性的溶剂萃取部位对各种真菌的作用,以及对真菌细胞壁的影响,为进一步研究鹿药抗真菌活性物质提供依据.
1 材料与方法
1.1 材料和仪器
1.1.1 主要材料和试剂
鹿药购于德尔康医药连锁(槐芽第四连锁店).将药材粉碎,称取5 g粉末,按料液比1∶20加100 mL 75%乙醇,冷凝回流提取2 h,旋转蒸发浓缩成浸膏.加水溶解后分别用石油醚、乙酸乙酯、水饱和正丁醇萃取三次,浓缩后分别得浸膏,均用二甲基亚砜(DMSO)配成储备液浓度均为0.333 g/mL,分装,-20 ℃保存待用.
乙醇、石油醚、乙酸乙酯、正丁醇、二甲基亚砜均为分析纯;阿尼芬净,MCE公司,批号011155125;两性霉素B(AmB),Acros公司,批号P1434922;氟康唑(FCZ),Sigma公司,批号036M4709V.
真菌菌种包括:白念珠菌SC5314、耐药白念珠菌103、光滑念珠菌、近平滑念珠菌、克柔念珠菌、热带念珠菌和新生隐球菌,均惠赠于上海市长海医院检验科.
1.1.2 主要仪器
GHP-9080型隔水式恒温培养箱(上海一恒科学仪器有限公司);THZ-98C型恒温震荡箱(上海一恒科学仪器有限公司);SW-CT-IF型超净工作台(苏州安泰空气技术有限公司);激光共聚焦显微镜(德国卡尔蔡司);多功能酶标仪(赛默飞世尔科技有限公司,芬兰).
1.2 实验方法
1.2.1 微量液基稀释法
挑取菌克隆少量,接种至YPD 培养液,35 ℃,200 rpm 振荡培养,使真菌处于指数生长期后期.以RPMI 1640培养基调整菌液浓度至103个/mL.取无菌96孔板,使各孔的最终药物浓度分别呈现倍比浓度减少,孔中DMSO含量均低于1%.每次配制药敏板的同时均制备一质控菌药敏板,各药敏板于35 ℃恒温箱培养.培养24 h,观察实验结果,并确定其最低抑制浓度(minimum inhibitory concentration,MIC)值[10].
1.2.2 生长实验
将耐药白念珠菌SC5314、103、新生隐球菌、克柔念珠菌、光滑念珠菌、热带念珠菌至液体YPD 培养基中培养过夜,离心收集菌体,PBS 洗涤,调整菌浓度至1.0×106cells/mL.加不同浓度的正丁醇部位(104μg/mL、208μg/mL、416μg/mL)、石油醚部位(416μg/mL)、乙酸乙酯部位(416μg/mL)、水部位(416μg/mL)作用24 h后拍照[9].
1.2.3 时间-杀菌曲线实验
将白念珠菌SC5314克隆至液体YPD 培养基中培养过夜.离心收集菌体,PBS 洗涤,RPMI 1640培养基调整菌浓度至1.0×105cells/mL,加不同浓度的正丁醇部位(104μg/mL、208μg/mL、416μg/mL)、石油醚部位(416μg/mL)、乙酸乙酯部位(416μg/mL)、水部位(416μg/mL).将菌液分装50 mL离心管中,振摇培养,于不同时间点(0、6 h、12 h、24 h)取出菌液,用PBS稀释不同的浓度,分别涂铺SDA平板,35 ℃,静置培养48 h后,数克隆数并计算CFU/mL数目[9].
1.2.4 生物被膜实验
将白念珠菌SC5314克隆于YPD培养基中培养过夜,经实验处理后,RPMI1640 培养基调整菌浓度至1.0×106cells/mL.菌悬液100μL加入96孔板,37 ℃粘附90 min后,PBS洗3次,再加入新鲜PRMI 1640或者含药的培养基,37 ℃培养24 h后,用XTT(0.5 mg/mL)/甲萘醌(1μM)孵育3 h,用多功能酶标仪检测波长为495 nm的吸收值.成熟生物被膜的检测:1.0×106cells/mL菌悬液100μL加入96孔板,37 ℃粘附90 min后,PBS洗3次,再加入新鲜PRMI 1640 37 ℃培养24 h后,PBS洗3次,加含药的培养基,37 ℃培养24 h后,用XTT(0.5 mg/mL)/甲萘醌(1μM)孵育3 h,用多功能酶标仪检测波长为495 nm的吸收值[11].
1.2.5 棋盘式微量液基稀释法
棋盘式微量稀释法是微量液基稀释法的延伸,即合用的两种药物于96孔板上以二维棋盘的纵(A至H)横(2至11)两方向分别进行二倍的倍比稀释.例如鹿药正丁醇部位与另一种抗真菌药物两性霉素B合用后,使得两性霉素B的终浓度为4μg/mL、2μg/mL、1μg/mL、0.5μg/mL、0.25μg/mL、0.125μg/mL、0.063μg/mL、0.031μg/mL、0.016μg/mL、0.008μg/mL,鹿药正丁醇的终浓度为104μg/mL、52μg/mL、26μg/mL、13μg/mL、6.5μg/mL.与鹿药正丁醇合用的其他抗真菌药物阿尼芬净的终浓度为:1μg/mL至0.002μg/mL.
部分抑菌浓度指数(Fractional Inhibitory Concentration Index,FICI)是评价联合用药的两药相互作用方式的主要参数.抑菌浓度分数(FIC),分别为每一种药物联合抑菌时所需MIC与单用时MIC的比值.而FICI指数则等于两种药物FIC之和.当MIC值高于检测最高限时以最高限浓度的两倍值用以计算FICI.当FICI≤0.5时两药的相互作用确定为协同作用,且FICI指数越小,协同作用越强;0.5
1.2.6 细胞毒性实验(CCK-8法)
96孔板每孔加入浓度为8×104个/mL的细胞悬液100μL,即8 000个细胞/孔,置37 ℃、5%CO2培养箱内.24 h后,上层培养液吸掉,加入含有不同浓度的鹿药正丁醇部位(6 660μg/mL、3 330μg/mL、1 665μg/mL、832μg/mL、417μg/mL、208μg/mL)的培养液,100μL/孔,37 ℃作用48 h.每孔加入CCK-8 10μL,置37 ℃、5%CO2培养箱内,作用1 h后,用多功能酶标仪测OD470nm值.
1.2.7 点板实验
挑取白念珠菌克隆于1 mL YPD中,35 ℃,200 rpm培养使其菌处于对数生长期,重悬于新鲜PRMI 1640,使菌浓度为1×106CFU/mL,加鹿药正丁醇部位(浓度为1/2MIC、MIC、2MIC),35 ℃,200 rpm培养1 h.5 000 rpm离心2 min收集,PBS涡旋混匀,重复清洗三次,PBS重悬,通过显微镜计数法调整菌浓度为1×107CFU/mL,按照5倍梯度稀释菌浓度,分别取3μl菌液点于YPD平板或YPD添加15μg/mL荧光素白(CFW),30μg/mL刚果红,2μg/mL 氟康唑(FCZ),0.5μg/mL 两性霉素B(AmB),25 ng/mL的阿尼芬净,平板放于35 ℃培养箱,培养,拍照[12].
1.2.8 激光共聚焦实验
挑取白念珠菌克隆于1 mL YPD中,35 ℃,200 rpm培养至菌处于对数生长期,PBS涡旋混匀,5 000 rpm离心2 min,重复清洗三次,再用0.5 mL PBS重悬,将菌液转移至1.5 mL EP管,加入CFW使其终浓度为50μg/mL,涡旋混匀,用锡箔纸包裹EP管避光,置于30 ℃培养箱,120 rpm震荡培养30 min.5 000 rpm离心2 min,去上清,PBS重复清洗3次,用PBS重悬,并通过显微镜计数方法调整菌浓度,取80μL于粘附载玻片上,避光静置通风,吹干,滴80%甘油10μL,盖上盖玻片,用锡箔纸将制片包被,放于4 ℃冰箱待用.激光共聚焦显微镜观察荧光(63×油镜,激发光405 nm),拍照[12].
2 结果与讨论
2.1 鹿药不同萃取部位对各种真菌的MIC值
由表1可知,正丁醇部位对7种真菌(白念珠菌SC5314、耐药白念珠菌103、光滑念珠菌、克柔念珠菌、近平滑念珠菌、热带念珠菌、新生隐球菌)的MIC值最小,对这7种真菌的MIC值范围为104~832μg/mL,而石油醚部位对这7种真菌的MIC值最高,MIC值范围为3 330μg/mL至大于3 330μg/mL;乙酸乙酯、水的部位次之,对7种真菌的MIC值范围为832μg/mL至大于3 330μg/mL.这结果说明鹿药正丁醇部位对7种真菌有较优的抗真菌活性,可能是鹿药发挥抗真菌活性的主要部位.
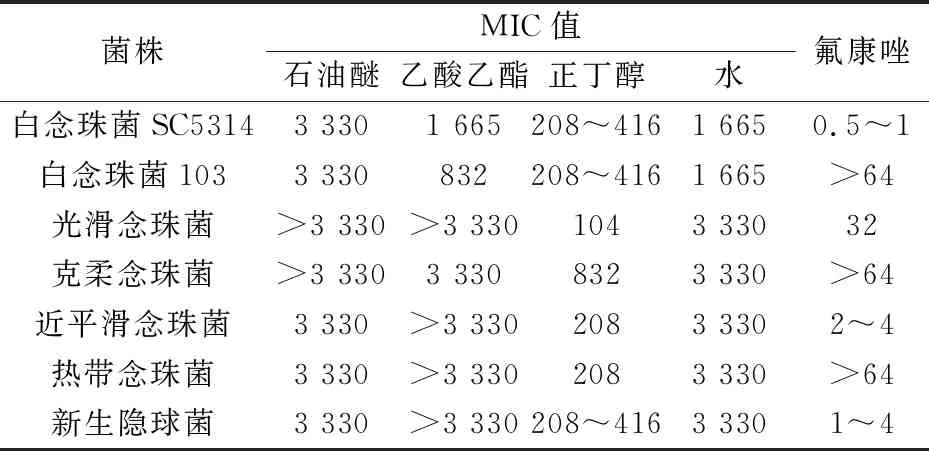
表1 鹿药不同萃取部位对各种真菌的MIC值 (μg/mL)
2.2 鹿药不同萃取部位对真菌生长的影响
由图1可知,当浓度为1/2MIC、MIC、2MIC的正丁醇部位作用各种真菌24 h后,6种真菌(敏感白念珠菌SC5314、氟康唑耐药白念珠菌103、新生隐球菌、克柔念珠菌、光滑念珠菌、热带念珠菌)的培养液均保持不同程度的澄清,其中5种真菌(敏感白念珠菌SC5314、氟康唑耐药白念珠菌103、新生隐球菌、克柔念珠菌、光滑念珠菌)在浓度为1/2MIC、MIC、2MIC的正丁醇部位作用后,菌液仍保持澄清状态,这说明正丁醇部位对6种真菌(敏感白念珠菌SC5314、氟康唑耐药白念珠菌103、新生隐球菌、克柔念珠菌、光滑念珠菌、热带念珠菌)均有抑制作用,其中对敏感白念珠菌SC5314、氟康唑耐药白念珠菌103、新生隐球菌、克柔念珠菌、光滑念珠菌的抑制作用更优.

图1 鹿药正丁醇部位对6种真菌生长的作用
2.3 鹿药不同萃取部位对真菌的时间-杀菌曲线
由图2可知,不同浓度的正丁醇部位(208μg/mL、416μg/mL)作用白念珠菌6 h后,存活菌落数均为0,且在12 h,24 h,三个浓度正丁醇部位组(104μg/mL、208μg/mL、416μg/mL)均无存活菌落数,而其他鹿药萃取部位(石油醚、乙酸乙酯、水)作用24 h后的存活菌落数与空白组无差异.这结果表明:鹿药正丁醇部位对白念珠菌具有较好的杀菌活性,且是鹿药发挥杀菌活性的主要有效部位.
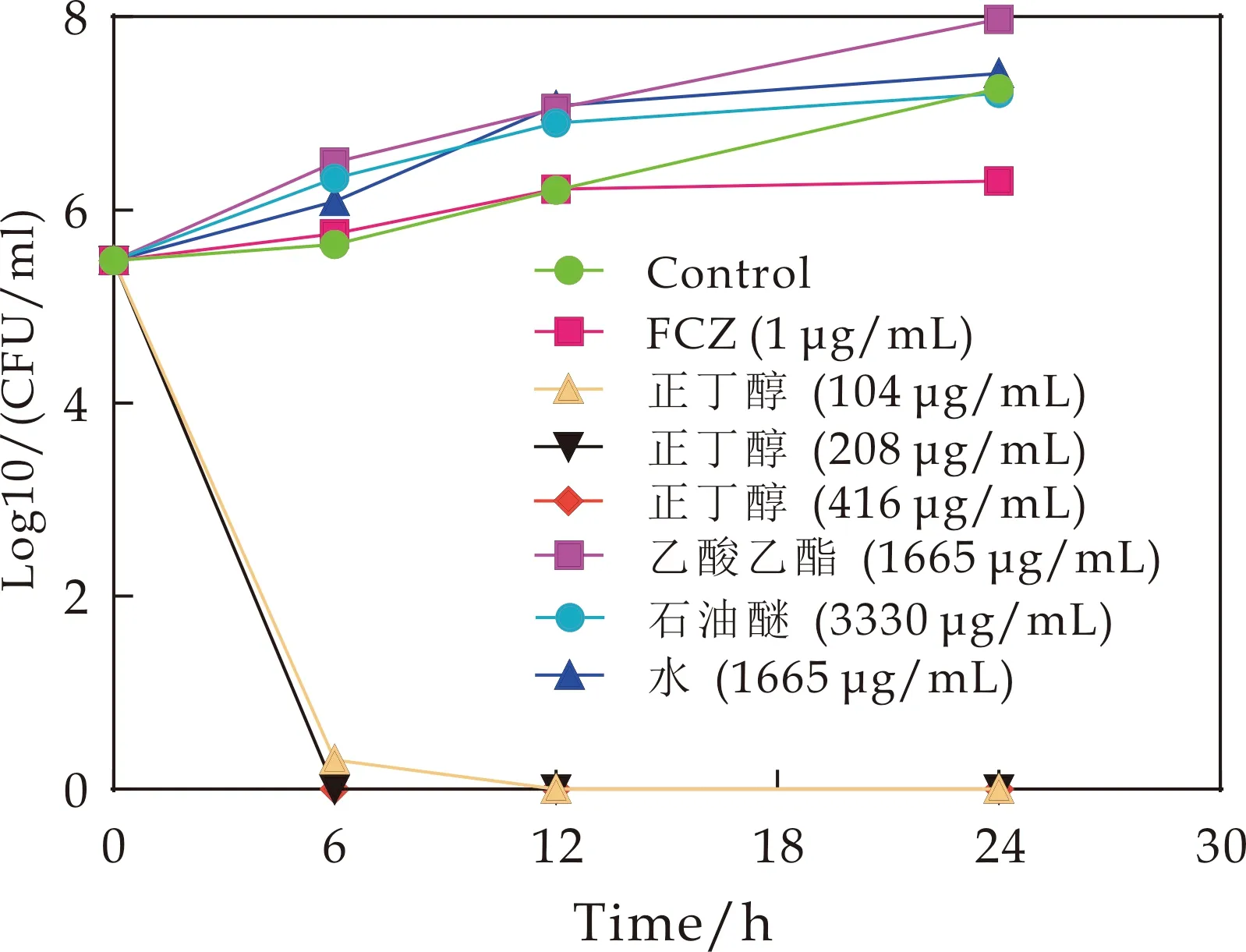
图2 鹿药不同萃取部位对真菌的时间-杀菌曲线
2.4 鹿药正丁醇部位对真菌生物被膜的影响
由图3(a)可知,当鹿药正丁醇部位在浓度为26μg/mL时,对生物被膜的形成表现明显的抑制作用(P<0.05),且随着浓度的增加,其抑制生物被膜形成能力亦逐渐增加.由图3(b)可知,鹿药正丁醇部位在较高浓度(1 665μg/mL、3 330μg/mL、6 666μg/mL)时,对成熟生物被膜具有明显的损伤作用(P<0.01).这说明鹿药正丁醇部位能明显的抑制生物被膜的形成,且在较高浓度时对成熟生物被膜也有一定的损伤作用.

(a)生物被膜的形成
2.5 鹿药正丁醇部位对正常细胞存活的影响
如图4所示,417μg/mL和208μg/mL鹿药正丁醇部位分别作用人胚肾293T细胞48 h后,细胞存活百分率分别为87.7±9.1%和84.0±4.9%.这结果表明:在正丁醇部位浓度为抗真菌的MIC(208μg/mL)和2MIC值(417μg/mL)时对正常细胞毒性较小.

图4 鹿药正丁醇部位对人胚肾293T细胞存活的影响
2.6 鹿药正丁醇部位与抗真菌药物的联合抗真菌作用
由表2可知,鹿药正丁醇部位与阿尼芬净合用后,对4种真菌(敏感和耐药白念珠菌、热带念珠菌和新生隐球菌)的敏感性均增加.阿尼芬净单用时对白念珠菌SC5314和103的MIC值分别为0.125μg/mL和0.063μg/mL,鹿药正丁醇部位MIC值均为416μg/mL.两药合用后,阿尼芬净的MIC值分别下降到0.031μg/mL和0.008μg/mL,鹿药正丁醇部位下降至52μg/mL和26μg/mL,同样地,阿尼芬净单用时对热带念珠菌MIC值为1μg/mL,鹿药正丁醇部位MIC值为1 560μg/mL.两药合用后,阿尼芬净的MIC值下降到0.125μg/mL,鹿药正丁醇部位下降至52μg/mL.两药合用对这四种菌的FICI值范围为0.157~0.315,均<0.5,提示鹿药与阿尼芬净具有协同抗真菌活性.
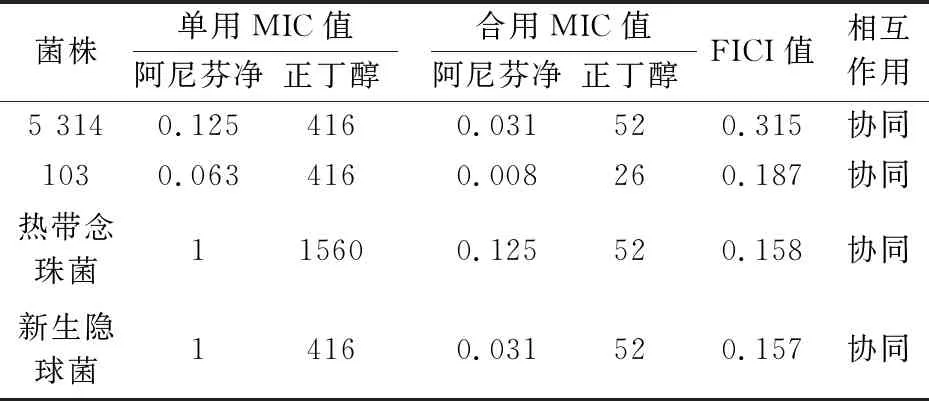
表2 鹿药正丁醇有效部位与阿芬尼净合用对真菌的MIC值 (μg/mL)
由表3可知,鹿药正丁醇萃取物与两性霉素B合用后,对3种真菌(敏感白念珠菌5314、热带念珠菌和新生隐球菌)的敏感性均增加.两性霉素B单用时对白念珠菌SC5314和103、新生隐球菌的MIC值均为0.25μg/mL,鹿药正丁醇萃取物MIC值均为416μg/mL.两药合用后,两性霉素B的MIC值分别下降到0.063μg/mL、0.125μg/mL和0.031μg/mL,鹿药正丁醇萃取物下降至52μg/mL,同样的,两性霉素B单用时对热带念珠菌MIC值为0.5μg/mL,鹿药正丁醇萃取物MIC值为1 560μg/mL.两药合用后,两性霉素B的MIC值下降到0.125μg/mL,鹿药正丁醇萃取物下降至52μg/mL.两药合用对白念珠菌5314、热带念珠菌和新生隐球菌的FICI值范围为0.25~0.375,均<0.5,提示鹿药与两性霉素B具有协同抗真菌活性.对耐药白念珠菌103,FICI值为0.625,提示鹿药与两性霉素B两药合用表现相加作用.

表3 鹿药正丁醇部位与两性霉素B合用对真菌的MIC值(μg/mL)
2.7 鹿药正丁醇部位作用后的真菌对各种药物刺激的敏感性
由图5可知,与对照组——正常YPD平皿相比,鹿药正丁醇作用后的真菌在含阿尼芬净、刚果红、荧光素白、两性霉素B的平皿上的真菌存活数量减少甚至无菌存活,在含氟康唑药物的平皿上真菌存活数量与空白组相比无差异.从以上结果可知:鹿药的正丁醇部位作用后的真菌对细胞壁抑制剂(阿尼芬净、刚果红和荧光素白)和细胞膜抑制剂两性霉素B均表现敏感性增强,提示鹿药可能对细胞壁有影响.
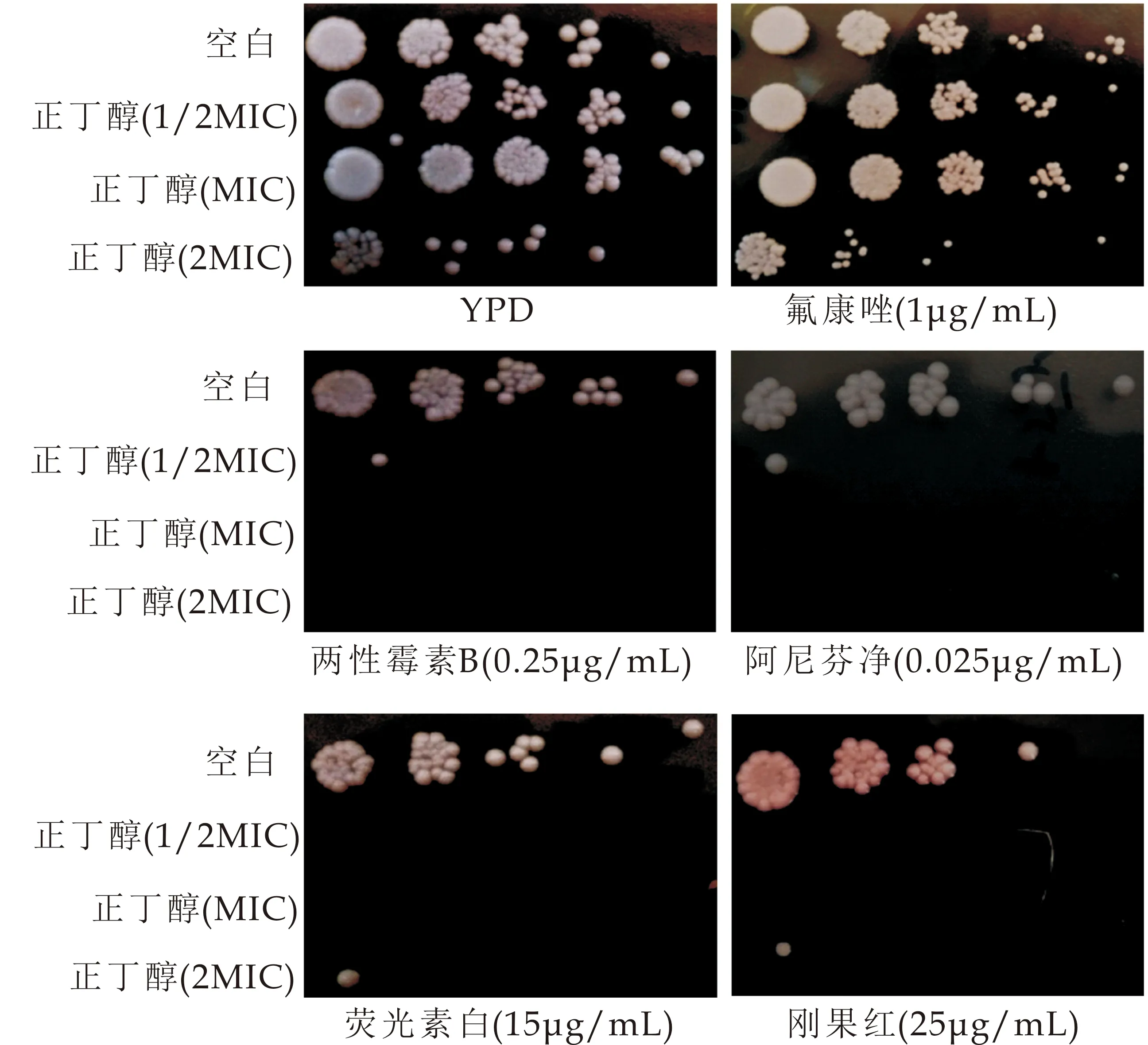
图5 鹿药正丁醇部位作用后的真菌对各种药物刺激的敏感性
2.8 鹿药正丁醇部位对真菌细胞壁几丁质的影响
从图6可知,空白组表现较弱的钙荧光白(Calcofluorwhite,CFW)荧光,阳性对照组(阿尼芬净)细胞壁表现较强的CFW荧光,而鹿药的正丁醇部位作用后的真菌也表现类似的较强的CFW荧光,并且真菌细胞也发生阳性组类似的聚集.文献报道阿尼芬净作用真菌后,会通过影响细胞壁葡聚糖的合成而引起细胞壁几丁质含量代偿性增加[13].本实验结果提示:鹿药的正丁醇部位可能对真菌的细胞壁有影响,直接或间接引起细胞壁几丁质含量的增加.

图6 鹿药正丁醇部位对真菌细胞壁几丁质的影响
3 结论
近年来,由于艾滋病、器官移植、恶性肿瘤患者等人数的增加,以及生物医学材料如静脉插管、心脏支架、气管插管、导尿管等越来越多的应用于人体,国内外研究报道,真菌感染尤其是侵袭性真菌感染的发生率和死亡率呈逐渐上升趋势[14,15].国内外临床统计分析发现,大多数医院深部真菌感染是由念珠菌引起的,其中白念珠菌构成比最高,其次为光滑念珠菌、近平滑念珠菌、热带念珠菌和克柔念珠菌.目前临床上可供选择的抗深部真菌感染药物种类有限,耐药菌株的产生,生物被膜的形成,以及药物本身存在的毒性,深部真菌感染治疗是临床上的一大难题.
本文研究了鹿药不同极性溶剂的萃取部位对真菌的作用,发现鹿药的正丁醇部位为抗真菌有效部位,其体外表现较好的广谱抗真菌甚至杀真菌活性,这与本课题组前期报道的鹿药乙醇粗提物的抗真菌活性类似.为了评价鹿药正丁醇部位的细胞毒性,本文通过CCK8实验发现鹿药正丁醇部位的抗真菌活性浓度明显低于其对正常细胞产生毒性的浓度.生物被膜的形成是临床抗真菌感染药物耐药性产生的重要原因之一.本文研究还发现,鹿药的正丁醇部位对白念珠菌生物被膜的形成表现较优的抑制活性,在较高浓度(1 665μg/mL)时,对成熟被膜还表现明显的损伤作用(P<0.01).为了解决临床抗真菌药物治疗可选择方案有限的问题,药物联用是近年来研究报道的热点策略之一[16].本课题组前期已报道鹿药粗提物与氟康唑联用对新生隐球菌和克柔念珠菌表现协同作用[9].本文研究发现,鹿药正丁醇部位还能与现有的抗真菌药物(两性霉素B和阿尼芬净)联用表现较好的协同作用.初步的抗真菌作用机制研究发现,鹿药正丁醇部位对真菌的细胞壁可能有损伤作用,直接或间接引起细胞壁多糖成分——几丁质含量增加,这与前期报道鹿药粗提物损伤细胞壁超微结构的结果相符[9].
综上所述,鹿药具有较好的抗真菌和抗生物被膜活性,正丁醇萃取部位为其抗真菌有效部位,本文为鹿药有效活性成分的研究及临床应用奠定了良好的基础.
