羊肉中多黏菌素A 和多黏菌素B液相色谱—串联质谱检测方法的建立
2021-11-29康博洋张欣昕冯小慧刘广华狄彩霞高天云
莎 娜,康博洋,张欣昕,杜 琳,冯小慧,刘广华,狄彩霞,高天云
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.呼和浩特市科学技术创新服务中心,内蒙古 呼和浩特
010090)
多黏菌素是一种发现于多黏杆菌培养液中的具有抗菌活性的多肽, 主要包括A、B、C、D、E等类型[1]。 其通过与革兰阴性菌细胞膜磷脂中带负电荷的磷酸根结合, 破坏脂多糖的稳定性,从而发挥抗菌作用[2-3]。细菌对该类抗菌药物不易产生耐药性,所以多黏菌素类抗菌药物常在动物的饲养过程中使用,并在动物体内残留,通过动物源性食品传递给人类,对人的肾和神经系统有一定的毒性[4-6]。 中国、美国、日本和欧盟等许多国家和地区批准其作为饲料添加剂或兽药使用, 但超量使用,不严格遵守休药期,可以使动物性食品中多黏菌素超过残留限量。 随着其在养殖业中广泛不合理应用、 缺乏科学指导以及法律监督等问题的出现, 动物性食品中多黏菌素的残留问题逐步受到各国的重视[7-9]。 针对其致毒性,我国农业农村部发布第235 号公告《动物性食品中兽药残留限量》对多黏菌素残留量做出了严格规定,要求其残留量在动物肌肉、 脂肪和肝脏中为150 μg/kg,肾脏中为200 μg/kg,第278 号公告同时禁止其在产蛋期和产奶期应用[10-12]。 羊肉作为人们的主要肉食品,其兽药残留必然是人们担忧的问题,为了保障羊肉食用安全, 需要建立一种同时检测羊肉中多黏菌素A 和多黏菌素B 残留量的准确、高效定量检测方法, 对该类药物在羊肉中的残留进行监测。
目前, 国内外对动物源性食品中多黏菌素类药物的检测方法有酶联免疫分析法(ELISA)[13]、微生物法[14]、高效液相色谱法等[15]。酶联免疫分析法抗体制备比较困难, 方法选择性差, 易出现假阴性、假阳性,定性难以保证,在实际检测中,一般采用进口试剂盒居多,价格昂贵,大批量使用受限。高效液相色谱法因为紫外吸收较弱且本身不具备产生荧光的基团,需经过衍生化再检测,检测过程繁琐、用时较长,无法作为常规定量检测方法。 微生物法灵敏度不高,选择性差,且耗时长,费时费力。近年来液相色谱—串联质谱(LC-MS/MS)技术由于灵敏度高、 定量准确和便于验证等优点应用于动物源性食品中β-内酰胺类和多肽类抗生素的多残留检测[16-18]。 该研究建立了一种快速高效的液相色谱—串联质谱方法, 通过对仪器分析条件、净化方式和提取溶剂进行优化,使所建方法能够满足现行检测要求。
1 材料与方法
1.1 仪器和试剂
LC-MS/MS 液相色谱—串联质谱仪(Waters-TQ-S Micro); 色谱柱Acquity UPLC BECH-C18(1.7 μm,2.1 mm×100 mm);高速冷冻离心机(上海安亭科学仪器厂);Milli-Q 超纯水仪(Millipore公司);NAI-DCY-12Z 氮吹仪 (上海那艾精密仪器有限公司);固相萃取装置(北京优昇联合科技有限公司);微孔滤膜(0.22 μm);VORTEX-GENIE 涡旋振荡器 (上海兰仪实业有限公司);AE270 电 子 天 平 (Mettler Toledo 公 司);pH 计(METTLER TOLEDO 公 司);Oasis WCX 固 相 萃取净化柱(60 mg/3 mL);均质器(IKA,德国);MCX 固相萃取净化柱 (60 mg/3 mL);HLB 固相萃取净化柱(60 mg/3 mL);乙腈、甲醇(色谱级,DIKMA,德国);甲酸(ACROS ORGANICS,赛默飞世尔科技公司);三氯乙酸、氨水(分析纯);多黏菌素A 和多黏菌素B 标准样品购于Dr 公司,纯度为99.7%;实验用水为Milli-Q 超纯水仪制造。
1.2 样品制备
取有代表性样品约0.5 kg,用组织捣碎机充分捣碎混匀分装,装入洁净容器作为试样,密封,标明标记,将试样置于-18 ℃冷冻保存。
1.3 标准溶液配制
分别称取适量的多黏菌素A 和多黏菌素B标准品,用甲醇分别配制成浓度为10 mg/L 的标准储备液,于2 ℃保存。
1.4 提取液配制
1.4.1 10%三氯乙酸溶液称取10.00 g 三氯乙酸,用水溶解,定容至100 mL。
1.4.2 10%三氯乙酸水溶液—乙腈溶液取30 mL 10%三氯乙酸溶液和70 mL 乙腈,混匀,现用现配。
1.5 试验方法
1.5.1 样品前处理提取:称取试样2.00 g(精确到0.01 g),置于100 mL 聚丙烯离心管中,准确加入10 mL“1.4.2”项下提取溶液,涡旋2 min后,5 000 r/min 离心5 min, 转移上清液至另一洁净离心管中, 样品残渣中加入10 mL 提取液重复以上提取操作,合并2 次提取液后,用氨水调pH值至9.0,5 000 r/min 离心5 min,上清液备用。
净化:依次用甲醇3mL、水3mL 活化平衡WCX固相萃取柱,取全部备用液上样,以小于2 mL/min的流速通过,备用液全部通过后,依次用5 mL 水、3 mL 甲醇洗涤固相萃取柱, 弃去全部流出液,在65 kpa 的负压下,减压抽至近干。 用5 mL 甲醇洗脱,收集洗脱液至10 mL 试管中,在45 ℃下氮气吹至约1.0 mL,用水定容至2.0 mL,涡旋混匀,过0.22 μm 滤膜,供液相色谱—串联质谱仪测定。
1.5.2 仪器条件
1.5.2.1 色谱条件色谱柱BEH-C18(1.7 μm,2.1 mm×100 mm);流动相如表1 所示;流速为0.3 mL/min;柱温:40 ℃;进样量:1.0 μL。

表1 梯度洗脱条件
1.5.2.2 质谱条件离子源:电喷雾离子源,温度为150 ℃。 扫描方式:正离子扫描(ESI+)。 检测方式:多反应离子监测模式(MRM)。 待测化合物定性离子、定量离子对及对应的锥孔电压、碰撞能量见表2。

表2 质谱分析参数
2 结果与分析
2.1 样品前处理条件优化
2.1.1 提取试剂的选择多黏菌素A 和多黏菌素B 属于多肽类抗生素,酸性条件下易溶解,且性质稳定。文献报道均采用强酸性水溶液和酸性有机溶剂提取动物肌肉中的多黏菌素残留[19]。 由于多肽类抗生素含有多个氨基,属于极性化合物,宜采用极性有机溶剂提取,该研究采用乙腈、丙酮和甲醇3 种有机溶剂,通过添加回收实验,考查3 种有机溶剂对提取效率的影响,结果见图1。
从图1 看出,乙腈提取回收率较高,甲醇溶解度好,但在提取动物组织时杂质较多,提取液较混浊,对多黏菌素B 的回收率有影响,丙酮提取回收率偏低,不予选择。根据目标化合物易溶于水的特性,选择乙腈作为有机提取溶液,分别比较了不同体积比(3∶7、5∶5、7∶3)的10%三氯乙酸水溶液—乙腈提取液的效果。结果显示,三氯乙酸水溶液占比多,提取样品时较混浊,难以过柱,有机相比例高净化时易过柱,提取效率高且基质干扰少,实验最终选择10%三氯乙酸水溶液—乙腈 (3∶7,V/V)作为测定目标化合物的提取溶液。
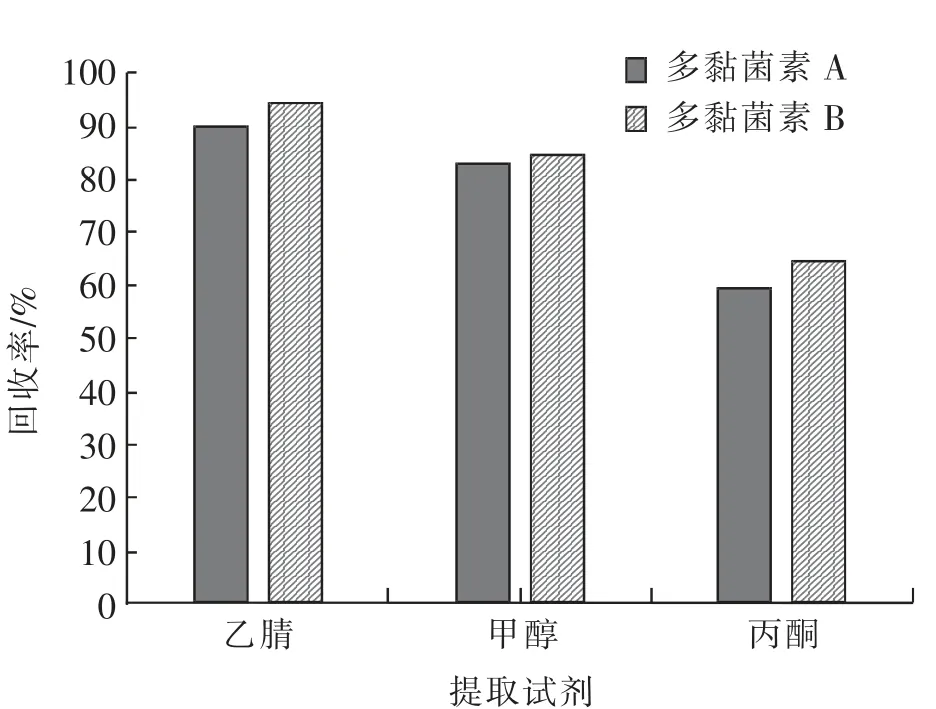
图1 不同提取有机溶剂的回收率
2.1.2 色谱条件的选择由于多肽类抗生素含有多个氨基,化学性质不稳定,极性强,试验选择了不同类型的色谱柱、流动相比例和梯度洗脱程序,通过对目标化合物标准品测试,最终选择保留能力强、柱效佳的BEH-C18(1.7 μm,2.1 mm×100 mm)色谱柱, 确定了用0.1%甲酸水溶液做流动相,采用梯度洗脱程序,多黏菌素A 和多黏菌素B 均得到较好保留,峰型良好且无干扰峰存在。
2.1.3 质谱条件的选择由于多黏菌素是由氨基酸缩合而成的肽类物质,分子量较大,在SCAN 模式下,易与1 个或多个H+结合产生带正电的单电荷或多电荷离子, 对待测物多黏菌素A 和多黏菌素B 进行一级质谱扫描, 获得母离子确定碎片离子,然后对碎片离子对应的碰撞能量CE 值等参数进行了优化。 多黏菌素A,在SCAN 模式下扫描得到母离子为390,其碎片离子为123 和199,对碎片离子123 对应的碰撞能量CE 值进行优化,通过比对发现, 碰撞能量CE 值为15、20、30、35 eV 时对应的丰度分别为5 000、5 100、5 300、5 600,依据产生最高丰度值,选择碎片离子199 对应的CE值为35 eV。 多黏菌素B,在SCAN 模式下扫描得到母离子为337,其碎片离子为111 和119,对碎片离子111 对应的碰撞能量CE 值进行优化,通过比对发现, 碰撞能量CE 值为15、25、35、40 eV 时对应的丰度分别为5 000、5 300、5 100、5 600,故选择碎片离子111 对应的CE 值为40 eV,经过优化得到目标物的离子图(见图2、图3)。 根据目标物出峰时间在1.5 min 附近, 运用质谱设置时间,在0~0.5 min 和3~10 min 切换至废液, 只有0.5~3.0 min 进样检测, 可以较好地维护仪器, 保护质谱端,延长使用时间。

图2 多黏菌素A 离子色谱图
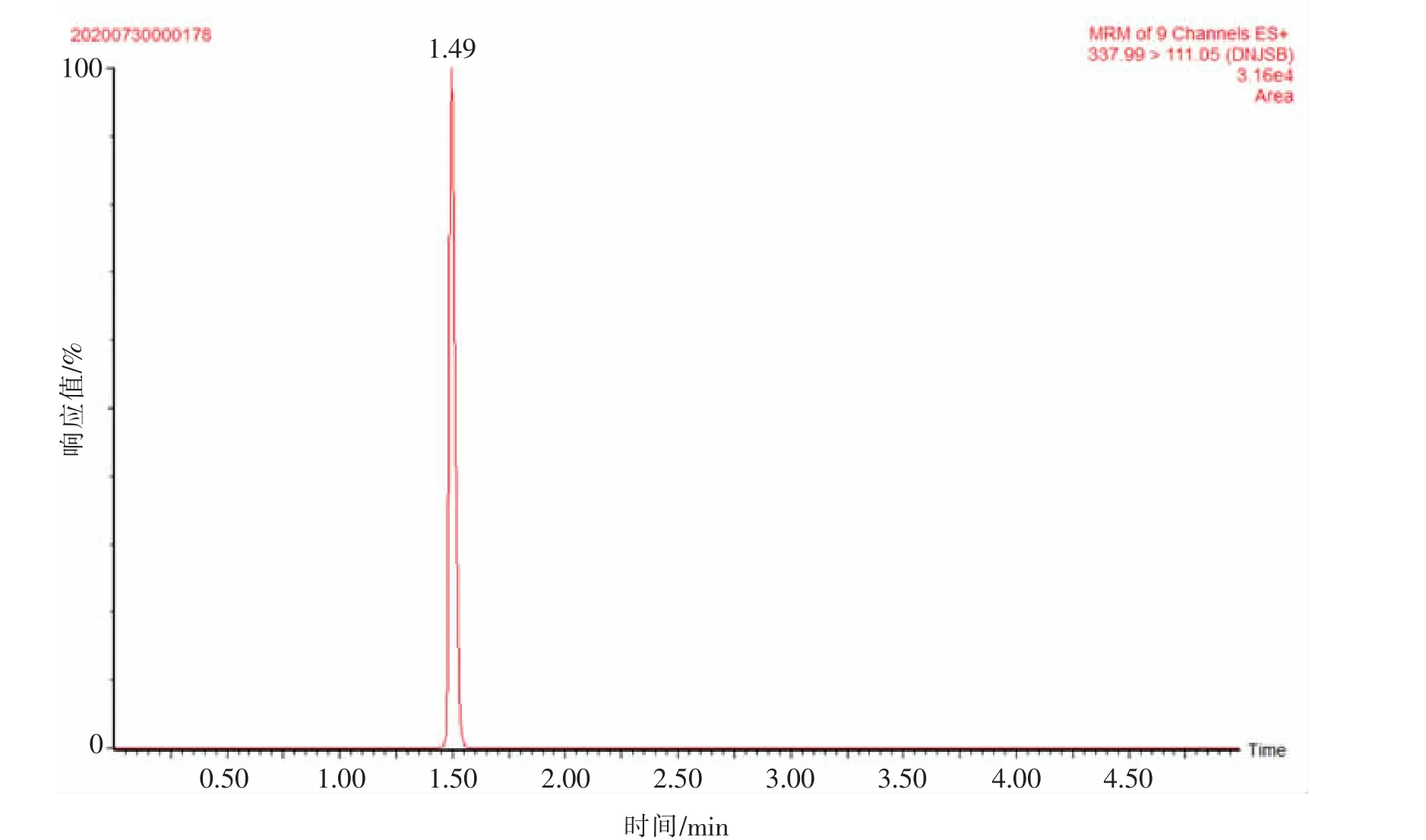
图3 多黏菌素B 离子色谱图
2.1.4 净化条件的选择实验考查了MCX、HLB、WCX、C18 4 种不同填料的固相萃取柱对样品净化效果的影响,并对净化步骤进行了优化,提取液调至碱性后直接过柱,从图4 可以看出,各固相萃取柱对待测物质都有一定的选择性,净化时C18、MCX 柱回收率低于50%,HLB 柱对样品的酸碱性要求较高,样品弱酸条件下易混浊,易堵,难以过柱。 pH 值范围更广的WCX 固相萃取柱净化回收率较高,实验最终选择WCX 固相萃取柱净化。
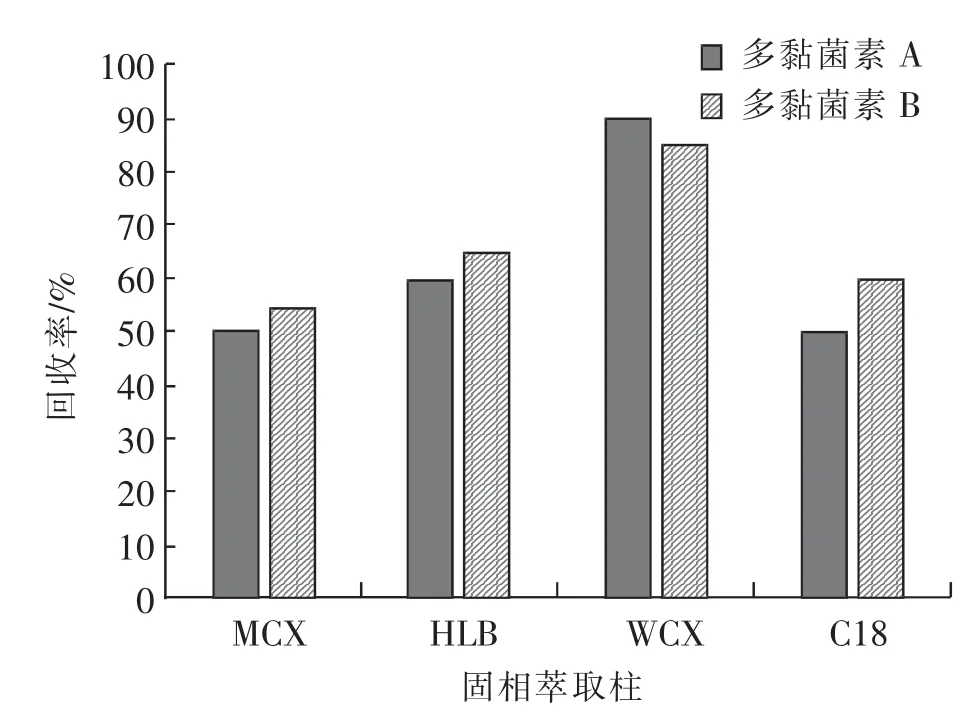
图4 不同固相萃取柱净化样品的回收率
2.2 标准曲线及相关系数
准确吸取 “1.3” 项下标准储备液0.10、0.20、0.30、0.40、0.50 mL 于6 份空白试样中, 按上述实验操作步骤进行提取,得到基质加标系列工作液,上机测试,用MRM 模式扫描,以基质加标系列工作液质量浓度为横坐标, 以目标化合物峰面积为纵坐标,绘制标准工作曲线,回归方程及相关系数见表3。 结果发现, 多黏菌素A 和多黏菌素B 在5.0~110 μg/L 浓度范围内呈良好线性关系。

表3 回归方程及相关系数 单位:μg/L
2.3 回收率及精密度实验
取空白羊肉样品,分别添加高、中、低3 个浓度水平的标准溶液,获得5、10、15 μg/kg 添加水平样品,每个加标水平进行3 次平行实验,按照上述实验过程提取、净化样品,上机测试,计算各添加水平下的回收率及精密度。结果表明,测试样品的平均回收率为70%~120%,RSD 小于10%,加标回收率、相对标准偏差见表4,以3 倍信噪比(S/N)计算检出限,以10 倍检出限计算定量限,最终确定方法的检出限为0.05 μg/kg,定量限为0.50 μg/kg。
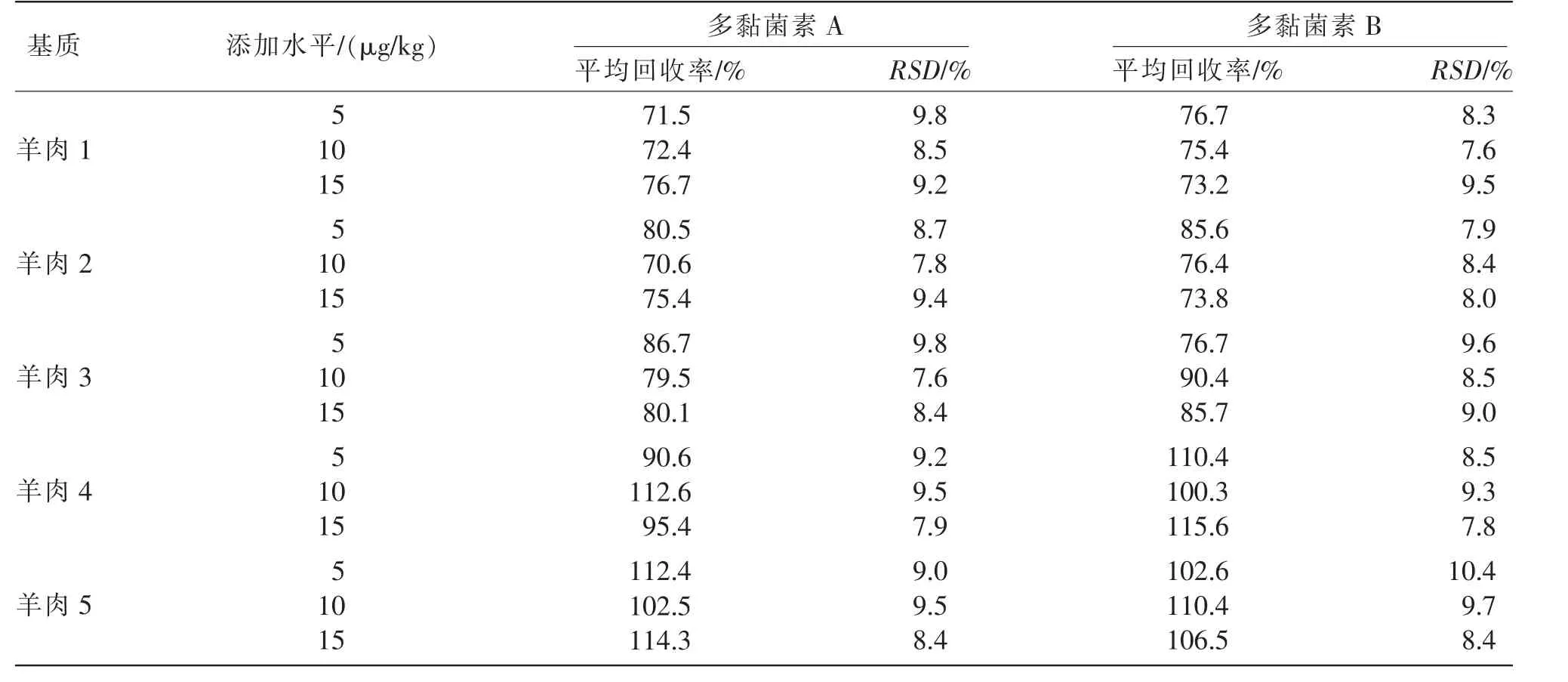
表4 回收率及精密度实验结果(n=6)
2.4 羊肉样品基质效应影响
由于实际样品中存在较多待测物之外的干扰物,在测定时会对待测物产生增强或者抑制作用。实验采用苏萌等[20]建立的基质效应确认方法,即对比样品提取净化后的基质添加溶液和标准品溶液的响应值考查方法的基质效应。 当比值等于或者接近1 时,表明不存在基质效应影响,比值大于1 时,说明被测化合物有离子增强作用,比值小于1 时,表明被测化合物有离子抑制作用。 由表5 可知, 两种多黏菌素类药物在羊肉基质中均存在强基质抑制效应,在实际检测过程中,为校正基质效应对结果的影响, 在定量分析中使用基质匹配标准曲线。

表5 两种待测物的基质效应
2.5 实际样品的测定
应用该研究建立的方法, 对内蒙古巴彦淖尔地区的羊肉样品进行检测, 采用基质标准曲线进行定量分析,结果良好,样品均未检出多黏菌素A和多黏菌素B,检测结果见表6。

表6 实际样品中多黏菌素A 和多黏菌素B 的检测结果 单位:份
3 讨论
该研究建立的羊肉中多黏菌素A 和多黏菌素B 的液相色谱—串联质谱检测方法, 考查多个提取液的提取效率, 样品最终采用三氯乙酸水溶液—乙腈直接提取;通过添加回收实验,考查不同固相萃取柱的净化效果,采用WCX 固相萃取柱直接净化, 净化液离心氮吹后经0.22 μm 有机滤膜过滤,上HPLC-MS/MS 分析测试,通过优化色谱、质谱条件使目标物均得到较好的分离; 经过基质效应研究, 选用羊肉基质添加标准溶液外标法定量,多黏菌素A 和多黏菌素B 检出限(LOD)和定量下限(LOQ)分别为0.05 μg/kg 和0.50 μg/kg,选择低、中、高3 个水平在羊肉中加标回收,计算多黏菌素A 和多黏菌素B 的平均回收率为70%~120%,相对标准偏差小于10%。 结果表明,两种待测组分在5.0~110.0 μg/L 浓度范围内线性关系良好,R 大于0.996。
4 结论
该方法快速准确,前处理简单,重现性良好,可以为日常分析检测羊肉中多黏菌素A 和多黏菌素B 提供技术支撑。
