利用绿色荧光蛋白报告基因筛选植物乳杆菌强启动子
2021-11-29萨初拉吴青海白苏乐其布日连海飞苏少锋付绍印
萨初拉,吴青海,,白苏乐,其布日,,高 娃,,连海飞,苏少锋,常 琰,付绍印,呼 和
(1.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031;2.天津科技大学,天津 300457;3.巴彦淖尔市动物疫病预防控制中心,内蒙古 临河区 015000)
乳酸菌被公认为是安全的食品级微生物(GRAS)[1-2],植物乳杆菌在发酵饲料、青贮饲料、微生态制剂、医药及食品等领域广泛应用[3-5]。 使用基因工程手段修饰改造植物乳杆菌, 可释放更大的应用潜力。 植物乳杆菌具有高氧耐受能力和生长发酵稳定性, 作为宿主表达重组蛋白方面的应用越来越受到人们的重视[6-8]。 随着基因工程技术的迅猛发展,目前综合利用基因组学、转录组学及细胞工程手段[9-10]提高化合物、代谢产物及酶产量的研究已成为热点[11]。 Van Kranenburg 等[12]对来自植物乳杆菌隐蔽质粒pWCFS101、pWCFS102进行了分析,同时利用其复制子构建了克隆载体。在植物乳杆菌表达系统中, 研究比较成熟的是pSIP 系统。 Sørvig 等[13-14]在pSIP300 和pSIP400 系列基础上构建了通用表达载体。在此基础上,通过引入乳杆菌素A 及乳杆菌素P 基因的启动子进一步构建了pSIP500 系列载体。 pSIP 系统是以细菌素Sakacin A 为诱导物的诱导型表达系统,该表达系统避免了宿主细胞过表达而中毒及新陈代谢的干扰,但需要添加细菌素Sakacin A 诱导表达,因此,不适合应用于饲料及食品的发酵和肠道环境[15]。
国内植物乳杆菌作为外源基因表达宿主的研究起步较晚, 近些年来的研究主要集中在植物乳杆菌内含质粒研究及利用pSIP 系统表达异源蛋白上, 而自主研发植物乳杆菌表达载体方面报道较少。 钟泽民等[16]以商品化乳杆菌表达载体pIAβ8 为骨架, 结合干酪乳杆菌超强组成型启动子SCP 以及M6 前体蛋白信号肽SP、猪表皮生长因子pEGF 基因等元件, 构建可以表达具有生物学活性pEGF 的植物乳杆菌表达载体pSCPS。 但表达载体pSCPS 的骨架pIAβ8 含有来源于大肠杆菌的复制子、 氨苄青霉素抗性基因和氯霉素抗性基因,不符合食品级应用要求[17]。
微生物基因表达水平主要与启动子强度[18]、基因拷贝数[19]、表达蛋白分泌到胞外效率[20]等有关。 组成型启动子即持续性启动基因转录的启动子,可用作调控元件构建表达载体,实现目的蛋白在胞内外大量表达。 但目前在植物乳杆菌基因工程改造中, 可实际应用的组成型启动子资源很有限。为构建植物乳杆菌高效特异表达载体,该研究以绿色荧光蛋白基因(GFP)作为报告基因,使用启动子Pefp(来自布赫内氏乳杆菌)、Ptuf34(来自布赫内氏乳杆菌)、Ptuf33 (来自植物乳杆菌)、P11(来自植物乳杆菌)替换pMG36e 载体原有P32 启动子。随后将该载体转化至植物乳杆菌H18 中,检测启动子在植物乳杆菌中启动转录的有效性、广泛性和强弱特性, 从而为后续构建高表达植物乳杆菌载体提供良好的研究基础和基因元件。
1 材料与方法
1.1 试验材料
1.1.1 菌种大肠杆菌Top10 感受态细胞(CB104)购自天根生化科技(北京)有限公司;植物乳杆菌H18 由内蒙古农牧业科学院生物技术研究中心提供。
1.1.2 主要试剂红霉素(A600192)购自上海生工生物工程 (上海) 股份有限公司,LB 培养基(HB0128)和MRS 培养基(HB0384)购自青岛海博生物技术有限公司, 琼脂 (N8290) 和琼脂糖(A8201) 购自北京索莱宝科技有限公司,EcoRⅠ限 制 性 内 切 酶 (1611),Hind Ⅲ限 制 性 内 切 酶(1615) 购自宝日医生物技术 (北京) 有限公司。pMG36e 表达载体(VECT75336)购自北京兴华越洋生物科技有限公司, 中量质粒提取试剂盒(DP106)购自天根生化科技有限公司。
1.2 试验方法
1.2.1 序列合成与测序委托南京金斯瑞生物科技有限公司依照表1 完成序列合成, 一代测序由上海生工生物工程(北京)股份有限公司完成。 合成的正确片段于-20 ℃保存,用于后续载体构建。

表1 启动子、荧光素酶报告基因及引物的合成
1.2.2 亚克隆的制备及鉴定将合成的正确片段利用EcoRⅠ和HindⅢ双酶切连接至pMG36e 载体,转化至Top10 感受态细胞,利用含有红霉素的LB 琼脂培养基筛选阳性克隆。 取生长的阳性克隆进行扩培, 进一步利用天根质粒提取试剂盒依照说明书进行质粒提取。 取约300 ng 质粒, 利用EcoRⅠ和HindⅢ限制性内切酶进行37 ℃水浴酶切40 min,将质粒和酶切产物进行1%琼脂糖凝胶电泳检测。 将电泳正确的克隆质粒送至上海生工北京分部进行目的片段的测序,测序正确的克隆质粒于-20 ℃保存,用于后续植物乳杆菌转化实验。
1.2.3 植物乳杆菌感受态制备取20 mL 培养至OD600nm值为0.6 左右的经甘氨酸处理的H18 植物乳杆菌培养物,离心收集菌体,用冷的SG 缓冲液洗涤并离心收集菌体,重复2 次。 利用500 μL SG缓冲液重悬菌体, 每离心管分装60 μL,-80 ℃冷冻保存,待用。
1.2.4 H18感受态转化取约1 μg 测序正确的质粒与H18 植物乳杆菌感受态混合, 利用伯乐电转仪, 选择1.5 kV、400 Ω、25 μF 参数进行植物乳杆菌的电转。 电转物重悬于MRS 培养基内,32 ℃培养2 h 后涂布于含有红霉素抗性的MRS 琼脂固体培养基,32 ℃培养筛选。
1.2.5 H18重组子鉴定利用天根质粒提取试剂盒对长出的克隆进行质粒提取, 并利用36echeck1-1 引物检测目的片段。
1.2.6 荧光强度的测定取1 mL PCR 检测呈阳性的H18 植物乳杆菌重组子培养物, 离心收集菌体后利用生理盐水洗涤收集菌体,200 μL 生理盐水重悬菌体。取少量重悬菌体利用Nikon 荧光显微镜观察绿色荧光表达情况, 结果如图3 所示。 取100 μL 重悬菌液至96 孔板,利用Thermo Varioskan Flash 酶标仪在激发光395 nm 和发射光509 nm 条件下测定荧光强度,同时检测600 nm 下的OD 值。通过计算单位OD600nm下的荧光强度获得样本的相对荧光强度(RFI),野生型H18 为阴性对照。
1.2.7 统计分析利用GraphPad Prism 软件对测得的荧光强度值进行Ordinary One-Way ANOVA分析,并标注显著性差异。
2 结果与分析
2.1 亚克隆质粒鉴定
由图1 可知, 所有合成片段获得酶切正确的阳性克隆。 通过测序结果得知构建的表达载体均含有序列完全正确的阳性克隆。
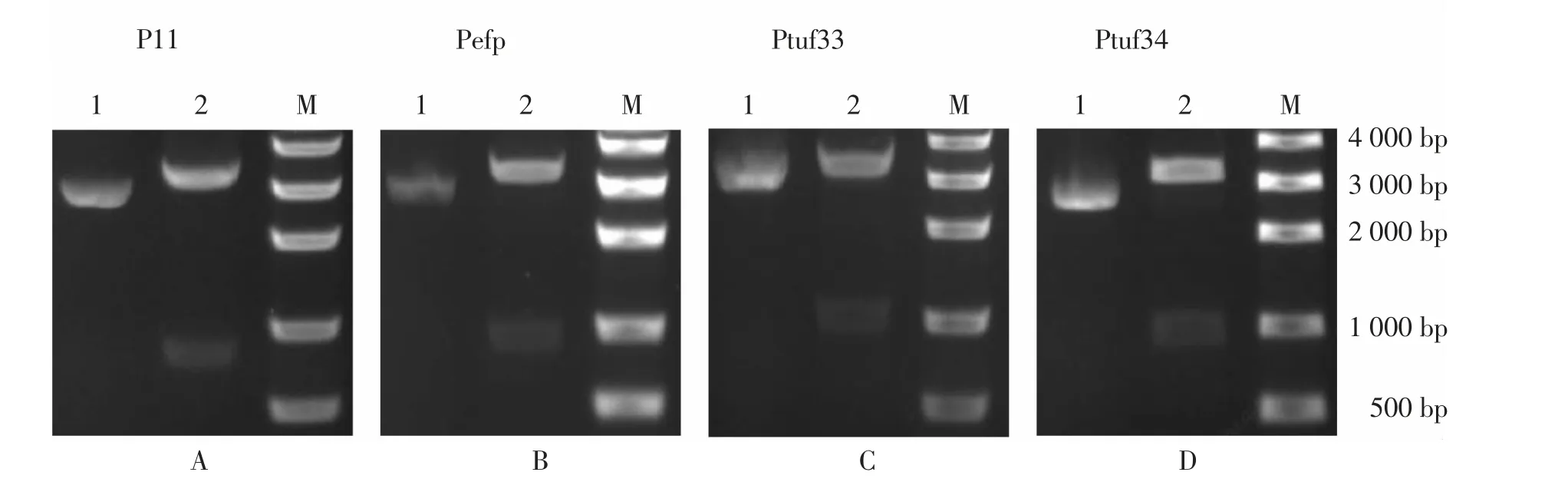
图1 pMG36e-promoter-GFP 载体质粒及酶切产物电泳图
2.2 植物乳杆菌重组子的鉴定
由图2 可知,PCR 结果显示每个表达载体均获得部分阳性克隆。 革兰阳性细菌具有特殊的细胞壁结构, 所以提取高纯度和浓度的质粒有一定难度,部分阳性克隆条带较弱。

图2 H18 重组子目的片段PCR 产物琼脂糖凝胶电泳检测图
2.3 植物乳杆菌重组子荧光检测
由图3 可知, 在荧光显微镜下可以观察到植物乳杆菌重组子均有荧光信号, 除了转化pMG36e_Pefp-GFP 质粒的H18 重组子均具有较强的荧光信号。 为更好地定量荧光信号,利用酶标仪检测600 nm 下的OD 值, 并据此计算相对荧光强度, 结果如图4 所示。 由结果可知转化pMG36e_Ptuf33-GFP 和pMG36e_Ptuf34-GFP 质粒H18 重组子相对荧光信号最强, 其相对荧光强度平均值分别为3.35 和3.51, 极显著 (P<0.01)高于其他组。 而转化pMG36e_P11-GFP 质粒H18 重组子平均相对荧光强度为2.699,同样极显著(P<0.01)高于转化pMG36e_Pefp-GFP 质粒H18 重组子和阴性对照组的相对荧光强度。该研究中转化pMG36e_Pefp-GFP 质粒H18 重组子相对荧光强度与阴性对照无显著差异,说明Pefp 启动子无法在植物乳杆菌H18 中强表达目的基因。
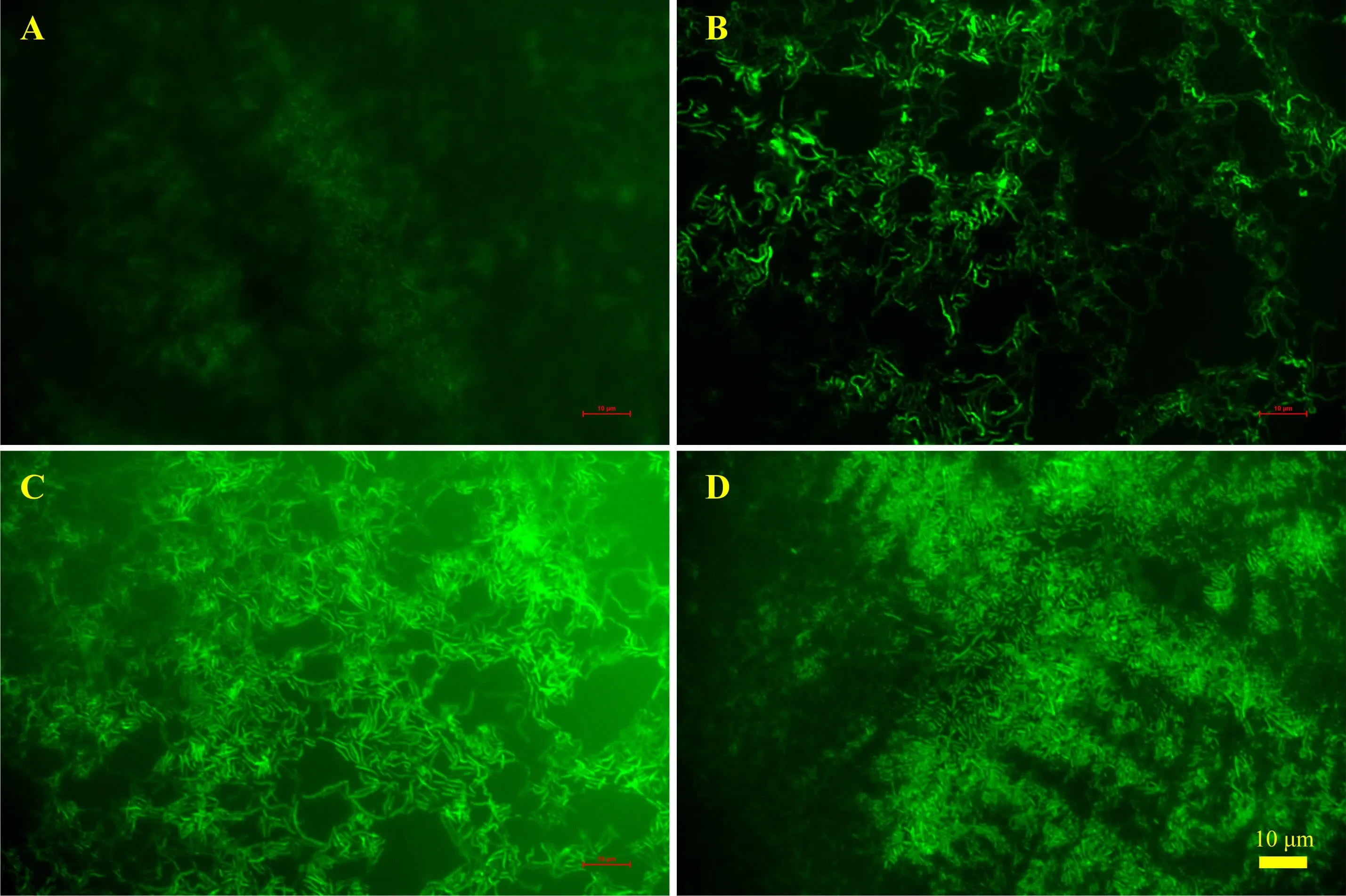
图3 酶标仪检测H18 植物乳杆菌重组子绿色荧光结果
3 讨论
已知原核微生物基因的表达水平主要与启动子强度[18]、基因拷贝数[19]、表达蛋白分泌到胞外效率[20]等有关。 已报道的乳酸菌表达系统中所用启动子大多为诱导型启动子, 如细菌素Sakacin A、木糖等诱导型启动子。 虽然这些诱导物为食品级的,但在大规模发酵生产中,诱导物的添加往往会使得工艺变得繁琐,生产成本增加。而组成型启动子在这方面具有一定的优势,能够简化工艺,节约成本。 强启动子P11 是植物乳杆菌WCSF1 的rRNA 启动子, 应用于pSIP 表达系统。 Ptuf33 和Ptuf34 分别为植物乳杆菌CD033 和布氏乳杆菌(L. buchneri)CD034 转录延伸因子TU(translation elongation factor TU)基因启动子序列。Pefp 为布氏乳杆菌(L.buchneri)CD034 延伸因子P(translation elongation factor P)基因启动子序列。 为更好地检测启动子特性, 选择了具有广泛寄主特性的pWVO1 复制子的乳酸菌穿梭表达载体pMG36e[21]。依照Tauer 等[22]的报道,启动子SD 序列与报告基因起始碱基的距离最佳为8 bp, 所以在该研究中为更好地比较启动子特性, 设计此间隔序列为8 bp 进行合成。 由图4 可知,启动子P11、Ptuf33 和Ptuf34 所表达GFP 荧光信号显著高于Pefp 和对照组,而启动子Pefp 所表达GFP 荧光信号与对照组无显著差异,说明启动子Pefp 不能在植物乳杆菌中有效表达目的基因。 Ptuf33 与Ptuf34 启动子在该研究中显著高于P11 启动子表达报告基因,虽然这两个强启动子取自不同的植物乳杆菌种,但其转录效率无显著差异, 这可能是由于它们源自相同基因。

图4 酶标仪检测H18 植物乳杆菌重组子绿色荧光结果
4 结论
通过该研究可知P11、Pefp、Ptuf33 和Ptuf34 4个启动子中转录延伸因子TU 基因启动子Ptuf33和Ptuf34 在受体植物乳杆菌中表达目的基因水平显著高于其他启动子, 可以作为后续构建高表达植物乳杆菌载体的基因元件, 为开发植物乳杆菌高效表达系统奠定良好的研究基础。
综上所述, 植物乳杆菌的基因工程展现出广阔的应用前景。然而,植物乳杆菌表达系统还处于研究和完善阶段, 缺少有效的商业化的表达载体和受体菌株, 建立一种高效表达外源蛋白且达到食品级的表达系统是使其发挥更重要作用的关键。该研究主要对植物乳杆菌启动子进行研究,从而为通过提高启动子强度和复制子的拷贝数提升工程菌的表达水平提供理论依据。
