铅对骨代谢生化指标影响的研究进展
2021-11-29林露茜徐婷婷曹芹芹张朝栋郑晶晶贺秀媛黄淑成
林露茜,徐婷婷,曹芹芹,岳 珂,张朝栋,郑晶晶,贺秀媛,黄淑成
(河南农业大学兽医学院,河南 郑州 450002)
众所周知,铅是三大重金属污染物(铅、汞、镉)之一。近年来,铅被加入有毒有害污染物名录。目前,我国铅生产业因无技术提升,导致能源消耗多,排污量大,成为我国铅污染严重的首要原因之一[1]。 另一方面,由于生物代谢不能分解重金属,铅在环境中成为持久性的污染物。 而人和动物一旦饮用含铅的水或长期使用铅制品, 会造成铅在体内的蓄积,进而影响机体各系统功能。医学研究表明, 铅在人体的分布随时间和蓄积量的变化而变化,早期存在于血液等软组织中,数周后,从软组织转移到骨并以溶解度极低的磷酸铅形式沉积下来,且骨铅负荷可达95%。 当缺钙或因饮酒、服用酸性药物等改变体内酸碱平衡, 以及发生骨骼疾病时(如骨质疏松症、骨瘤等),将导致骨内蓄积的磷酸铅转化为易溶的磷酸氢铅进入血液循环,引起铅中毒症状发作或加重症状[2]。
骨骼是人和动物机体的支架, 不仅有造血功能,还是重要的矿物质仓库。其主要功能是保护内脏同时为肌肉收缩提供附着点。 骨骼中的细胞也在持续进行细胞代谢,通常将其称为骨代谢。骨代谢从功能上可分为骨吸收和骨形成, 在整个过程中破骨细胞和成骨细胞发挥重要作用[3],前者可以吸收骨基质,而后者能够合成骨基质。骨代谢生化指标是反映骨代谢状态和辅助代谢性骨病的诊疗、鉴别诊疗以及疗效评价的重要指标,经常用于临床试验, 并且为骨质疏松症的治疗提供有效信息。 骨代谢生化标志物可概括为一般生化标志物如血钙、尿钙、尿磷等,骨代谢调控激素和骨转换标志物(BTMs)[4]。 骨代谢生化指标实现动态监测机体骨代谢状况, 通过高水平表达反映全身骨形成与骨丢失的关系[5]。
由于骨骼是铅毒性作用的重要靶器官, 在骨骼中的积累能直接对成骨细胞和破骨细胞产生损伤[6]。 目前,铅通过影响骨代谢相关指标如钙磷代谢、骨形成标志物等影响骨骼的生长发育,导致骨发育异常、骨钙化障碍的研究备受关注。该文就铅对骨形成标志物、 骨吸收标志物以及骨代谢相关激素的影响进行综述。
1 铅对骨形成标志物影响
BTMs 是反映骨骼细胞活性与骨基质代谢水平的生化产物,通常分为两类,即骨形成标志物和骨吸收标志物, 两者的生化指标可以从血液或尿液中检测到, 且骨形成标志物和骨吸收标志物选择性地组合可以表达成骨细胞和破骨细胞的代谢活性[7]。 骨形成标志物是在骨质形成过程中由成骨细胞生成并分泌到血液循环中的物质。 通常认为,骨形成标志物主要包括骨钙素(OC)、骨特异性碱性磷酸酶(BALP)、骨保护素(OPG)、Ⅰ型前胶原氨基端前肽(PINP)和Ⅰ型前胶原羧基端前肽(PICP)[8]。 OC、BALP、PINP 是反映骨形成的特异性生化指标,通常OC 作为成骨细胞成熟的标志,而BALP 和PINP 在骨形成前期敏感性较好。 目前,这方面研究结果更多来自小鼠或大鼠,人医方面将其与糖尿病或骨瘤等疾病相结合做出的调查同样意义重大(见表1)。 临床上,骨形成标志物的测定结果结合骨密度值, 常可用于骨质疏松症的诊断, 也可用于鉴别原发性骨质疏松和继发性骨质疏松。 另外,在骨质疏松症的治疗过程中,定期采取血液测定骨形成标志物数值, 可通过动态观察数值变化评估治疗效果。此外,在继发性骨质疏松症的鉴别中, 骨形成标志物测定可起到决定性作用。
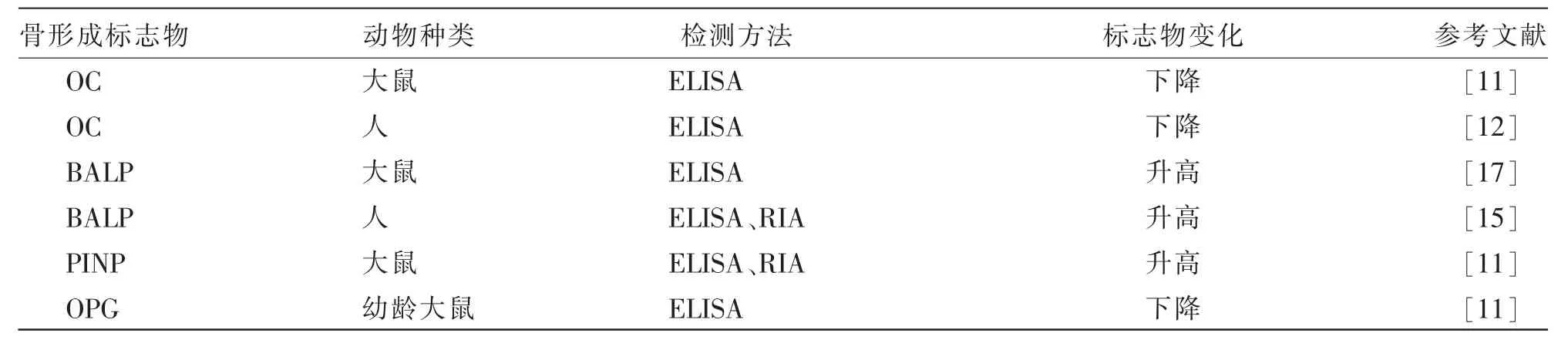
表1 铅对骨形成标志物的影响
1.1 骨钙素
骨 钙 素 (osteocalcin,OC 或bone glaprotein,BGP)是骨组织中含量最丰富的非胶原蛋白,大部分与骨基质内的羟磷灰石(HA)紧密结合。 堆积在骨基质中的羧化OC 能有效吸引并使HA 附着,抑制异常HA 结晶的形成, 降低生长软骨矿化的速度[9]。已有研究发现OC 是成骨细胞分化成熟的标志,主要参与骨吸收的调节、基质的矿化过程与成骨细胞的分化[10],因此,OC 是反映骨形成的特异性生化指标。 Zhang 等[11]的研究发现,铅暴露大鼠骨内OC 水平有所下降, 经螯合治疗部分情况好转,说明铅暴露可影响成骨细胞的分化和增殖;路小婷等[12]证实了铅接触可引起工人血清OC 水平降低;吴焕卿[13]和刘康生等[14]研究结果也支持铅抑制OC 合成分泌的观点。 另外,在分子水平上进一步发现, 铅减少OC 的产生并抑制碱性磷酸酶的活性[15],因此,研究OC 在骨代谢过程中的作用可能对预防铅中毒有重要意义。
1.2 骨特异性碱性磷酸酶
骨特异性碱性磷酸酶 (bone specific alkaline phosphatase,BALP) 是成骨细胞产生的一种糖蛋白,在特异水解酶作用下,释放入血,在骨骼发生病变时其活性增加,以促进钙盐沉积于骨骼内。通常成骨细胞成熟和具有活性的标志就是BALP,且被认为是最精确的骨形成标志物之一[3]。 张玲[16]通过探讨血清BALP 与非小细胞肺癌骨转移的相关性, 结果发现,BALP 升高对诊断骨转移的灵敏度为86.7%,特异度为83.3%,即BALP 对诊断骨转移灵敏度高, 因此,BALP 可为骨转移的早期诊断、 治疗效果的监测、 病情预后等提供有效的依据。 铅对成骨细胞的直接作用是抑制其合成、分泌BALP, 但探讨胎儿期低水平铅暴露对新生儿骨代谢的影响发现BALP 水平与血铅浓度成正相关[15];在铅致大鼠骨骼损伤的干预作用研究中,也发现铅暴露使BALP 活性上升[17],这与铅对骨骼细胞水平的毒性作用相悖, 提示可能与铅毒性作用引起的钙、VD 降低有关。
1.3 Ⅰ型前胶原C-端前肽/N-端前肽
Ⅰ型前胶原C-端前肽 (type Ⅰprocollagen carboxyl-terminal peptide,PICP) 和Ⅰ型前胶原氨基末端肽(type Ⅰprocollagen amino-terminal peptide,PINP)来自Ⅰ型胶原,占有机骨基质的90%。胶原合成中前胶原的细胞外加工包括切割氮末端和碳末端延伸前肽。 因为这些前肽与新形成的胶原分子以1∶1 的化学计量比产生[18],在一定范围内血液中PINP 水平作为特异指标反映成骨细胞活性、骨形成以及Ⅰ型胶原合成速率,是具有真正意义的骨形成标志物[9]。目前,大量研究表明PINP与多种骨代谢疾病密切相关,且其检测不受食物、激素等干扰因素影响。 因此, 与PICP 相比,PINP是骨形成更特异和敏感的指标, 是一个优质的新型骨代谢疾病的临床诊断标志物, 可以利用放射免疫法进行检测[19]。研究发现,铅暴露大鼠在成骨细胞增殖期间分泌的早期骨形成标记物PINP 增加[11],这与OC 水平表达不一致,推测原因可能是铅损害成熟的成骨细胞,降低OC 水平,而未成熟的成骨细胞增加并分泌更多的PINP,以维持机体骨骼生长发育的平衡[20]。
1.4 骨保护素
骨保护素(ostoeprotegerin,OPG)是一种分泌的肿瘤坏死因子受体相关蛋白,在体外和体内对破骨细胞分化和维持骨密度具有负调节的作用[21]。OPG 在多种骨细胞中均有表达,如成骨细胞、破骨细胞等[22-23]。 OPG 对骨的作用表现在OPG 对OC的作用上, 即抑制OC 的分化、 活化成熟和诱导OC 的凋亡,还能影响OC 的存活,通过减少OC 的数量减少骨吸收[24]。现代研究发现,参与调节骨重建最重要的分子系统之一是OPG/RANK/RANKL信号通路及相关分子, 这对女性绝经后骨质疏松症的防治意义重大[25]。研究表明,OPG 基因的表达受雌激素调节, 雌激素是一种控制包括维持骨量在内的多种生理过程的关键激素[26]。 女性绝经后骨代谢发生变化,血清中OPG 持续升高,且与年龄成正相关[27],由此推测雌激素缺乏时破骨细胞功能活跃,机体代偿性骨吸收,导致骨形成增加,OPG 水平升高。 在研究铅暴露对不同年龄组大鼠骨代谢的影响中, 发现铅暴露主要使幼龄大鼠OPG 水平下调, 而青年大鼠和成年大鼠在铅暴露后OPG 蛋白表达和基因表达均无明显变化[11];在铅暴露对胎儿影响的研究中也发现孕妇低浓度铅暴露能直接影响新生儿骨代谢[28],因此,可以推测婴幼儿时期骨代谢生化指标对铅暴露更敏感。
2 铅对骨吸收标志物的影响
骨吸收标志物代表破骨细胞活动以及骨吸收的代谢产物,特别是骨基质的降解产物,主要包括Ⅰ型胶原交联C-末端肽(CTX)、Ⅰ型胶原交联N-末 端 肽 (NTX)、 抗 酒 石 酸 酸 性 磷 酸 酶-5b(TRACP5b)、 尿吡啶啉 (PYD) 和尿脱氧吡啶啉(DPD)等物质[29]。 这些指标的测定能帮助鉴别骨转换的类型、计算骨丢失的速率和评估骨折风险,有益于治疗方法的选择以及疗效的监测。 但在临床发生铅中毒时,NTX、TRACP、PYD 等不常作为检测指标,实验研究中也鲜有报道。 目前,临床与实验研究中较多推荐β-Ⅰ型胶原交联C-末端肽(β-carboxy-terminal cross-linking telopeptide of type I collagen,β-CTX)作为骨吸收的标志物。
除此之外, 对CTX 的研究报道也较多,CTX由破骨细胞介导的Ⅰ型胶原蛋白降解并释放到血液中,而后在骨中由丰富的有机物质构成。Ⅰ型胶原蛋白C 末端肽α1 链经过β 异构化和消旋化形成血清CTX[30]。 血清CTX 可反映破骨细胞的骨吸收活性,Brito 等[31]和Monir 等[32]研究结果均显示,铅暴露后,CTX 浓度显著增加,表明此时破骨细胞高度活跃,加速骨吸收,进而影响骨代谢的平衡。
3 铅对骨代谢调控激素的影响
在骨代谢过程中, 发挥激素调节作用的主要有钙磷代谢调节指标、激素以及细胞因子。钙磷代谢是影响骨代谢以及骨病痊愈的重要因素, 正常的钙磷代谢能够促进骨的形成以及骨骼矿化[33]。钙磷代谢调节指标主要包括甲状旁腺激素、 降钙素和VD3及其代谢产物(见表2)。

表2 铅对骨代谢调控激素的影响
3.1 甲状旁腺激素
甲状旁腺激素 (parathyroid hormone,PTH)是甲状旁腺主细胞分泌的多肽类激素,骨、肾以及小肠是其主要靶器官。PTH 作用于骨时,能加快骨质吸收,使骨钙转入血液。 当血钙降低时,PTH 可间接诱导破骨细胞的增殖、分化,促进骨基质的吸收,进而使骨钙释放满足身体对钙的需求。因此,通常情 况 下,铅 暴 露 后 机 体 血 钙 水 平 变 化 不 大[2,34-35]。铅能损伤甲状旁腺, 从而影响PTH 的生成及VD3的羟化,进而干扰钙磷代谢。 铅暴露后,PTH 浓度代偿性增加,以维持血清钙水平。 有研究发现,铅中毒儿童血清PTH 表达增加与全血中OC 含量轻微下降有相关性[36]。宋波等[37]的实验结果显示,低浓度铅暴露可造成未怀孕小鼠血清总PTH 水平升高44.21%,证实了铅可对小鼠甲状旁腺的功能造成直接影响。而郝称莉等[38]的研究结果显示,一定剂量的钙可通过调节骨骼中的BGP 和PTH 的变化,缓解铅导致的骨代谢紊乱,从而保护骨组织的损伤。
3.2 维生素D3
VD3可以促使骨钙动员到循环中, 促进钙盐堆积在骨基质内[33]。 VD3代谢产物中活性最高的是1,25(OH)2D3。1,25(OH)2D3是调节骨代谢的重要激素,具有极强的生物活性,可促进人体小肠上皮细胞吸收钙、磷并加速入血,还可作用于成骨细胞,影响遗传信息转录过程,促进蛋白质合成和细胞分化,加速成骨作用。 研究表明[39],铅可使1,25(OH)2D3分解增加,降低血中活性维生素D水平。 Needleman[40]研究指出,随着体内铅浓度增加,儿童1,25(OH)2D3水平降低,进而影响骨发育。 董秋颖等[41]在研究维生素D 受体(VDR)基因与血铅水平的meta 分析中发现, 不同VDR 基因位点的血铅水平有差异, 在普通人群中携带b 基因的人血铅含量较高,因此,铅的接触水平还可能与一些调控基因有关。
3.3 降钙素
降钙素(calcitonin,CT)由甲状腺的滤泡旁细胞(明亮细胞或C 细胞)产生和分泌,能够降低血钙、血磷的浓度;阻止小肠对钙离子的吸收,使体内血钙浓度降低,导致血中游离钙转至骨组织中[3]。CT 能直接作用于人的成骨细胞, 使其增殖分化,但CT 主要靶细胞是破骨细胞,对其骨吸收功能有显著的抑制作用。 另外,CT 还能抑制破骨细胞成分的生成,如酸性磷酸酶等[42]。当铅镉联合使用致大鼠亚慢性中毒后,测定血清中PTH 和CT 浓度,结果发现PTH 水平上升,而CT 水平下降,该结果表明铅镉联合染毒可使大鼠钙磷代谢紊乱, 进而影响骨代谢过程[43]。
4 其他
此外,与骨代谢相关的指标还有细胞因子,如白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(IL-6)、转化生长因子(TGF)、胰岛素生长因子-1(insulin like growth factor-1,IGF-1);激素,如生长激素(growth hormone,GH)、雌激素和睾酮等(见图1)。申海琴等[44]研究还发现,持久职业性铅暴露会造成促炎细胞因子与血管生成因子的浓度均升高,影响骨骼细胞营养吸收,进而影响骨骼的生长发育。 徐焰等[45]研究发现,铅可能通过促进IGF-1相关信号通路分子的磷酸化从而影响IGF-1 介导的GH 促生长作用,进而导致儿童生长矮小。 由此可见,骨代谢过程受多种因素的调节,而探索更多的影响因素对预防及治疗铅中毒意义重大。

图1 骨代谢生化指标分类
5 结论
综上所述, 铅可以通过影响骨代谢指标的水平影响骨骼的生长和发育, 即铅暴露对骨代谢的影响是多因素综合作用的结果, 且这种影响可以通过骨代谢生化指标如PINP、CTX 等检测到。 目前,随着骨代谢生化指标检测技术不断发展,其在临床应用日益广泛,但国内外仍无统一检测标准,因此, 不断探索骨代谢生化指标的具体作用以及统一检测标准,或将对预防铅中毒有重大意义。
