猪传染性胃肠炎病毒疫苗株S 基因的克隆及其与流行株的比对分析
2021-11-29侯宏艳潘孝成张丹俊赵瑞宏胡晓苗周学利
侯宏艳,潘孝成,尹 磊,张丹俊,赵瑞宏,胡晓苗,周学利
(安徽省农业科学院畜牧兽医研究所 安徽省畜禽疫病研究中心 畜禽产品安全工程安徽省重点实验室, 安徽 合肥230031)
猪传染性胃肠炎病毒(transmissible gastroenteritis virus,TGEV) 可引起各种年龄猪病毒性肠炎,感染后引起猪呕吐、严重腹泻和脱水,仔猪1~28 d 是该病最易感日龄,每年的1—2 月是该病高发期[1-4]。 TGEV 除了与引起猪腹泻的猪轮状病毒(porcine rotavirus,PoRV)、 猪 流 行 性 腹 泻 病 毒(porcine epidemic diarrhea virus,PEDV) 等混合感染,还能与猪繁殖与呼吸障碍综合征病毒(porcine reproductive and respiratory syndrome, PRRSV)、猪圆环病毒 (porcine circovirus,PCV)、 猪细小病毒(porcine parvovirus,PPV)等混合感染[5-8],给养猪业造成巨大危害。
近年来, 我国多个地区对TGEV 进行了流行病学调查,报道的TGEV 检测率存在差异。孙秋艳等[6]对2014—2016 年山东省部分地区TGE 流行病学调查发现,TGEV 检测率为9.3%;徐丽华等[7]对2011—2017 年浙江省猪病毒性腹泻的流行病学调查发现,TGEV 的阳性率为3.05%; 杜雅楠等[8]对内蒙古地区采集的病料进行了TGEV 检测,显示阳性率为11.76%,赤峰市TGEV 阳性率为20.83%;祖立闯等[9]在2007—2016 年的39 篇流行病学监测文献中发现TGEV 整体阳性感染率在0~31.86%, 还发现外观健康猪群仍可检测出TGEV 病原或抗体,健康猪群中普遍存在TGEV 隐性感染。 因此,对猪场进行TGEV 检测很有必要。
TGEV 为RNA 病毒, 存在遗传变异的可能。在TGEV 基因组中,S 基因编码的氨基酸是中和抗体的主要靶点[4-5,10]。因此,该研究选择了国内常用的3 个厂家的猪传染性胃肠炎病毒疫苗进行TGEV RNA 提取和S 基因序列的扩增, 并与已公布流行毒株基因序列进行比对, 建立检测猪传染性胃肠炎病毒的RT-PCR 诊断方法, 初步判断猪传染性胃肠炎病毒疫苗与流行菌株S 基因的遗传性,为临床疫苗的应用提供参考。
1 材料和方法
1.1 疫苗
购买国内目前广泛使用的猪传染性胃肠炎的3 个厂家的冻干疫苗,分别记作疫苗A、疫苗B 和疫苗C。
1.2 主要试剂
病毒检测用RNA 提取试剂盒(离心柱型)和Fastking cDNA 第一链合成试剂盒购自TaKaRa 公司;2×Taq mix、DNA 凝胶回收试剂盒和DL 2 500 Marker 等均购自天根生化科技(北京)有限公司;琼脂糖购自美国Sigma 公司。
1.3 RNA 提取
将疫苗A、疫苗B、疫苗C 按1 头份加入1 mL DEPC 水进行溶解,-80 ℃反复冻融3 次后,取200 μL 按病毒检测用RNA 提取试剂盒说明书提供的方法提取疫苗中的TGEV RNA,-80 ℃保存。
1.4 cDNA 链合成
将“1.3”项下保存的疫苗A、疫苗B、疫苗C 的RNA 取出溶解, 按FastKing cDNA 第一链合成试剂盒说明书的方法进行反转录,获得cDNA。
1.5 RT-PCR 检测
引物参照樊雅婷等[11]报道的,参照GenBank上TGEV 毒株的S 基因cDNA 序列设计1 对引物, 上游引物序列为5′-CCACTTCGTTAACACACC-3′;下游引物序列为5′-GATAGCCCCAACTATGGTA-3′。 该引物预期扩增片段大小为2 279 bp,为上海生工生物工程技术服务有限公司合成。对“1.4”项下提取的cDNA 进行PCR 扩增,反应体系为:上、下游引物各1 μL(20 μmol/L)、cDNA 模板2 μL、2×Taq mix 12.5 μL、ddH2O 8.5 μL, 总体系25 μL。 反应条件为:95 ℃预变性4 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸2 min,35 个循环;72 ℃终延伸10 min,4 ℃结束反应。 得到的RTPCR 产物进行1%琼脂糖凝胶电泳。
1.6 目的基因克隆与测序
参照DNA 凝胶回收试剂盒说明书进行目的基因凝胶回收与纯化, 纯化的目的基因片段送至通用生物(安徽)有限公司测序。
1.7 序列分析
将疫苗A、 疫苗B、 疫苗C 的S 基因序列在NCBI 网站的Blast 上与近年公开发表的来自不同地区的基因序列进行遗传分析, 得到与已知序列的同源性。 再选取登录号为AF104420.1-Britain、AY587882.1 -Nanjing、DQ811786.2 -America、EU074218.2 -Harbin、FJ755618.2 -Harbin、JQ700304 -fuzhou、KC609371.1 -Shanghai、KX900411.1 -United States、M94099.1 -Spain 和MK272773.1-Fushun 的S 基因序列,与疫苗A、疫苗B、疫苗C 的S 基因序列一起,用MegAlign 软件进行比对分析。
2 结果与分析
2.1 目的基因RT-PCR 检测结果
对疫苗A、疫苗B、疫苗C 的S 基因片段进行RT-PCR 扩增, 均得到预期大小约为2 279 bp 的DNA 片段(见图1),并将纯化后的产物送至通用生物(安徽)有限公司测序。

图1 TGEV 疫苗A、疫苗B、疫苗C的S 基因RT-PCR 扩增结果
2.2 序列分析
将疫苗A、 疫苗B、 疫苗C 的S 基因序列在NCBI 网站的Blast 上进行序列比对, 利用MegAlign 软件进行核苷酸同源性比对分析(见图2),并绘制S 基因克隆序列的系统发生树 (见图3)。结果表明,疫苗A、疫苗B、疫苗C 的S 基因序列两两间的同源性在96.7%以上;疫苗A 与NCBI 已知序列的同源性在94.43%~99.82%, 疫苗B 与NCBI 已知序列的同源性在95.30%~99.64%,疫苗C 与NCBI 已知序列的同源性在93.48%~98.38%。

图2 TGEV 疫苗A、疫苗B、疫苗C 的S 基因核苷酸同源性比对分析结果
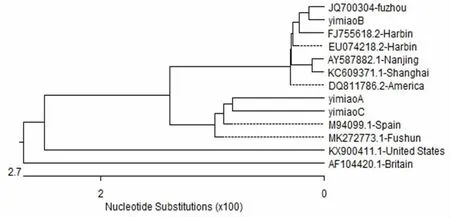
图3 TGEV 疫苗A、疫苗B、疫苗C 的S 基因克隆序列的系统发生树
选取10 个来自国内外的S 基因序列,与疫苗A、疫苗B、疫苗C 的S 基因序列一起,用MegAlign软件进行比对分析。从系统发生树可以看出,疫苗A 和疫苗C 在一个分支上, 且与国外M94099.1-Spain 株在同一分支上, 而疫苗B 在另一个分支上,与国内JQ700304-fuzhou 株在同一分支上。
3 讨论与结论
猪传染性胃肠炎病毒(TGEV)是一种包膜病毒,属于冠状病毒科(coronaviridae,CoV),该病毒有一个28.5 kbp 的单链阳性RNA 基因组,S 蛋白位于病毒表面, 主要形成病毒纤突。 在功能上,TGEV 的S 糖蛋白是中和抗体的主要靶点,还与宿主细胞的嗜性有关, 能够与宿主细胞受体相互作用, 让病毒侵入细胞;S 蛋白还决定TGEV 的血凝活性。 有学者认为TGEV 的S 基因为易变基因,对TGEV 的S 基因进行克隆和分析值得深入研究[4]。
该研究购买了市场上常用的TGEV 疫苗A、疫苗B 和疫苗C,提取疫苗中TGEV 的RNA,对S基因片段进行RT-PCR 扩增, 均得到了预期大小的基因片段。 将获得的S 基因序列在Blast 上进行比对后发现,疫苗A、疫苗B、疫苗C 的S 基因序列两两间的同源性在96.7%以上,且3 种疫苗的S 基因与NCBI 已知序列的同源性超过96%的占比在80%以上,说明目前TGEV 流行株的S 基因变异较低,市场上所用疫苗能有效防控TGEV,与孙秋艳等[6]对山东省部分地区的TGEV 检测的检出率为9.3%, 检出率相对其他常发病(PEDV、PRRS、PCV等)要低的结论相符,与樊雅婷等[11]研究分离的T04 株S 基因变异较低且相对稳定一致。
在对TGEV 的研究中, 朱蕴暖等[12]建立了TGEV 的间接免疫荧光(IFA)检测方法,王赛[13]用抗TGEV 重组N 蛋白的单克隆抗体和多克隆抗体建立了一种双抗体夹心ELISA 检测方法。 在开发有效的抗TGEV 疗法中,单玲玲等[14]认为IFN-y可作为一种有效的治疗制剂。 但在实际生产中,TGEV 仍然以疫苗预防为主, 病原检测多采用RT-PCR 方法,如李嘉琛等[15]对内蒙古某猪场的粪便样品进行RT-PCR 鉴定,郭容利等[16]设计32对PCR 引物分片段扩增TGEV 江苏分离株JS2012 全基因组并进行分析。 在该研究中建立的TGEV 的S 基因RT-PCR 方法,成功获得了TGEV疫苗中的S 基因, 所以该方法可以用来检测腹泻病猪是否感染了TGEV,对监测TGEV 的S 基因变异情况和对TGEV 的防控都有生产意义。
