TCDCA 对IL-1β 刺激下AA 大鼠成纤维样滑膜细胞中PGE2 分泌的影响
2021-11-29姜雪莹钱英红赵俊利李培锋何秀玲曹金山郭文瑞
姜雪莹,钱英红,赵俊利,张 凯,段 艳,李培锋,何秀玲,毛 伟,曹金山,郭文瑞
(1. 内蒙古农业大学, 内蒙古 呼和浩特 010018;2. 农业农村部动物疾病诊疗技术重点实验室, 内蒙古 呼和浩特010018;3.内蒙古自治区农牧业科学院,内蒙古 呼和浩特 010031 )
动物胆汁在临床疾病治疗中被广泛应用,最重要的活性成分之一是胆汁酸类化合物, 胆汁中胆汁酸类成分在动物体内发挥护眼、护肝、调节肠胃功能、抗癌、抗炎、止咳、平喘、平衡血糖以及保护神经等药理作用[1]。 牛磺鹅去氧胆 酸(taurochenodeoxycholic acid,TCDCA)是动物胆汁中主要有效成分之一,化学名称为3α,7α-二羟基-5β-24-胆烷酰-N-牛磺酸,由鹅去氧胆酸(3α,7α-二羟基-5β-胆烷酸,CDCA)的羟基与牛磺酸(2-氨基乙磺酸,Tau) 的氨基之间缩水而成的结合型胆汁酸[2-3]。 前期研究发现,剂量为0.1 g/(kg·BW)和0.2 g/(kg·BW) 的TCDCA 均能够降低SO2诱发的小鼠咳嗽模型气管和肺组织中前列腺素E2(prostaglandin E2,PGE2)的分泌[3]。 同时,研究还发现TCDCA 能够通过抑制小鼠血清和气管组织中NO 含量,促进气管组织中cAMP 的产生,降低SO2诱发的呼吸道炎症部位中PGE2的分泌,进而发挥镇咳、平喘等作用[4]。 Arndt 等[5]研究发现,TCDCA能够对小肠炎症产生缓解作用, 在吲哚美辛诱导发生的急、慢性小肠炎症反应中TCDCA 还能够显著抑制白细胞在炎症反应发生部位的聚集和游走。 TCDCA 剂量为[0.1、0.2 g/(kg·BW)]时对由甲醛(5%)、角叉菜胶(1%)引发的大鼠炎性反应中局部组织的PGE2含量均有显著抑制作用。国外学者Nguyen 等[6]的研究发现,在大鼠肝脏窦状隙上皮细胞cAMP 生成的过程中,TCDCA 具有显著的促进作用。 由此可知,TCDCA 对机体炎症反应发生具有重要的调节作用。
成纤维样滑膜细胞 (fibroblast-like synoviocytes,FLS)是类风湿性关节炎(rheumatoid arthritis,RA)关节组织中具有重要作用的细胞。 FLS 的大量增生以及在关节滑膜部位的重新分布是发生RA 特征性病变的主要表现之一。国内外大量研究发现, 在RA 发病过程中成纤维细胞的增殖优势是与非疾病相关组织的成纤维细胞的重要不同点。 通过体外分离培养FLS 的研究发现,RA 患者的FLS 主要发生细胞增殖速度和迁移能力明显增强,同时细胞形态具有多样性等生物学特性变化。当分离培养的FLS 在多种因素的刺激下, 细胞因子(如IL-1β 等)和金属基质蛋白酶的分泌、表达和活性均有所提高, 促使炎症和自身免疫反应发生[7-9]。 Liu 等[10]研究发现,在完全弗氏佐剂(complete freund′s adjuvant,CFA)诱导的大鼠佐剂性关节炎(adjuvant arthritis,AA)模型中,引发的大鼠足跖肿胀(包括原发性和继发性)均能够由TCDCA产生不同程度的抑制效应。由以上研究结果可知,TCDCA 均能在由物理性、化学性和细菌性因素引起的急、 慢性炎症发生过程中发挥明显的抑制作用。 为了进一步探究在AA 模型大鼠急、慢性炎症反应过程中TCDCA 的作用机制,该研究以AA 模型大鼠FLS 为研究对象,采用ELISA 方法检测了TCDCA 和IL-1β 作用下AA 大鼠FLS 上清液中PGE2的含量,分析了TCDCA 对IL-1β 刺激下AA模型大鼠FLS 中PGE2分泌情况的影响,进一步揭示动物机体内源性物质TCDCA 的抗炎免疫调节作用。
1 材料与方法
1.1 试剂与仪器
1.1.1 实验动物该试验选用的Wistar 大鼠均购于军事医学科学院实验动物研究中心, 动物合格证号为SCXK-(军)2007-004, 选取大鼠体重为(160±20)g。
1.1.2 试剂TCDCA 由内蒙古农业大学兽医学院兽医药理学课题组从鸡胆汁中提取和纯化,纯度为98.6%;医用卡介苗(BCG)购自宝生物工程(大连)有限公司;PGE2ELISA 检测试剂盒购自美国Cayman 公司;IL-1β (批号:I2393)、 地塞米松(批号:50-02-2)均购自美国Sigma 公司;其他试剂均为国产或进口分析纯。
1.1.3 主要仪器设备低温高速离心机 (Sigma-3-30K);多功能酶标仪(Synergy 4,美国Bio-Tek);超净工作台(AIRTECH);37 ℃摇床;CO2细胞培养箱(Thermo Fisher)。
1.2 佐剂性大鼠关节炎模型的建立
选择Wistar 大鼠12 只饲养1 周,使其熟悉环境,以减少应激的产生。根据该试验需要随机分为正常对照组和AA 模型组,每组6 只大鼠。 根据参考文献[11]中的方法制备完全弗氏佐剂(CFA),正常对照组不予处理,AA 模型组则需左后足趾皮内注射0.1 mL 制备好的CFA 以复制AA 大鼠模型。
1.3 模型的评价
AA 大鼠模型复制后18~21 d, 观察各组大鼠的双侧足关节、足爪以及尾部的主要病变。
1.4 AA 大鼠成纤维样滑膜细胞的体外培养及生物学特征的鉴定
1.4.1 滑膜组织的采集急性处死大鼠后, 将大鼠放于75%酒精中浸泡2~3 min,根据文献[11-12]中的方法采集滑膜组织,用于后期细胞分离培养。每只大鼠应尽可能多收集双侧滑膜组织, 收集量为10~20 mg。
1.4.2 成纤维样滑膜细胞的分离与培养采用文献[12-13]中的方法,提取建立成功的AA 模型大鼠成纤维样滑膜细胞进行分离、培养和传代,用于后续试验。
1.5 分组与给药
根据试验设计要求,将该试验分为4 组,即空白对照组(AA 大鼠成纤维样滑膜细胞,简称FLS,下同);IL-1β 刺激组:FLS+ IL-1β (10 ng/μL);TCDCA 作用组:FLS+IL-1β (10 ng/μL)+TCDCA(10-4mol/L);地塞米松组:FLS+IL-1β(10 ng/μL)+地塞米松(500 nmol/L)。
1.6 细胞悬液的制备
将经组织块贴壁法分离得到的单个滑膜细胞用含有10 ng/μL IL-1β 的DMEM 培养液配制成浓度为5×108cells/L 滑膜细胞悬液, 加入24 孔培养板, 每孔1 mL, 于37 ℃、5%CO2中作用48 h后,取细胞培养孔内的上清液,按照分组用无菌离心管离心,4 ℃、2 000 r/min 离心10 min 去除细胞碎片,轻轻吸取上清液,放入1.5 mL 新的无菌Eppendorf 管,封盖、编号后保存在-70 ℃冰箱中待测。
1.7 TCDCA 对IL-1β 刺激下AA 大鼠成纤维样滑膜细胞中PGE2 分泌的影响
采用ELISA 方法,按照Cayman 公司PGE2检测试剂盒说明书进行PGE2含量的检测。
2 结果与分析
2.1 AA 大鼠的鉴定
由图1 可知,在AA 模型组大鼠造模后18~21 d,与空白对照组(见图1a)比较,AA 模型组大鼠在腕部及掌部出现红肿, 并且肿胀明显 (见图1b),证明AA 大鼠模型制备完成。
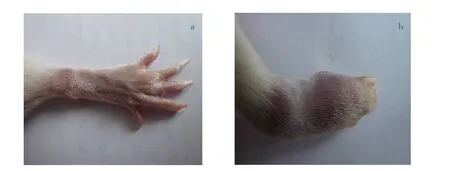
图1 空白对照组与AA 模型组大鼠腕部及掌部对比
2.2 成纤维样滑膜细胞的光镜观察
由图2a 可知,在组织周边有细胞长出,分离及培养的细胞形态较为均一、 呈长梭状并伸出突起,局部仍分布少量圆形细胞。传代后第5 天即在瓶底稠密分布,较前期生长更快,形态更均一,第7 天可予以再次传代。 传代细胞形态见图2b。

图2 成纤维样滑膜细胞光镜观察(100×)
2.3 PGE2 含量的检测
采用ELISA 方法检测AA 大鼠FLS 上清液中PGE2含量,PGE2的标准曲线 见图3。 由图3 和OriginLab Origin V8.0 软件处理数据结果可知,相关系数R2=0.997。

图3 PGE2 标准曲线
由图4 可知,与空白对照组相比,IL-1β 刺激组、TCDCA 作用组、 地塞米松组AA 大鼠FLS 中PGE2的分泌量均显著(P<0.05)升高;与IL-1β 组相比,TCDCA 作用组和地塞米松组均能够显著(P<0.05) 抑 制AA 大 鼠FLS 中PGE2的 分 泌。TCDCA 对AA 大鼠FLS PGE2的分泌呈现抑制作用。 TCDCA 在10-4mol/L 浓度时, 能够显著抑制IL-1β 刺激AA 大鼠FLS PGE2的分泌。
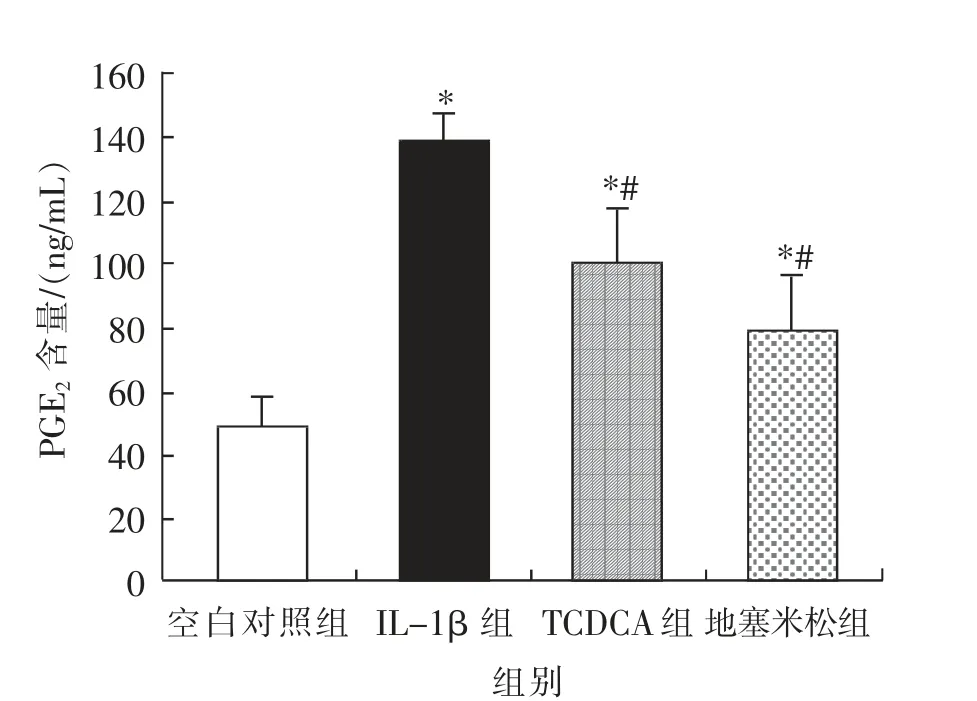
图4 TCDCA 对IL-1β 刺激下AA大鼠FLS PGE2 分泌量的影响
3 讨论
前列腺素(prostaglandins,PGs)是类花生酸家族的成员,可以由体内几乎所有的细胞产生。PGE2是一种具有广泛生物学效应的脂质, 作为前列腺素类化合物中的成员, 是二十碳饱和脂肪酸形成的花生四烯酸通过一系列酶催化反应形成的产物,对免疫细胞具有明显抑制作用。 PGE2是一种重要的脂质介质, 可在机体的所有类型细胞中表达,在机体炎症和发热的病理生理过程中,引发炎性细胞趋化运动,聚集在炎性反应部位,扩张毛细血管使其通透性增加,促进炎性细胞渗出,继而引起发热及炎症介质IL-1β 的含量增加, 催化爆发式炎症级联反应,进而放大炎症反应,导致发生炎症和发热的部位和组织PGE2的含量增加,在炎症反应中发挥着重要的作用[14-16],研究发现,在炎症和免疫反应发生的过程中,TCDCA 可通过对糖皮质激素受体(glucocorticoid receptor,GR)介导的信号通路在基因组学水平上引发激活效应, 进而发挥重要的调节作用。 同时研究结果还表明,GR 受体能够被TCDCA 激活,启动了基因组学和非基因组学的调控作用, 从而促进了抗炎相关因子脂皮素-1(lipocortin-1,LC-1)的表达。目前,LC-1 已被公认为糖皮质激素(glucocorticoids,GCs)参与抗炎反应的重要调控因子[16]。 磷脂酶A2(phospholipase A2,PLA2) 重要的内源性抑制剂为LC-1,是介导GCs 发挥抗炎作用的重要因子。 在炎性介质合成释放过程中,PLA2 为关键的影响因素, 同时也是炎性反应调节的中心。 花生四烯酸的产生过程中,PLA2 激活后作用在膜磷脂上起促进作用,花生四烯酸在一系列合成酶的作用下生成炎性介质PGE2。 另一项研究还发现, 白介素-1β (interleukin 1 beta,IL-1β) 能够刺激FLS 进而产生活化效应[17]。 在IL-1β 刺激FLS 过程中,环加氧酶-2(cyclooxygenase-2,COX-2)的表达量升高,提高了PGE2的合成分泌水平。 TCDCA 能够促进FLS 细胞中GR 受体的激活, 降低血管细胞黏附分子-1(vascular cell adhesion molecule 1,VCAM-1) 的表达量,这一抑制效应可能与TCDCA 增强LC-1 的表达,降低COX-2 产生,以及抑制cPLA2 的表达量有关[18-19]。 COX-2 是COX 两种同工酶中的一种, 作为COX-2 下游重要的影响合成因子mPGES-1。在PGE2合成过程中,mPGES-1 为这一合成反应中的最后一个催化酶, 在高表达炎症因子IL-1β、TNF-α 等的条件下其催化作用能够被提高,从而促进PGE2的合成,分泌量提高[20-21]。
研究结果显示,TCDCA 能够显著抑制IL-1β刺激下AA 大鼠成纤维样滑膜细胞中PGE2的分泌。综上所述,TCDCA 能够增强GR 介导的基因组学转录激活效应,抑制AA 大鼠炎症介质PGE2的产生,发挥抗炎作用。 这一结果与TCDCA 能在动物机体炎性组织中减少一氧化氮(NO)、PGE2以及白三烯B4(leukotriene B4,LTB4)等的含量,在体内发挥抗炎作用一致[10]。
