金针菇多糖对三文鱼片冻藏期间品质的影响
2021-11-29谢晨熊泽语李慧金素莱曼陈百科包海蓉
谢晨,熊泽语,李慧,金素莱曼,陈百科,包海蓉,2*
1(上海海洋大学 食品学院,上海,201306)2(上海水产品加工及贮藏工程技术研究中心,上海,201306)
三文鱼属于冷水性的高度洄游鱼类,主要分布在挪威、加拿大、美国等地区。三文鱼肉呈橙红色,肉质细腻,口感鲜美,且富含二十碳五烯酸和二十二碳六烯酸等多种不饱和脂肪酸,深受中国消费者青睐。中国市场上的三文鱼以进口三文鱼为主,2012—2019年中国三文鱼市场平均增速在19%左右,2019年的进口量达9万t。然而,由于三文鱼具有较高的水分活性和丰富的营养物质,在宰杀后鱼体极易发生腐败。为了延长三文鱼保质期,常常将屠宰后的三文鱼进行冷冻保藏。常用的冻藏温度有-18 ℃和超低温(-40 ℃及以下)。与-18 ℃冻藏相比,超低温冻藏虽能更好地保持三文鱼的品质,但其对仪器设备的要求更高,投资成本更大,而且无法精确地控制冻藏温度[1]。三文鱼在-18 ℃时,冻结率已达到90%,经过长时间的冻藏,三文鱼蛋白发生冷冻变性,脂肪逐步氧化,这些因素均会导致三文鱼品质劣变。目前添加抗冻剂是防止蛋白变性的主要方法,工业上常用的商业抗冻剂为4%蔗糖和4%山梨醇(质量分数)混合液。但由于传统商业抗冻剂高甜高热量的特点与如今消费者追求健康低热量的消费趋势不符,因此寻找天然、健康、高效的新型抗冻剂成了目前科研人员研究的热点。
金针菇多糖(polysaccharide fromFlammulinavelutipes,FVP)是从金针菇中提取出的水溶性多糖,是金针菇的主要活性成分,早在1968年日本就有关于FVP的研究报导[2]。到如今,FVP虽然已经引起了部分学者的关注,但目前关于FVP的国内外研究均集中于抗氧化[3],促进肠道健康[4],免疫调节[5]等方面,对于将多糖应用于水产品抗冻剂的研究鲜有报导。
本文通过研究不同浓度FVP浸渍处理的三文鱼片在-18 ℃冻藏4个月后的Ca2+-ATPase活性,巯基,硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARS),蛋白二级结构以及冰晶大小变化,并与蒸馏水处理以及商业抗冻剂处理进行对比,探讨将FVP作为水产品抗冻剂使用的可行性。
1 材料与方法
1.1 材料与仪器
冰鲜三文鱼,购于上海东方国际水产中心,在产地屠宰、去除内脏后,冰藏,约2 d运至上海。由商店专业人员进行剔骨、去皮,只取中段背部肌肉,装入保鲜袋,冰藏,2 h内至实验室。
蔗糖、硫代巴比妥酸、山梨醇、氯化钾、浓硫酸、二甲苯、5,5′-二硫代双、三氯乙酸、苏木精、伊红、曲拉通(Tritonx-100)、钼酸铵、硫酸亚铁、无水乙醇、浓盐酸、无水硫酸铜等,均为分析纯,国药集团化学试剂有限公司。
FA2004 型电子天平,南京东迈科技仪器有限公司;ECLIPES 80i高级研究级显微镜,日本尼康株式会社;SG2 pH计,梅特勒-托利多仪器(上海)有限公司;D-130电动匀浆机,维根技术(北京)有限公司;LRH-100CL 低温培养箱,上海一恒科学仪器有限公司;GL-20B 高速冷冻离心机,上海安亭科学仪器厂。
1.2 实验方法
1.2.1 原料处理
金针菇洗净、冻干、碾成粉末,用2%(质量分数)KOH溶液于100 ℃处理2.5 h,10 000 r/min离心15 min, 重复3次后蒸发浓缩上清液,在浓缩液中加乙酸中后加过量乙醇,使浓缩液产生沉淀,将沉淀清洗、透析、过柱纯化,得到FVP,分子质量为106 kDa。
三文鱼段运回实验室后,立即将其切成10 cm×5 cm×2 cm的鱼片,然后将鱼片随机分成5组,分别在蒸馏水,0.09、0.12、0.15 mg/mL FVP以及4%蔗糖和4%山梨醇(质量分数,下同)混合液中浸渍10 min, 捞出后沥干表面水分,装入自封袋中。所有样品先放到-60 ℃冰箱中快速降至中心温度-18 ℃,然后再置于-18 ℃冰箱贮存,每隔15 d随机取样测定指标,每组指标做3个平行组。
1.2.2 肌原纤维蛋白提取
参照KATOH等[6]的方法进行肌原纤维蛋白的提取,每个样品取5 g剁碎的三文鱼肉依次加入40 mL 不同蛋白提取液10 000 r/min均质2 min,在4 ℃、 5 000 r/min离心15 min,除去离心上清液,取沉淀进行下一步实验,蛋白提取液依次为:40 mmol/L Tris-Maleat,0.16 mol/L KCl,1% Triton,pH 7.5; 40 mmol/L Tris-Maleat,0.16 mol/L KCl,pH 7.5,提取过程全程冰浴,提取完后用双缩脲法测定蛋白浓度,配制成2 mg/mL 进行后续指标测定,置于4 ℃冰箱保存。
1.2.3 TBARS值
参考SALIH等[7]的方法测定TBARS值,略有改动。取将三文鱼肉剁碎,称取5.00 g加入25 mL 20%(质量分数)三氯乙酸,均质成匀浆,静置2 h后10 000 r/min 离心15 min,然后将上清液用蒸馏水定容至50 mL,取5 mL混合液加入5 mL 0.02 mol/L 的硫代巴比妥酸溶液,沸水浴20 min。水浴后流水冷却至澄清,在532 nm出测定吸光度。
1.2.4 总巯基含量
依据 SIMPLICIO等[8]的方法测定总巯基含量,在波长412 nm处测定吸光度。每毫升2 mg/mL的肌原纤维蛋白加入9 mL Tris-HCl缓冲液(8 mol/L尿素、10 mmol/L 二乙烯三胺、2%十二烷基硫酸钠,pH 6.8),然后根据5,5′-二硫代双显色结果计算巯基含量。
1.2.5 Ca2+-ATPase 活性
根据 BENJAKUL等[9]的方法进行测定三文鱼Ca2+-ATPase 活性,结果以1 mg蛋白每分钟生成无机磷量(μmol)来表示。
1.2.6 显微镜观察
组织切片参考KAALE等[10]的方法,略作修改。将三文鱼片切成4 cm×4 cm×3 mm小块置于Carnoy试剂(乙醇与冰醋酸体积比3∶1),-18 ℃固定24 h。依次使用70%、80%、90%、95%、100%(体积分数)乙醇脱水1 h,然后使用二甲苯透明45 min,65 ℃浸蜡2 h,用石蜡包埋后切成8 μm薄片,37 ℃烘片4 h,然后进行脱蜡,用伊红和苏木精染色,使用光学显微镜尼康ECLIPES 80i观察。
1.2.7 二级结构
参考刘芳芳等[11]的方法,将蛋白样品冻干,将干粉与溴化钾以质量比1∶100的比例研磨压片,用傅里叶红外光谱在400~4 000 cm-1范围内扫描测定吸光度。
1.3 数据处理
采用 Origin Pro 9.1进行图像绘制,SPSS 23软件进行数据分析,具体使用单因素ANOVA中的Duncan模型,P<0.05表示数据间有显著性差异。
2 结果与分析
2.1 TBARS值
脂肪氧化会产生过氧化物,这些过氧化物随后会降解成醛、酮等次级产物,这些化合物会加剧油脂的酸败,并产生刺鼻的气味[12]。硫代巴比妥酸法就是利用氧化终产物会与硫代巴比妥酸在高温下生成红色产物的原理测定脂肪氧化情况。鱼类冻藏过程中同样会发生脂肪氧化,冻藏中生成的冰晶会破坏细胞,使之释放出促进氧化的物质[13]。对于多脂鱼来说,脂肪氧化造成的品质劣变比微生物的影响更大[14]。当TBARS值>0.5 mg MDA/kg时,脂肪氧化产生的异味可被闻到[15]。如图1所示,新鲜三文鱼的TBARS值为(0.08±0.02) mg MDA/kg,冻藏过程中TBARS值不断上升。其中,蒸馏水组TBARS值增加最快,在120 d达到0.585 mg MDA/kg,FVP组和商业抗冻剂均能有效抑制TBARS值的增长(P<0.05),0.15 mg/mL FVP抑制效果最好。FVP具有清除自由基的能力,即使多糖的添加量很少,也能达到抗氧化效果。冻藏过程中TBARS值的主要影响因素为氧气,除了添加抗氧化剂外还可以选用氧气阻隔性更好的包装材料来抑制脂肪氧化。还有研究发现,反复冻融使细胞中的水分发生重结晶,产生大冰晶破坏细胞膜,从而加速肉类脂肪氧化[16]。因此,在冻藏过程中控制冻藏温度稳定也是保持肉类品质的方法。
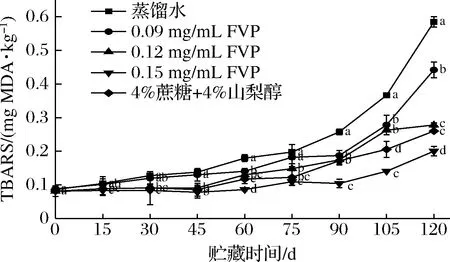
图1 FVP对冻藏三文鱼片TBARS值的影响
2.2 总巯基含量
总巯基包括活性巯基和隐藏巯基,是稳定蛋白空间结构,反映蛋白氧化程度的重要指标。其中,活性巯基又可分为在肌球蛋白头部的SH1、SH2和位于轻链酶解肌球蛋白中的SHa[17]。蛋白冷冻变性会造成蛋白空间结构发生变化,隐藏巯基暴露,蛋白发生交联产生二硫键[18],从而使巯基含量进一步下降,其中,活性巯基更容易被氧化成二硫键。此外,高温贮藏也会使巯基含量下降[19]。各组三文鱼总巯基含量的变化如图2所示。在前30 d,巯基含量下降幅度较大,而后下降趋势变缓,到贮存末期,蒸馏水、0.09、0.12、 0.15 mg/mL FVP,4%蔗糖+4%山梨醇处理组的总巯基含量分别为初始值的21.3%、27.4%、29.8%、34.7%、31.4%。三文鱼蛋白在贮藏前期巯基下降最快可能是因为在前期即使蛋白冷冻变性程度较小,但暴露在蛋白分子外部的巯基已被氧化[20]。到贮藏后期,蛋白变性和脂肪氧化产生的自由基可能是巯基含量进一步下降的主要原因。FVP和商业抗冻剂处理组的巯基含量始终高于蒸馏水组可能是因为FVP虽然浓度较低,但是其抗氧化作用抑制了巯基的氧化,而商业抗冻剂中较高浓度的蔗糖和山梨醇在三文鱼片表面形成了一层糖膜,有一定阻隔氧气的作用。

图2 FVP对冻藏三文鱼片总巯基含量变化影响
2.3 Ca2+-ATPase 活性
Ca2+-ATPase 活性常用单位时间内肌球蛋白中的ATP酶被Ca2+赋活后催化ATP水解产生的无机磷含量来判断[μmol/(mg·min)]。Ca2+-ATPase活性来源于肌球蛋白头部。因此,可根据Ca2+-ATPase活性的下降程度来大致判断肌原纤维蛋白变性情况。关于冻藏过程中Ca2+-ATPase活性下降的原因可能是肌球蛋白中的活性巯基氧化成二硫键,使得蛋白分子发生交联,肌球蛋白头部与ATP的接触减少[21]。此外,Ca2+-ATPase 活性还与蛋白分子中的氢键、二硫键以及疏水相互作用相关[22]。由图3可知,前15 d,冻藏三文鱼Ca2+-ATPase活性下降最明显,降幅依次为34.1%、31.1%、24.5%、23.9%、26.9%,后期下降速度放缓。总体而言,FVP和商业抗冻剂都达到了抑制Ca2+-ATPase活性下降的作用(P<0.05),贮藏末期各组Ca2+-ATPase活性依次为0.091、0.118、0.135、 0.182、0.166 μmol/(mg·min)。Ca2+-ATPase活性的变化过程与总巯基的变化相似,此结果与曹淑敏等[23]的研究结果一致。巯基中的SH1和SH2和Ca2+-ATPase都位于肌球蛋白头部,蛋白变性过程中,肌球蛋白头部更容易受到影响[23]。关于FVP抑制Ca2+-ATPase活性下降的原因可能是多糖含有大量羟基,这些羟基可以和蛋白中的水分子以氢键的形式结合,抑制了冻藏过程中结合水向自由水转化,减少蛋白因结合水流失而脱水聚集变性。
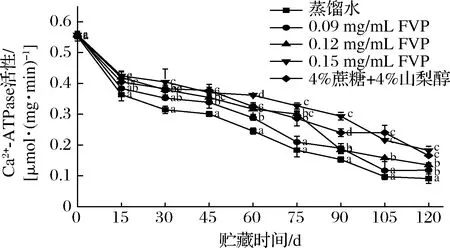
图3 FVP对冻藏三文鱼片Ca2+-ATPase 活性的影响
2.4 冰晶生长情况
冻藏是目前水产品的主要保藏方式,但由于冻藏设备的限制,在长时间的冻藏过程中难免会产生温度波动,促进水产品中的冰发生重结晶而造成冰晶数量减少,体积增大,细胞内溶液因细胞外溶液冷冻浓缩而发生迁移,而使肌纤维发生脱水,冰晶体有更大的成长空间[24]。这不仅会对细胞造成机械损伤,还会在水产品解冻后增大汁液流失率,从而造成水产品营养流失,减少水产品保质期。
由图4可知未经冷冻的新鲜三文鱼组织呈致密的网状结构,排列紧密,组织结构清晰。冻藏120 d后,组织形状发生了变化,肌纤维均有不同程度的破裂。三文鱼组织使用固定剂固定后,被苏木精和伊红试剂染色,未被染上颜色的部分为冻藏时在组织中的冰晶。图4中可以看到蒸馏水组的组织冻藏120 d后生成的冰晶较大,冰晶形状不规整,组织被分成较小的块状。其余冻藏120 d的实验组生成的冰晶较小,并且可明显在图中看到冰晶的形状较规则、圆润,对组织的破坏也较小。其中0.15 mg/mL 的FVP处理组生成的冰晶最为细小、致密,抑制重结晶效果最好。糖类含有大量羟基,可将水分子束缚在蛋白表面,抑制冰晶生长[25]。羟基数目越多,糖的抗冻效果越好。FVP作为大分子多糖还可能形成玻璃态体系,在玻璃态体系下,组织中的水达到最大冻结浓缩状态,此时水分子的迁移速度大大降低,可以有效避免蛋白之间聚集变性[26]以及冰的重结晶。

图4 FVP对冻藏三文鱼片冰晶大小的影响
2.5 红外光谱分析
红外光谱图中波数为1 600~1 700 cm-1(酰胺Ⅰ带)的区间常用来分析蛋白的二级结构变化[27],确定蛋白各种二级结构的相对含量。一般来说,β-折叠在1 600~1 640 cm-1附近有较强的吸收峰,无规卷曲的吸收峰出现在1 640~1 650 cm-1附近,α-螺旋在1 650~1 660 cm-1附近有弱吸收峰,β-转角在1 660~1 700 cm-1附近。α-螺旋和β-折叠是二级结构主要组成部分,两者分别依赖分子内氢键和分子间氢键形成[28]。本实验中,蛋白二级结构以光谱图二次求导后的吸收峰面积变化来表示蛋白二级结构变化规律,占比为峰面积比。
由图5可知,冻藏120 d后,与新鲜三文鱼相比,β-折叠比例下降,其余含量均有所上升。FVP处理的3个组β-折叠含量升高,β-转角含量降低,无规卷曲含量略有降低,α-螺旋含量升高较少。4%蔗糖和4%山梨醇处理组β-折叠含量降低,无规卷曲含量略降,β-转角含量略升,α-螺旋含量增加比例小于蒸馏水组,大于FVP处理组。不同抗冻保护剂对蛋白二级结构的影响各有不同。冻藏过程中,蛋白二级结构含量是波动变化的,低温有利于α-螺旋的含量增加,与大分子糖相比,小分子糖处理会促进α-螺旋的形成[29]。不同抗冻保护剂对蛋白二级结构的影响各有不同。与无规卷曲和β-转角相比,α-螺旋和β-折叠是相对比较稳定、有序的结构,新鲜三文鱼α-螺旋和β-折叠的总占比为70%左右,冻藏后蒸馏水组降低到约55%,FVP处理的鱼片α-螺旋和β-折叠总和均保持在77%以上,因此FVP可能会使蛋白的二级结构逐渐由无序向有序转变。
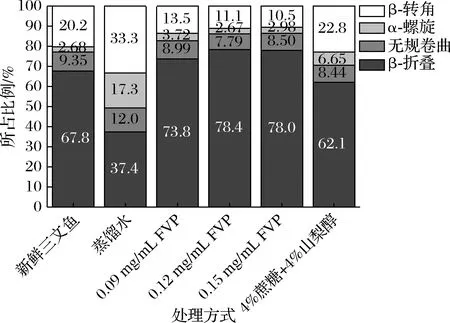
图5 FVP对冻藏三文鱼片蛋白二级结构分布的影响
3 结论与讨论
鱼肉的含水量高达70%~80%。鱼体水分含量高,水分活性强,这是鱼肉在常温贮藏下比禽畜肉更容易受到微生物污染而腐败变质的重要原因。而在冻藏中,这2个因素也会造成鱼体内产生大量冰晶,造成组织机械损伤。评价冻藏鱼品质的指标,如巯基、TBARS值、Ca2+ATPase活性、持水性、冰晶等,往往是相互联系的,即一个指标的变化可能会造成其他指标变化。冰晶的重结晶是指小冰晶升华形成的蒸气聚集到大冰晶周围,凝聚成更大的冰晶,以及组织内未冻结部分的水迁移到大冰晶周围促进其生长。FVP可以清除自由基,抑制TBARS值的上升和巯基被氧化,阻断脂肪氧化产生的次级代谢产物对蛋白的破坏。同时,FVP通过羟基结构和形成玻璃态固定水分子抑制水分子迁移,减少蛋白质脱水聚集变性。同时,水分子迁移被抑制还可以减缓冰重结晶,生成小冰晶可以减少细胞完整性被破坏,减少鱼肉营养成分流失。在本研究中,0.09、0.12、0.15 mg/mL 的FVP均对抑制蛋白冷冻变性和脂肪氧化等起到了较好的效果,在此浓度范围内,0.15 mg/mL的FVP效果最佳。