葡萄糖及谷氨酰胺代谢调控干细胞命运
2021-11-27高诗祺陈小倩郑黎薇周雅川
高诗祺 陈小倩 汪 宇 郑黎薇 周雅川
1.四川大学华西口腔医院儿童口腔科,四川成都 610041;2.口腔疾病研究国家重点实验室,四川成都 610041;3.国家口腔疾病临床医学研究中心,四川成都 610041 4.四川大学华西口腔医院牙体牙髓科,四川成都 610041
干细胞向成熟体细胞分化过程中经历了代谢谱转变。多能干细胞主要依赖于糖酵解氧化形成乳酸供能,分化细胞则主要依赖氧化磷酸化及三羧酸循环(tricarboxylic acid cycle,TCA cycle)供能。细胞内代谢状态可通过表观遗传机制参与细胞命运决定过程,影响细胞分化状态。表观遗传学主要研究范畴包括染色质重塑、DNA/RNA 甲基化、组蛋白修饰、非编码RNA 调控与随机染色体失活等。其中葡萄糖及谷氨酰胺代谢的中间产物参与DNA 甲基化、RNA 甲基化及组蛋白修饰调控。如,α-酮戊二酸(α-ketoglutarate,α-KG)可影响DNA、RNA 及组蛋白甲基化标记状态;乙酰辅酶A 及烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)可影响组蛋白乙酰化标记状态;黄素腺嘌呤二核苷酸(flavin adenine dinucleotide,FAD)可影响组蛋白甲基化标记状态。
1 葡萄糖和谷氨酰胺代谢
葡萄糖和谷氨酰胺都是机体重要的营养物质及能量代谢底物,也是生物体碳、氮元素供应的重要来源。葡萄糖经糖酵解分解为丙酮酸后,在氧气供应不足时转化为乳酸;在氧气供应充足时进入线粒体并反应生成乙酰辅酶A。乙酰辅酶A 进入TCA 循环,而TCA 循环衍生产物则可进入氧化磷酸化途径,为细胞生命活动提供大量能量支持[1](图1)。期间伴随着α-KG、NAD+及FAD 的循环再生。葡萄糖可以糖原形式储存能量,也可参与核苷酸和氨基酸的生物合成,维持氧化还原稳态[1]。
谷氨酰胺可水解生成谷氨酸,再经转氨或脱氨反应,转化为α-KG 进入线粒体TCA 循环并参与三磷酸腺苷的生成[2](图1)。另外,谷氨酰胺的含氮基团也可用来合成其他氨基酸和核苷酸,对机体的氮转运十分重要[1]。
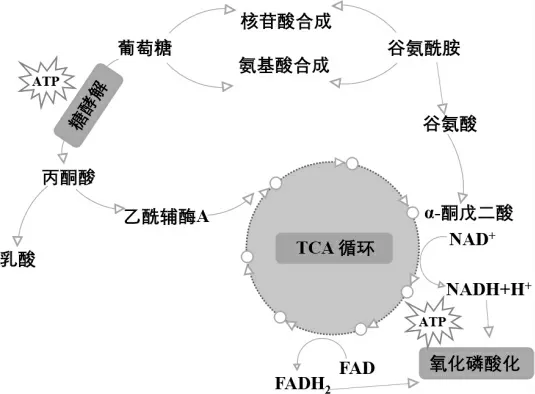
图1 葡萄糖与谷氨酰胺代谢示意图
虽然葡萄糖和谷氨酰胺在细胞代谢中的贡献比例尚不清楚,但在不同发育阶段,两者消耗量是严格平衡协调的。谷氨酰胺代谢与葡萄糖代谢相互促进,又互为补充,是细胞广泛的生理活动所必须的代谢基础。
2 不同阶段干细胞的葡萄糖代谢和谷氨酰胺代谢
当干细胞进入谱系分化程序,其分化潜力逐渐降低,代谢谱也发生变化。在干性状态下,细胞内糖酵解比TCA 循环及氧化磷酸化活跃,氧耗低,糖酵解相关酶的表达水平较高[3]。这种代谢状态与细胞的生理需求相适应。葡萄糖的不完全氧化可满足干细胞的能量需求并为生物合成提供充足底物;细胞内活性氧自由基产生少,可避免DNA 和细胞结构遭破坏。分化细胞需要维持稳态并发挥谱系特异性功能,处于高能量需求状态。在干细胞分化过程中,能量代谢场所逐步向线粒体内转移,TCA 循环和氧化磷酸化被激活,以满足巨大的能量需求[3]。抑制干细胞氧化磷酸化活动使分化延迟,解除抑制则使细胞进入分化阶段[4]。因此,细胞分化过程中,能量代谢逐渐从糖酵解向TCA 循环和氧化磷酸化转移。
在干细胞分化过程中,谷氨酰胺代谢起重要的调节作用。阻断谷氨酰胺代谢可抑制干细胞分化[5]。外源性添加谷氨酰胺时,肠干细胞表现出分化能力增强[6]。谷氨酰胺代谢可决定干细胞谱系分化方向:在骨髓间充质干细胞中,减少谷氨酰胺供应可促进成脂向分化,抑制成骨向分化[7]。
3 葡萄糖和谷氨酰胺代谢通过表观遗传学机制调控细胞命运
表观遗传与葡萄糖及谷氨酰胺代谢在干细胞命运抉择中相互作用。代谢产物(α-KG、Acetyl-CoA、NAD+、FAD 等)搭建起表观遗传与葡萄糖和谷氨酰胺代谢相互作用的桥梁(图2)。
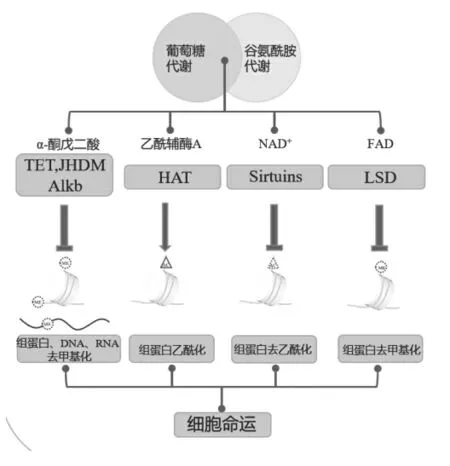
图2 葡萄糖和谷氨酰胺代谢通过表观遗传学机制调控细胞命运
3.1 α-KG
α-KG 是TCA 循环的关键中间产物,可由葡萄糖或谷氨酰胺合成。含Jumonji 结构域的组蛋白去甲基酶(jumonji domain-containing histone demethylases,JHDMs)、10-11 易位(ten-eleven-translocation,TET)酶家族的DNA 去甲基酶和Alkb 家族的RNA 修饰酶都依赖于辅助因子α-KG 发挥作用,称为α-KG 依赖的双加氧酶。因此,α-KG 可通过上述酶参与调控细胞组蛋白、DNA 和RNA 甲基化水平。
α-KG 可促进原始态小鼠胚胎干细胞的干性维持和自我更新,也可加速始发态多能干细胞的早期分化[8],这些结果可能与影响JHDMs 和TETs 介导的组蛋白及DNA 甲基化标记水平改变相关。α-KG 可通过增强TETs 活性及降低DNA 甲基化标记水平以增强干细胞的增殖活性,增加小鼠胚胎内细胞团的体积、新生小鼠的体重[9]。过表达JMJD2C 和TET1 使人胚胎干细胞保持干性并抑制分化进程,而敲除TETs则促进多个谱系早期分化[10]。然而,高浓度α-KG 可抑制间质前体细胞的分化[11]。提示干细胞的类型和状态以及α-KG 的浓度会影响α-KG 的作用。
到目前为止,4 种依赖α-KG 的双加氧酶(ALKBH1/5/8/9)被鉴定为RNA 脱甲基酶,参与RNA 甲基化的动态修饰。ALKBH5 可逆转成骨抑制作用,并可通过激活AKT 信号通路促进黄韧带细胞成骨分化[12]。抑制ALKBH5/9 对胶质母细胞瘤干细胞增殖和致瘤能力有抑制作用[13]。由此可见,α-KG 相关的表观遗传修饰广泛参与了包括肿瘤干细胞在内的干细胞发育过程的调控。
3.2 乙酰辅酶A
乙酰辅酶A 是组蛋白乙酰化唯一的乙酰基供体,可影响组蛋白乙酰化水平,从而调控基因表达影响细胞的命运。
在干细胞的早期分化过程中,细胞内组蛋白乙酰化标记水平降低,这是葡萄糖衍生的乙酰辅酶A 减少导致的,而增加细胞内葡萄糖衍生乙酰辅酶A 水平可以促进增殖且抑制早期分化[14]。然而在某些研究中,乙酰辅酶A 则表现为促进干细胞分化的作用[15]。
谷氨酰胺衍生乙酰辅酶A 在干细胞命运决定中也起着调节作用。谷氨酰胺通过乙酰辅酶A 相关的表观遗传调节基因表达以促进软骨细胞分化和软骨内骨形成[16]。谷氨酰胺衍生的乙酰辅酶A 储存池增大,是肿瘤细胞存活、增殖和自我更新必不可少的,且参与支持肿瘤细胞上皮间充质转化、肿瘤发生和转移[17]。综上,乙酰辅酶A 介导的组蛋白乙酰化水平参与了干细胞命运决策。
3.3 NAD+
NAD+通过糖酵解、TCA 循环和氧化磷酸实现再生循环,且其合成过程需要谷氨酰胺等含氨代谢物作为氨基供体。
NAD+通过调节NAD+依赖的组蛋白去乙酰酶家族(sirtuins)发挥表观遗传作用。Sirtuins 是干细胞存活必要条件,其异常会使胚胎发育异常甚至死亡[18]。激活SIRT1 有利于干细胞多能性维持并抑制干细胞分化,SIRT1 失活则使干细胞提前分化,这与SIRT1影响H4K16 和H3K9 乙酰化水平继而影响基因表达有关[19]。而SIRT6 的作用则相反:SIRT6 的激活介导H3K56 去乙酰化以促进干细胞分化,抑制SIRT6 则有助于维持多能性[20]。研究显示SIRT2 的下调是多能干细胞分化的重要特征[21]。总之,NAD+依赖的sirtuins酶在胚胎发育和干细胞命运调控的表观遗传调控网络中起着重要作用。
3.4 FAD
FAD 是赖氨酸特异性去甲基酶(lysine-specific demethylase,LSD)家族的辅助因子。LSDs 活性与FAD水平和FAD+/FADH2 相关。
LSD1 通过介导H3K4 去甲基化,可促进干细胞分化过程,而抑制LSD1 则有助于维持干细胞的未分化状态[22]。LSD1 激活使肌肉干细胞成肌向分化,而抑制LSD1 则促进成脂向分化[23]。而对于脂肪来源的干细胞,增强LSD1 可保证脂肪向谱系分化,而阻断LSD1 则促进成骨向分化[23]。因此,LSD1 表达水平对不同干细胞的谱系分化方向的影响不尽相同。
4 治疗应用
葡萄糖及谷氨酰胺代谢相关的表观遗传机制为许多疾病提供了新的治疗靶点及思路。干预代谢物及表观遗传相关酶,对多种肿瘤、心脏疾病及骨质疏松等具有预防及治疗意义。α-KG 通过促进骨髓间充质干细胞的增殖和分化,延缓老年性骨丢失和骨质疏松症[24]。在糖尿病性心肌病中,细胞内NAD+下降而乙酰辅酶A 升高,组蛋白乙酰化标记水平升高。逆转此代谢及表观遗传状态,可以缓解心脏功能障碍[25]。乙酰转移酶HBO1 特异性抑制剂可通过降低肿瘤干细胞H3K14 乙酰化水平,抑制肿瘤生长,可能成为急性髓系白血病的治疗靶点[26]。由此可见,代谢与表观遗传相互作用的研究成果推动了许多疾病治疗的发展。
5 小结
近年来,代谢和表观遗传学引起了不同领域学者的关注。葡萄糖和谷氨酰胺代谢为生命活动提供底物和能量,是细胞代谢十分重要的部分。在干细胞命运决策中,存在着葡萄糖和谷氨酰胺代谢谱的转变。此外,关键中间代谢产物:α-KG、乙酰辅酶A、NAD+和FAD 将代谢与表观遗传机制联系起来,参与细胞命运的调控。这些研究成果也为肿瘤、心脏疾病、骨质疏松等疾病治疗提供了新思路。不难看出,在代谢与表观遗传调控细胞命运决定这个领域仍存在许多未知,例如代谢物之间的交互调节机制,代谢网络在表观遗传调控中的平衡原则等。我们坚信随着研究的深入,细胞命运的内部代谢和表观遗传调控的秘密终会一一揭开。
