伊木萨克通过调节人血清PF4和CXCL7水平改善勃起功能障碍
2021-11-27金秀芳牛立盼郭浩强朱兵兵刘凤霞
金秀芳,牛立盼,郭浩强,朱兵兵,刘凤霞
新疆医科大学基础医学院人体解剖学教研室,新疆乌鲁木齐 830011
勃起功能障碍(erectile dysfunction,ED)是指男性性交过程中阴茎无法勃起或维持正常勃起且病程大于3个月以上的男性性功能障碍疾病[1]。流行病学研究显示,ED的发病率在全球呈逐年上升的趋势,部分地区甚至高达76.5%[2]。ED病程的发生发展受人体内多个系统调控和多条信号通路共同介导,目前的治疗效果尚有很大的局限性。伊木萨克作为一种常见的治疗阳痿的中药,通过延长射精潜伏期、提高性欲、加强阴茎勃起功能等机制治疗ED[3],但具体的药理机制尚未明了。该研究团队前期通过蛋白质组学技术对ED大鼠模型和伊木萨克干预后的大鼠阴茎组织差异表达蛋白进行筛查,得到包括血小板因子4(platelet factor 4,PF4)、趋化因子配体7(chemokine ligand 7,CXCL7)在内的多种与机体炎症反应紧密相关的差异蛋白,并发现大鼠上述蛋白在ED的病理生理过程及伊木萨克治疗ED方面发挥一定作用。为进一步研究ED的发病机制和该药的可能作用机制,该研究于2015年5月—2017年4月采用酶联免疫吸附法检测新疆医科大学第一、第四附属医院男科确诊ED40例例患者血清中PF4和CXCL7的含量变化,观察传统药物伊木萨克对人体内其含量变化的影响,并探讨该药在改善ED患者过程中可能的作用机制,旨在为后续研究ED的发病机制和伊木萨克治疗靶点的探究提供新的研究思路和研究方向。报道如下。
1 资料与方法
1.1 一般资料
选择新疆医科大学第一、第四附属医院的男科门诊及住院确诊ED患者共40例,诊断和排除标准均以1993年美国国立卫生研究院提出的定义为标准:①已婚、同居且居住环境良好;②男性患者的年龄在20~60岁;③患者无精神类疾病和严重器质性疾病;④配偶无严重的器质性疾病;⑤采用国际勃起功能指数5项(IIEF-5)调查问卷表进行评分,且分值<22分。排除标准:①确诊的器质型ED,如外伤、动脉性、静脉瘘型患者;②药物型ED,如服用高血压药、雌激素等药物的患者;③患者合并有心血管、肝肾等系统的原发性疾病,如精神病或不能配合者;④配偶患有全身严重的器质性疾病,如心功能衰竭、肾功能衰竭等。选择同期健康体检者36名作为对照(N组)。纳入标准:经体检及血糖、血尿常规、肝肾功能、心电图等检查,无心、肝、肺、肾等主要器官系统的器质性病变,阴茎勃起的功能正常,IIEF-5指数≥22。该研究选择上述ED患者为M组,采用酶联免疫吸附法分别检测伊木萨克片治疗前和治疗后人血清PF4和CXCL7的含量变化。该研究经新疆医科大学伦理委员会的批准(2015XE036),且所有患者或家属知情同意。
1.2 主要实验仪器和试剂
酶 标 仪 (BIO-RAD-xMark,Microplate spectrophometer,美国伯乐公司),SK-O180-E摇床(SCILOGEX,上海琦淮仪器公司)。伊木萨克(国药准字Z65020144,规格0.5 g/片),人血清PF4 ELISA试剂盒(ab189573,美国Abcam公司),人血清CXCL7 ELISA试剂盒(ab100613,美国Abcam公司)。
1.3 血清蛋白水平检测
参照ELISA试剂盒说明书步骤,分别检测N组、M组人血清PF4和CXCL7含量。
1.4 统计方法
采用SPSS 22.0统计学软件对相关数据进行统计分析,计量资料以(±s)表示,两组间差异比较以t检验,3组比较采用单因素方差分析。P<0.05为差异有统计学意义。
2 结果
2.1 各组人血清PF4含量变化
N组血清PF4浓度为(0.69±0.21)μg/mL,M组治疗前后、N组人血清PF4的浓度比较差异有统计学意义(F=5.513,P<0.05);进一步多重比较发现,N组与M组治疗后人血清PF4的浓度差异无统计学意义(P>0.05),N组、M组治疗后分别与M组治疗前差异有统计学意义(P<0.05)。与N组相比,M组治疗前患者血清PF4含量增加124.6%,差异有统计学意义(P<0.05),而经伊木萨克治疗后,其血清PF4含量与N组相比,其浓度增加42.0%,差异无统计学意义(P>0.05),M组治疗后与治疗前相比,患者血清PF4含量降低58.2%,差异有统计学意义(P<0.05)。见表1。
2.2 各组人血清CXCL7含量变化
N组血清CXCL7浓度为(4.57±0.91)μg/mL,M组治疗前后、N组人血清CXCL7的浓度比较差异有统计学意义(F=41.463,P<0.05);进一步多重比较发现,N组与M组治疗后组间人血清CXCL7的浓度差异无统计学意义(P>0.05),N组、M组治疗后分别与M组治疗前差异有统计学意义(P<0.05)。与N组相比,治疗前患者血清CXCL7含量增加8.7%,差异有统计学意义(P<0.05);而经伊木萨克治疗后,患者血清CXCL7含量与N组相比,其含量增加1.8%,差异无统计学意义(P>0.05)。与治疗前相比,治疗后患者血清CXCL7含量降低6.4%,差异有统计学意义(P<0.05)。见表1。
表1 各组人血清PF4、CXCL7浓度变化比较[(±s),μg/mL]
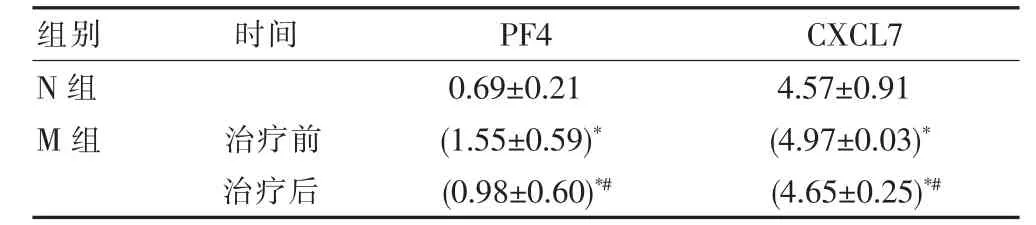
表1 各组人血清PF4、CXCL7浓度变化比较[(±s),μg/mL]
注:*表示与N组比较,P<0.05;#表示与同组治疗前组比较,P<0.05
?
3 讨论
生理条件下的阴茎勃起是一种神经-血管机制共同介导的复杂过程,主要依赖于神经信号和各种生物因子调节下的阴茎动脉和海绵体平滑肌舒张、海绵体窦充血致使阴茎胀大勃起。众所周知,血管内皮细胞可参与血管收缩、舒张及生成,并表达多种血管活性物质,调节血管的生理功能。Park等[4]发现ED的严重程度与阴部内动脉狭窄程度无明显相关性,主要是由内皮功能障碍引起,内皮功能障碍导致内皮NO释放减少和血管舒张功能受损,是动脉粥样硬化血管疾病发生的基本机制[5],阴茎海绵体血管内皮障碍已不单单是局部的身体疾病,更是心血管系统病变的一个预警[6-8]。血管危险因素有年龄、高血压、血脂异常等,其主要原因是内皮功能障碍引起的退行性改变,在ED研究中,已经明确ED的发生、发展是机体内部多种因素联合作用的结果,包括机体内高水平的炎症反应、免疫应答过程、血管内皮功能障碍、脂代谢紊乱、氧化应激反应以及上述病理过程所致的阴茎海绵体微结构改变和血管病变等均为诱发或加重ED的病理生理机制,但目前关于ED具体致病机制的研究尚未完全明了。该研究通过检测ED患者和伊木萨克治疗后患者血清PF4和CXCL7水平的变化,以进一步探究ED的发病机制及伊木萨克的临床治疗机制。
CXC趋化因子是细胞因子家族中通过激活G蛋白偶联受体发挥功能的低分子量蛋白,可与上皮细胞、淋巴细胞、中性粒细胞及内皮细胞上的相应受体结合,进而趋化细胞募集并迁移至炎性病灶,在损伤修复、炎症反应和血管生成等多种病理生理过程中发挥关键作用[9]。PF4和CXCL7作为CXC趋化因子亚家族的重要成员之一,主要通过干预巨核细胞分化、血小板生成等途径发挥作用,是血小板活化后释放的α-颗粒物中含量最多的两类可溶性因子。该研究结果显示ED患者血清PF4浓度为(1.55±0.59)μg/mL,CXCL浓度(4.97±0.03)μg/mL,与N组血清PF4浓度(0.69±0.21)μg/mL和CXCL7浓度(4.57±0.91)μg/mL相比,ED患者血清PF4和CXCL7水平显著增加,分别达到124.6%、8.7%,表明PF4和CXCL7含量的增加在其参与促进局部炎症反应、损伤组织细胞功能以及血管性病变等多种途径介导ED病程中发挥关键的调控作用。
有研究表明人体内PF4是一种生物学功能多样的炎症趋化因子,在机体免疫反应与炎症过程广泛表达,通过诱导巨噬细胞生成、促进受损内皮细胞周边单核细胞的粘附等过程,在机体炎症反应中发挥重要作用[10]。PF4参与介导动脉粥样硬化早、晚期病变[11],Mehmet等[12]研究发现心内直视手术患者采用肝素诱导血小板减少产生的自身免疫性抗体PF4/肝素复合物阳性的患者早期病死率呈增加趋势,PF4中和肝素形成PF4/肝素抗体复合物增加,最终导致动脉或静脉血栓形成。心血管疾病患者PF4水平增加,PF4在内皮细胞受损时发挥促凝作用[11],通过促进血小板聚集、加速血栓形成,造成血管狭窄或堵塞,抑制血管功能,这可能与其诱导基质金属蛋白酶9表达以调节血管重构及血管斑块稳定性等过程有关。
PF4作为抗血管生成因子,可抑制内皮细胞的增殖和游走,或通过抑制血管内皮生长因子受体激活,影响血管生成过程[13-14]。此外,PF4还具有诱导血小板活化、聚集等功能,促进血管壁内膜炎症反应等,以上研究均表明人体内PF4通过介导多种信号途径参与调节ED事件的发生与发展。该研究经伊木萨克治疗后发现ED患者血清PF4、CXCL7浓度明显降低,其血清PF4浓度为(0.98±0.60)μg/mL,浓度为(4.65±0.25)μg/mL,与治疗前相比,患者血清PF4、CXCL7含量显著降低58.2%、6.4%,结果说明伊木萨克可通过改善人血清PF4和CXCL7水平,发挥抗炎、抗氧化应激、稳定脂代谢过程等作用,进而保护内皮和血管功能等改善ED。此外,PF4还参与调节CXCL7合成,这与该研究中ED患者和伊木萨克治疗后患者体内PF4与CXCL7水平变化一致有关。
XCL7,又称中性粒细胞激活肽2,该趋化因子产生并存储在血小板、巨乳细胞、单核细胞、淋巴细胞和中性粒细胞中,与PF4同属血小板活化的特异性标记物。有研究发现CXCL7可通过与趋化因子受体CXCR1/CXCR2结合、激活Ras/Raf/MAPK和PI3K/AKT/mTOR等信号通路发挥重要生理作用[15],其除了具有同PF4类似的促进炎性细胞游走和趋化、上调炎症因子释放以及调节细胞迁移和增殖、血管生成等功能[16-17]外,CXCL7与趋化因子受体CXCR2间信号的上调会加重血管损伤;研究发现在平滑肌-内皮细胞间的通信中,通过阻断CXCL7或其受体CXCR2可显著影响内皮细胞的损伤修复[18],可见ED患者体内高水平炎症反应可能也与血清CXCL7水平上升有一定联系。内皮细胞损伤已经成为ED及心血管疾病的共同致病因素之一,ED的发病是多因素联合诱导、多条信号通路介导调控的,鉴于目前关于ED具体病理生理机制研究的不明确性,当前的治疗效果尚有很大的局限性。伊木萨克作为一种常见的治疗阳痿的中药,通过延长射精潜伏期、提高性欲、加强阴茎勃起功能等机制治疗ED[3]。该研究结果进一步证明PF4和CXCL7含量变化与ED的发病过程及其信号通路调控密切相关,而伊木萨克在ED的病程中,可能通过改善内皮细胞功能,起到抑制炎症和保护血管的作用。
综上所述,该研究结果进一步证明人体内高炎症水平、内皮细胞功能障碍和血管病变在ED病程中发挥重要作用,包括氧化应激反应、脂代谢紊乱、免疫应答过程以及阴茎海绵体微结构改变等均是诱发或加重ED的病理生理机制,而伊木萨克可能主要通过介导上述途径治疗ED,但具体作用机制与方式尚需深入探究。
