基于CASES-T模型构建 有效课堂发展学生化学核心素养
2021-11-25徐惠
徐惠


摘要:基于CASES-T模型构建高中化学选修三“配合物的形成与应用”教学的有效课堂,发展学生化学核心素养,示范基于CASES-T模型设计素养为本化学课堂的实现路径。
关键词:素养为本;教学设计;配合物;CASES-T模型
文章编号:1008-0546( 2021 )08-0027-06
中图分类号:G632.41
文献标识码:B
doi: 10.3969/j.issn. 1008-0546.202 1.08.008
一、問题的提出
2017年新修订的《普通高中化学课程标准》(下简称2017版课标)要求教师在教学中开展以“素养为本的化学课堂教学。所谓“素养为本”的课堂教学就是站在化学学科的视角,将具有化学学科特质的科学观念与科学实践和科学思维作为发展化学学科核心素养的突破口[1]。如何在实践层面构建以“素养为本”的化学课堂就成为了一线教师必须面对的问题。
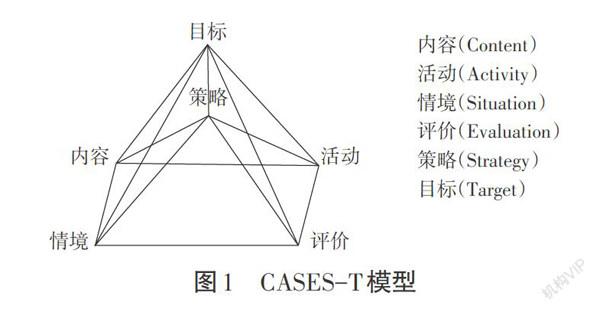
事实上,2017版课标回答了如何在实践教学中构建“素养为本”的化学课堂的问题。2017版课标在呈现课程内容时每一主题内容均提出了“内容要求”“教学提示”和“学业要求”等3个构成部分。其中“学业要求”是预计学生在学习相应教学内容后所能体现出的素养表现要求;而“内容要求”则明确了学生学习哪些内容,这些内容是培养学生素养的学习载体,学生借助于学习这些内容而达到最终的素养要求。在“内容要求”和“学业要求”之间2017版新课标提出了“教学提示”其中又具体包括:“教学策略”“学习活动建议”以及“情境素材建议”等三项。结合具体的课堂教学实践“教学情境”决定了学生在什么氛围下学习教学,“教学活动”决定了学生通过什么方式学习,“教学策略”则决定了怎样才能学得更好的问题。此外只有借助于评价才知道学生学得怎么样,是否达成了教学的目标要求。
内容( Content)、活动(Activity)、策略(Strategy)、评价(Evaluation)、情境(Situation)成为了化学课堂的核心构成5要素,只有这5要素构建整体系统、发挥系统作用才能实现素养为本的整体目标(Target)。郑长龙等专家认为这课堂构成五要素之间的CASES-T模型表征了2017版新课标所倡导的化学课堂教学系统构造(如图1)[2]。基于CASES-T模型,通过对内容、活动、策略、情境以及评价等进行合理的设计整合所设计出的课堂可以有效达成“素养为本”的教学目标。如何在实际课堂教学巾基于CASES-T模型,整合好教学内容、教学活动、教学情境、教学评价和教学策略最终为教学目标服务?教学一线的不断尝试的教学实践活动丰富和发展CASES-T模型的内涵,下文以“配合物的形成与应用”一课的课堂教学设计为例,阐述基于CASES-T模型构建以“素养为本”的有效课堂的实践路径。
二、“配合物的形成与应用”教学设计
1.内容分析与目标追求
CASES-T模型巾,教学内容(Content)是素养培养的载体,立足于素养培养的教学应从教学内容出发制定素养化的教学目标。
课程标准中“配合物”相关的内容要求为:“知道配位键的特点,认识简单的配位化合物的成键特征,了解配位化合物的存在与应用”。如何通过这些教学内容制定素养化的教学目标?配合物在实际生活中应用广泛,从治疗癌症的特效配合物的发现与应用作为起点,从化学史实以及生活走进化学,可以使得化学更贴近学生,从应用到物质性质、性质体现结构正是“宏观辨识与微观探析”核心素养的体现;同时配合物应用于癌症的治疗也正是“发展学生科学精神与社会责任”的重要素材。从制备简单的配合物的实验人手探究一般配合物的简单性质又可以发展学生证据推理、模型认知和实验探究与创新意识等核心素养。实验探究配合物的配位平衡还可以发展学生的变化观念与平衡思想。鉴于此,本教学设计整合现行3种版本教材相关内容,制定针对素养发展的教学目标,并依据教学目标创设教学情境、设计教学活动、结合评价运用恰当的教学策略组织教学。
2.教学过程
【教学情境创设】讲述1961年美国物理学家罗斯伯格(B.Rosenberg)受聘前往密西根大学成立生物物理学系,物理学家跨界进人生物学界后受植物有丝分裂图片(图2)与物理学电磁线(图3)相似的启发,设计实验,利用稳定Pt电极研究电磁能对细胞生长的影响。从而在Pt电极发现一种能够对细胞生长产生影响的物质顺铂-Pt(NH3)2Cl2,并最终将其应用于癌症治疗的故事[3]。并指出这种物质的组成和我们之前所学物质不同,Pt( NH3)2Cl2是一种配合物。进而明确学习主题——配合物的形成与应用。
从科学家的故事人手创设配合物的学习情境,除了激发学生兴趣之外还在于故事此处提出的配合物Pt(NH3)2Cl2也是贯穿整节课的教学线索,用以串起整节课的教学内容。
教师讲述,研究配合物可以直接选择Pt( NH3)2Cl2作为研究对象,但该物质限于条件并不易得,故选择从身边的物质开始实验探究,实验室可用常见药品制备配合物。
【教学任务1】配合物的制备实验探究与分析
教师取2mL O.lmol/L CuSO4溶液,往其中逐滴滴加浓氨水,观察现象并记录,请学生写出对应方程式,并提出问题:“深蓝色物质是CuSO4中谁生成?Cu2+还是?”从熟悉的实验人手引入具有认知冲突的新现象,引发学生思考。学生在教师引导下写出沉淀反应的化学方程式:CuSO4+2NH3.H20一Cu( OH)2↓+2(NH4).S04通过书写,将化学现象转化为化学符号表征。
教师继续取2mL O.lmol/L Cu (N03)2溶液、2mLO.lmol/L CuSO4溶液,分别往其中逐滴滴加浓氨水,引导学生观察现象并记录,通过实验渗透实验控制变量思想。
师生通过上述三组实验现象分析,可知蓝色物质由Cu2+生成。但仍需确认,在蓝色物质生成过程中,S04-是否参与,应如何设计实验证明?引导学生进一步思考培养学生证据意识。
教师再往“深蓝色溶液中加入BaCl2溶液”,溶液出现白色沉淀,证明S04-游离于溶液,未参与蓝色物质的生成。引导思考Cu2+参与了蓝色物质生成,那生成的蓝色物质中,Cu2+离子去了哪里?是否能够电离于溶液中,生成的蓝色物质中,Cu2+是否仍然游离在溶液中?
师生讨论基础上再“往生成蓝色物质的溶液中继续滴加NaOH溶液,观察有无蓝色沉淀出现”,结果发现无蓝色沉淀生成。
师生在分析上述探究实验结果后总结归纳结论一Cu2+参与蓝色物质生成,且生成的物质中Cu2+被牢固束缚。此处层层深入的实验探究引导学生从实验角度逐步认识新生成蓝色物质的组成,为理性分析奠定感性基础。且Cu2+不能大量游离的性质揭示也为后续分析配合物电离性质做铺垫。
教师讲解,上述实验活动获知NH3与Cu2+形成了新微粒,该微粒中Cu2+被紧紧束缚,且S04-未参与其中,该微粒只可能是NH3与Cu2+结合,通过后续测定发现该微粒组成为[Cu(NH3)4]2+并展示如图4所示结构图。实现从实验现象到微观结构的勾连,实现了从宏观辨识到微观的探析。进而教师引导学生写出CuSO4一次性与过量氨水反应离子方程式:Cu2++4NH3= [Cu(NH3)4]2+,又一次将实验现象转化为化学符号表征,从理性角度深入认知物质的转化。
【教学任务2】配合物形成的理論分析
教师提出系列问题:Cu2+为什么能与NH3形成[Cu(NH3)4] 2+?从化学键角度分析[Cu (NH3)4]2+中Cu2+与NH3如何结合?Cu2+、NH3之间的作用是否离子键?是否金属键?通过讨论最终将这种作用定位为共价键,再从Cu2+价电子排布[Ar]3d9分析Cu2+是否可以以常规共价键形式与NH3分子结合?进而引导学生思考特殊的共价键形式——配位键。再在讨论的基础上引导学生以NH3分子与H+结合成NH4+为例复习配位键的形成。
接着回顾:(1)配位键的成键条件:A:提供孤对电子(配位体);B:提供能量相近的空轨道
(2)配位键的表达方式:A→B。
通过讨论,复习所学有关价键理论,建立新知与旧知的联系,为新知学习做好铺垫。
在复习的基础上,教师再次引导学生思考并解决系列问题:(1)Cu2+与NH3之间是否可以通过配位键结合?(2)形成配位键时,谁提供空轨道?谁提供孤对电子?(3)在[Cu(NH3)4]2+结构示意图中表达出[Cu(NH3)4]2+中的配位键形成情况。
层层递进的问题将教学任务问题化,且推进引导学生思维逐步向前发展,最后教师再强调此类配位键正是配合物与其它物质最本质的区别,此时配位化合物的概念呼之欲出。
【教学任务3】配合物的概念界定与组成分析
教师引导,[Cu(NH3)4]2+中金属离子与NH3这样的物质形成特殊的配位键是我们把[Cu(NH3)4]2+界定为配合物的关键原因,能否根据此信息给配合物下个定义?引导学生思考并补充完成图5中横线上内容的填空。
在明确配合物定义后,教师回顾之前制备配合物的实验,CuSO4与过量氨水时发现生成[Cu(NH3)4]2+,溶液中有SO 2-4,生成的配合物可以完整书写为[Cu(NH3)4]SO4,该物质在水巾能电离出[Cu(NH3)4]2+、SO2- 4一两种离子,可以表示为:[Cu( NH3)4] SO4=
,这里生成的完整配合物应是[ Cu( NH3)4]SO4,那[Cu( NH3)4]2+与
一对于[ Cu (NH3)4]SO4又是怎样的存在?且配合物组成相对于一般物质比较复杂,它们的具体组成还可以如何细分呢?引导学生思考并阅读教材相应内容,通过阅读深入理解配合物的组成。学生通过阅读后分析配合物[Cu(NH3)4]SO4,理解配合物组成的各个细节,如图6所示。随后教师再引导学生从配合物组成的各个部分进行进一步的拓展与总结。
总结l——配合物的性质
电离性质:外界易电离、内界难电离:如[Cu(NH3)3]SO4=[Cu(NH3)4]2++S0 2-4
总结2——配合物组成
中心原子(离子):能够接受孤电子对的离子或原子,多为过渡金属元素的离子或原子以及部分主族元素。(如:Cu2+,Ag+,Fe3+,Fe,Ni,Al、P等)
配位体:提供孤电子对的分子或离子(如:X一,OH-,H20,NH3,CO,CN-)。
配位原子:配位体中提供孤电子对的原子(如:X、O、S、N、P等)。
配位数:实际与中心原子(离子)以配位键结合的原子个数。
此处简单概念通过引导学生阅读教材进行学习,既培养学生科学阅读能力,也能发挥教材作用,引导学生回归书本立足基础。[Cu(NH3)4]SO4组成分析到配合物一般组成的归纳,促使学生认知从个别到一般的提升。
教学过程中的适时反馈与评价有助于教师适时判断学生是否存在迷思概念,在配合物组成分析完毕,势必有学生的理解是不到位的,适时进行有效评价对教学行为就显得尤其重要。此时教师可再提出问题:依据概念分析[Cu(H2N-CH2-CH2-NH2)2]2+配位数为几?当学生困惑时适时展现出该微粒的结构如图7,明确“实际与中心原子(离子)以配位键结合的原子个数”为配位数,[Cu(H2N-CH2-CH2-NH2)2]2+配位数为4。
概念是否正确建立,需要在具体物质的识别判断中不断强化,新知识也只有不断纳入旧的学生原有的知识系统中才能逐渐建构发展,对于配合物的知识也是一样。教师根据配合物一般组成以及与一般化合物的本质区别引导学生通过对比分析搜索整个高中阶段所学习过的物质,思考学过的物质巾哪些可能是配合物?在回顾与思考中,学生可以逐一列举出[Ag(NH3)2]OH、Na3[AIF6]、Fe(SCN)3,三种物质,教师引导学生填写表1,通过练习巩固所学概念,将学生已有知识纳入新的概念范畴的做法,可以使知识系统化。
在学生分析上述三种配合物之后,教师进一步引导学生从组成角度分析填写表2。在完成上述两表内容以后,可及时引导学生总结出如下几点:(1)配合物巾,可以是配阳离子也可以是配阴离子、也可以是配分子;(2)配分子没有外界(Pt( NH3)2Cl2);(3)-种配合物中可以有多种配体;(4)同种的配体、中心原子可以形成不同配合物。从更加深入的层次强化了学生对于配合物概念的理解。
此處Pt( NH3)2Cl2的分析,呼应本课初始设置的情境使得教学内容一脉相承,而选取具有概括意义的典型配合物进行分析,既可充分巩固所学有关配合物概念,同时也为后续学习配合物的结构问题埋下伏笔。完成上述两表,通过及时的反馈与评价修正教学行为,促进教学目标的达成,适时体现了评价对于教学的重要性。
【教学任务4】配合物的性质探讨
上述分析的最后两种配合物中,同样的中心原子C03+,同样的配体NH3、Cl-,却形成了不同的两种配合物,这两种配合物品体[Co(NH3)6]Cl3和[Co(NH3)5Cl]Cl2,展示图片显示一种为橙黄色,另一种为紫红色,提出问题如何设计实验方案将这两种配合物区别开来?在学生进行讨论的过程中教师可引导学生注重定量实验方案设计的一般方法。学生尝试解决此问题的过程,是“配合物内界难电离,外界易电离的性质”的应用,也是本节课学习内容掌握的及时反馈与评价。
教师进一步提出C03+的配合物的美丽颜色打动了人,课上所用的CuSO4溶液也有漂亮的蓝色,可是新的问题也出现了,无水硫酸铜为白色固体,硫酸钠也是白色固体,那么硫酸铜溶液为什么是蓝色的呢?具有思维冲突的问题再次促使学生深入思考。
教师可引导学生思考硫酸铜溶液中存在的Cu2+与H2O分子之间可能的作用,进而分析硫酸铜溶液巾的蓝色为[Cu(H2O)4]2+所表现出的颜色,适时展示[Cu(H20)4]“的微观结构图如图8,再次强化宏观与微观的联系。
分析CuSO4溶液的蓝色后,可再次引导学生回忆无水CuCl2的颜色为何?结合高一知识学生可知,CuCl2为棕黄色。教师展示一瓶浓CuCl2溶液为绿色,介绍溶液中存在棕黄色[CuCl4]2-请学生尝试分析为什么CuCl2溶液为绿色,师生共同进行系列实验探究。
实验(l):往绿色CuCl2溶液中逐渐加水稀释至溶液为蓝色(图9-10)。
实验(2):向蓝色的氯化铜溶液中加一药匙NaCl固体观察颜色,再向加过NaCl固体的溶液中加水(图11)。
基于上述实验所呈现的证据,可以分析出配合物具有怎样的性质?在教师的引导下,学生不难发现,CuCl2溶液中存在[Cu(H20)4]2++4Cl
[CuCl4]2-+4H20的平衡,配合物内界的中心离子和配体之间是配位键,但配合物内界仍是可以电离的,只是电离微弱而可逆。此处通过实验展现出配合物的配位平衡,不仅让学生对于配合物的性质有了更清晰全面的了解,也培养了学生的变化观念与平衡思想。
【教学任务5】配合物结构的异构分析
物质的性质反映的是物质的结构,理解了配合物的一般性质后,我们能够把目光重新回到我们一开始就提到的配合物——Pt( NH3)2Cl2,能否尝试用球棍搭出Pt( NH3)2Cl2的结构模型?学生通过动手活动可以搭出如图12两种结构,两种结构为同分异构体。
讲述当年美国物理学家罗斯伯格在研究时同时发现了两种Pt( NH3)2Cl2分子,但这两种分子中一种是棕黄色极性分子,有抗癌性,另一种是淡黄色非极性分子,无抗癌性,请利用所学的物质结构知识分析,上述哪一结构具有抗癌性。学生应用本单元所学分子结构相关知识不难得出“顺铂”为具有抗癌性的分子。
此处学生通过动手活动搭建出Pt( NH3)2Cl2的两种结构,强化了学生的学习参与,也使得配合物的同分异构现象更为直观可见,且不同结构的物质展现出不同的性质,进一步强化了学生“结构决定性质”的基本的化学学科思维。且本课的教学,行将至此,又一次回到了初始设定的教学情境,做到了整个教学情境有始有终,教学情境能够为教学目标达成服务,教学情境才是有价值的。
【教学总结与回顾】这一节课的学习,通过共同研讨学习了(l)配合物不同寻常的成键方式(2)配合物有着丰富的结构(3)配合物也悠着独特的性质,这些必然决定配位化合物在各个层面有着神奇的用途,如“顺铂”可以用于治疗癌症,其实配合物还有很多用途,下节课继续探讨。总结教学,承上启下,教学情境也做到首尾呼应。
三、CASES-T模型应用于教学设计的思考
通过上文的详细叙述,我们不难看出基于CAS-ES-T模型的“配合物的形成与应用”一课的教学设计首先从核心素养培养角度解析本节课的教学目标,做到教学目标的“素养化”指向,然后分析教学内容,寻求信息资源匹配到真实且有意义的著名配合物“顺铂”的发现和利用历史,将其设计成贯穿整节课的教学情境,让学生在启发且趣味的情境巾学习,“真实的情境”是设计发展学生化学核心素养课堂重要的要素。教学内容如何在整个教学情境中贯穿也是重要的,本课的设计将教学内容进行了“任务化”分解与协同,整节课按照“配合物相关知识”获得的逻辑顺序将教学内容“分解”成“配合物的制备实验探究与分析”“配合物形成的理论分析”“配合物的概念界定与组成分析”“配合物的性质探讨”“配合物结构的异构分析”等五个思维关联的教学任务,五个教学任务层层递进,层次分明,任务的逐一解决过程也是教学目标达成的过程。而在每个教学任务的完成过程中,实施的是具体的教学活动,构建以“素养”为根本目标追求的教学课堂,教学活动必须是多样化的,“实验探究”“对话与讨论”“教材阅读““提问与回答”“模型搭建”……等丰富的活动拓展了知识的获得路径、愉快了学习的过程、提升了学习的目标达成度。至于在什么时候组织怎样的教学活动,属于教学策略层面是教师个人教学智慧的体现,以“素养”为目标导向的教学中,教师在不断思考与提升中,不断调整教学策略,灵活的策略使得课堂有着更多的灵动,且教师的策略选择应注意化学学科“变化与平衡”“结构决定性质”“宏微结合”等核心思维方式的培养,只有将基本化学思想融入教学,才能最终在学生思想巾成长。此外,课堂教学巾适时的教学评价可以即时反馈教学的效果,以“素养为本”的课堂,教学评价适时纳入到教学活动中,适时成为教师巧妙的教学策略。
基于CASES-T模型为“素养为本”的教学课堂设计提供了具有操作意义的设计路径。教学目标素养化、教学情境真实化、教学内容任务化、教学活动多样化、教学评价适时化、教学策略智慧化成就发展学生素养的化学课堂。
参考文献
[1]郑长龙,孙佳林.“素养为本”的化学课堂教学的设计与实施[J].课程·教材·教法,2018,38(4):71-78
[2]郑长龙.2017年版普通高中化学课程标准的重大变化及解析[J].化学教育(中英文),2018,39(9):41-47
[3]王夔.顺铂——多学科探索的成果[J].大学化学,1989(5):59-62
本文系江苏教育科学规划课题“基于真实问题的学生化学素养评价研究”(编号D/2016/02/24)研究成果。
