山银花提取物的抑制酪氨酸酶活性
2021-11-25易灿周新崇刘进兵
易灿,周新崇,刘进兵
邵阳学院食品与化学工程学院(邵阳 422000)
山银花作为忍冬科植物,是一种大宗中药材,具有清热解毒、疏散风热的功效,临床上用于治疗咽喉肿痛、风热感冒等疾病[1],主要产区为湖南隆回县和重庆秀山[2]。山银花主要活性成分为有机酸、黄酮类、环烯醚萜苷类及皂苷类、挥发性物质[3],山银花与金银花活性成分不同,研究者发现,与金银花比较,山银花中绿原酸成分较多,木犀草苷成分较少,并含有金银花目前未发现的皂苷类成分[4]。在药理作用方面,研究者发现山银花具有抗氧化性、抗菌抗炎、抗病毒、抗过敏、保肝利胆等功效[5-6]。
酪氨酸酶(EC 1.14.18.1,tyrosinase)是一种具有耦合双核铜活性位点的金属酶,其中每个铜离子与3个组氨酸残基螯合,这种多功能酶催化铜在氧分子存在下氧化苯酚和邻苯二酚[7]。酪氨酸酶作为参与酶促褐变的主要物质,是黑色素合成的关键酶及唯一限速酶,对皮肤、毛发的颜色起关键作用[8],酪氨酸酶表达异常可直接或间接导致非肿瘤性皮肤色素沉着障碍[9]。酪氨酸酶还能引发果蔬褐变造成食品颜色、味道变劣,甚至产品腐败变质,严重时会导致营养价值损失,产品货架期缩短,对其营养功效和商业价值造成损害。所以酪氨酸酶抑制剂在食品防腐添加剂、预防或治疗色素沉着障碍的药物和化妆品中的应用得到越来越多研究[10]。大多数酪氨酸酶抑制剂为化学合成,具有一定毒副作用。因此,从自然界中寻找安全低毒、高效的酪氨酸酶抑制剂越来越受到研究者关注。
试验探讨山银花不同溶剂萃取物对酪氨酸酶的抑制活性,运用酶动力学探讨其抑制机制,为进一步综合利用山银花资源提供参考和理论依据。
1 材料与方法
1.1 试验材料
隆回山银花(湖南省隆回县农贸市场);曲酸(纯度≥97%)、蘑菇酪氨酸酶(T3824-25KU)(上海阿拉丁生化科技有限股份公司);左旋多巴(L-DOPA,纯度≥99%,Johnson Matthey化学公司);其他均为国产分析纯。
FW135型中草药粉碎机(天津市泰斯特仪器有限公司);MCR-3常压微波化学反应器(巩义市中天仪器科技有限公司);PT-3502C全波长酶标分析仪(北京普天新桥技术有限公司);Cary Edipse荧光分光光度计(美国安捷伦科技有限公司)。
1.2 方法
1.2.1 提取分离
称取经中草药粉碎机中粉碎,过0.250 mm(60目)筛且石油醚脱脂12 h的粉末的干燥金银花20 g,在料液比1∶20(g/mL),微波功率400 W,乙醇浓度60%、提取时间8 min条件下提取,过滤,滤液减压浓缩至浸膏,加适量水混匀后,先后用石油醚、乙酸乙酯、正丁醇萃取,得石油醚相、乙酸乙酯相、正丁醇相和水相部分,减压浓缩后,干燥,所得浸膏用75%乙醇配制成各浓度溶液。
1.2.2 体外抑制酪氨酸酶活性测试
1.2.2.1 对酪氨酸酶活性抑制效果分析
利用L-DOPA为底物,研究山银花对酪氨酸酶活性的抑制效果[11]。将山银花石油醚相、乙酸乙酯相、正丁醇相和水相浸膏配制成初始质量浓度1 000 mg/L的溶液,试验时分别稀释成15.525~1 000 mg/L。在96孔板中依次加入160 μL 磷酸盐缓冲液(0.05 mol/L、pH 6.8)、20 μL待测样品(其中空白组20 μL磷酸盐缓冲液),20 μL酪氨酸酶溶液(0.2 mg/L)在28 ℃水浴条件下保温孵化15 min后,加入20 μL L-DOPA溶液(10 mmol/L)、在475 nm波长下进行动力学测试,抑制率按式(1)计算。
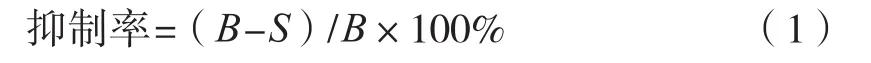
式中:B为空白吸光度;S为样品吸光度。
1.2.2.2 对酪氨酸酶的抑制动力学分析
在以上抑酶效果测定体系中维持酪氨酸酶的浓度不变,改变体系中L-DOPA浓度,测定酶促反应速率[12]。以底物质量浓度的倒数为横坐标和反应速率的倒数为纵坐标绘制Lineweaver-Burk曲线,根据直线交点的位置判断山银花萃取物对酪氨酸酶活性的抑制类型[13]。
1.2.3.3 荧光淬灭
山银花萃取物对酪氨酸酶的荧光淬灭试验参照Han等[14]的方法。采用Stern-volmer方程对荧光淬灭数据分析。

式中:F0为荧光物质的初始荧光强度;F为相互作用后荧光物质的荧光强度;Kq为双分子猝灭过程的速率常数;Ksv为Stern-Volmer方程猝灭常数;τ0为猝灭剂不存在时生物大分子的荧光平均寿命,一般为10-8s;[Q]为荧光淬灭剂浓度。
2 结果与讨论
2.1 山银花提取物对酪氨酸酶活性的抑制作用
以曲酸为对照物,山银花不同萃取物对酪氨酸酶活性的抑制作用如图1所示。4种山银花萃取物对酪氨酸酶活性的抑制效果随质量浓度增大而增强,并呈量效关系,抑制能力大小为乙酸乙酯相>正丁醇相>石油醚相>水相,其水相抑制酪氨酸酶活性能力最差。由Origin 2018软件分析得石油醚、乙酸乙酯、正丁醇、水相、曲酸IC50值分别为468.18,276.29,447.99,767.26和38.58 mg/L。

图1 曲酸和山银花萃取物对酪氨酸酶的抑制作用
2.2 山银花萃取物对酪氨酸酶抑制动力学分析
因山银花乙酸乙酯相对酪氨酸酶抑制效果最好,所以选择此相进行抑制动力学分析。由图2可知,随着山银花乙酸乙酯相的质量浓度增大,直线斜率增大,且直线几乎相交于横轴的一点,最大反应速率Vmax减小,米氏常数Km基本不变,由此推断它对酪氨酸酶的抑制作用类型为非竞争抑制型。根据Lineweaver-Burk方程(表1)计算得乙酸乙酯相的Km值约5.91 mmol/L。以各直线与纵坐标的交点对山银花乙酸乙酯相质量浓度进行二次作图也可得到一条线性良好的直线,如图3,通过这条直线与横轴的交点可求得山银花乙酸乙酯相对游离酶的抑制常数KI(KIS)为593.54 mg/L。

表1 山银花乙酸乙酯相对酪氨酸酶抑制作用的Lineweaver-Burk方程

图2 山银花乙酸乙酯相对酪氨酸酶抑制类型

图3 山银花乙酸乙酯相酶抑制常数KIS的测定
2.3 山银花提取物对酪氨酸酶的荧光淬灭作用
在激发波长280 nm下,0.5 U/mL酪氨酸酶在不同浓度山银花乙酸乙酯相萃取物(0~100 mg/L)下的荧光光谱,如图4所示。酪氨酸酶的荧光发射强度在355.84 nm处达到最大,随着山银花乙酸乙酯相浓度增加,酪氨酸酶的荧光发射峰的强度不断降低,酪氨酸酶的最大发射波长发生红移,可以推断萃取物与酶发生相互作用,且对酶具有荧光猝灭作用[15]。
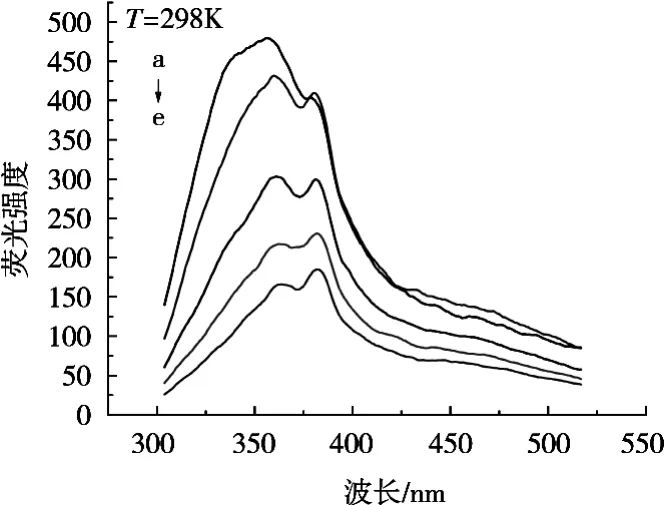
图4 山银花萃取物对酪氨酸酶的荧光作用
2.4 山银花提取物对酪氨酸酶的荧光猝灭机理
将山银花乙酸乙酯相质量浓度对F0/F-1作图,结果如图5所示。F0/F-1与[Q]呈良好的线性关系,根据Stern-volmer方程计算的相关参数见表2。结果显示,随着温度升高,淬灭常数Ksv、Kq减小,可判断山银花乙酸乙酯相对酪氨酸酶的荧光淬灭方式属于静态淬灭[16]。

图5 山银花乙酸乙酯相对酪氨酸酶荧光猝灭的Stern-Volmer图

表2 山银花萃取物与酪氨酸酶相互作用的Stern-Volmer方程参数
3 结论
试验采用微波辅助法提取山银花有效成分,并用不同溶剂进行萃取,对萃取物进行体外酪氨酸酶抑制试验,优选活性最强的萃取物并确定其抑制类型。结果显示,山银花不同溶剂萃取物具有一定酪氨酸酶抑制活性,其中山银花乙酸乙酯相抑制酪氨酸酶能力明显优于其他山银花萃取物,由酶促动力学及荧光光谱法研究结果显示,山银花乙酸乙酯相和酪氨酸酶的相互作用是按照静态淬灭进行,其抑制类型为非竞争抑制。后续可对山银花乙酸乙酯相进行分离纯化研究,以期分离出活性高的抑制酶单体成分。试验结果为山银花提取物在医学、食品及化妆品领域的应用提供参考依据。
