响应面法优化紫花芸豆凝集素的反胶束萃取工艺
2021-11-25符家良李春莲张红杨黄齐林阮长青张东杰
符家良 ,李春莲,张红杨,黄齐林,阮长青 ,张东杰
1.黑龙江八一农垦大学食品学院(大庆 163319);2.黑龙江省农产品加工与质量安全重点实验室(大庆 163319);3.国家杂粮工程技术研究中心(大庆 163319);4.黑龙江省杂粮加工及质量安全工程技术研究中心(大庆 163319)
凝集素是具有糖专一性与血型专一性的一类蛋白质[1],故凝集素可与动物消化道内膜结合并产生一定的毒副作用[2-3]。近年来,凝集素的抗菌、抗虫及抗肿瘤等性质开始被国内外学者重视,凝集素亦开始应用于农学、临床医学及生化检测领域[4-6]。
凝集素具有致敏剂量低、致死率高的特点,是芸豆中主要的过敏原蛋白之一[7]。早年亦有因食用未彻底加热的芸豆而致使食物中毒的案例[8],后经证实其主要致病原因为凝集素导致的毒副作用。紫花芸豆在东北也叫饭豆、大芸豆,含有优质蛋白质,是东北常见的食材[9]。课题组前期研究发现紫花芸豆凝集素其活性仅次于黑豆,显著高于其他杂豆品种,故对紫花芸豆中的凝集素进行提取和纯化并研究其相关性质具有必要性。
反胶束萃取作为双水相萃取方法的一种,通过表面活性剂在有机相中形成“水池”,利用电荷相互作用使蛋白进入反胶束“水池”中,通过改变表面活性剂类型、溶液pH、离子强度等参数就可以选择性萃取蛋白[10-12]。该方法不但具有选择性高、成本低、操作方便、易放大等优点,而且避免了双水相萃取中蛋白直接与有机相接触而易失活的缺点[13],现已在蛋白质的提取中有了广泛应用[14-16],但使用反胶束萃取法萃取凝集素的相关文献则罕见。
试验利用反胶束萃取对课题组前期的紫花芸豆凝集素粗提液进行分离纯化,探究反胶束萃取应用于凝集素纯化的可行性,以期得到一种高效的凝集素纯化方法,为后续研究工作的开展提供基础。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
紫花芸豆,黑龙江省哈尔滨市王岗镇新立村;4%兔红细胞,广州鸿泉生物科技有限公司;牛血清蛋白(生化试剂纯),上海源叶生物科技有限公司;其余试剂均为分析纯。
1.1.2 主要仪器与设备
FA2204B电子天平(上海天美天平仪器有限公司);CTH1850R高速冷冻离心机(湖南湘立科学仪器有限公司);723N可见分光光度计(上海仪电分析仪器有限公司制造);PHS-3C pH计(上海精密科学仪器有限公司);HZQ-C气浴恒温振荡器(常州金坛良友仪器有限公司)。
1.2 方法
1.2.1 样品前处理
根据前期研究,对原料粉碎,得到粒径0.25 mm的粉末,以PBS为浸提液,控制条件为超声功率300 W、微波功率300 W、提取时间30 min,提取后离心取上清液,得凝集素粗提液,其凝血活性为78 251.78 HU/mg。
1.2.2 萃取流程
样品粗提液→前萃取→离心→有机相→后萃取→离心→水相→透析冻干
1.2.3 单因素试验
根据何述栋[17]的研究方法,参照设计反胶束萃取凝集素的单因素试验,控制反胶束水分含量25%,以前萃取丁二酸二辛酯磺酸钠(AOT)浓度、前萃取离子强度、前萃取pH、前萃取时间、后萃取离子强度、后萃取pH为自变量,以蛋白回收率和纯化倍数为因变量进行单因素试验。根据单因素试验结果,利用软件Design-Expert.V8.0.6设计响应面优化试验。
1.2.4 响应面设计试验
根据单因素试验结果,固定前萃取离子强度50 mmol/L、萃取时间20 min,以前萃取pH、前萃取AOT浓度、后萃取pH、后萃取离子强度为因素,利用Design-Expert.V8.0.6软件进行Box-Behnken响应面优化试验,因素水平见表1。

表1 响应面因素水平表
1.2.5 蛋白质含量的测定
使用Folin-酚法测定蛋白含量[18]。
1.2.6 血凝活性测定
参照孙册等[1]与陈靖宜[19]的方法,由于方法中所用的最大凝血倍数和半数凝血倍数带有较强的主观意识,不易准确判断,故试验采用使红细胞全部凝结的最大稀释倍数为指标进行数据处理。凝血活性(HA,HU/mg)表示每毫克凝集素的活性单位,按式(1)计算,以该公式计算所得的凝集素活性亦可对凝集素的提取率进行表示。
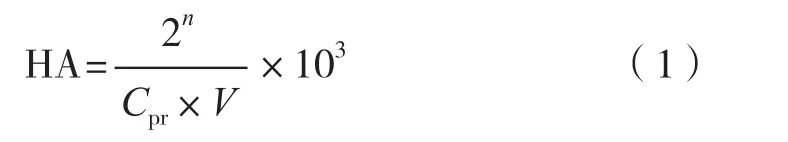
式中:n为红细胞全部凝结的最大稀释倍数;Cpr为粗提液蛋白浓度,mg/mL,按1.2.5中方法测定;V为每孔粗提液体积,50 μL。
1.2.7 蛋白回收率和纯化倍数测定
蛋白回收率和纯化倍数按式(2)和(3)计算。
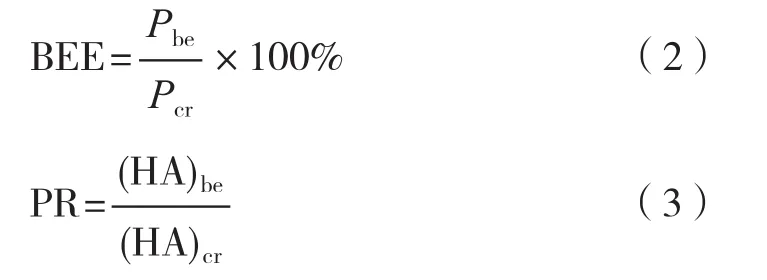
式中:BEE为蛋白回收率,%;Pbe为后萃取蛋白含量,mg/mL,按1.2.5中方法测得;Pcr为粗提液蛋白含量,mg/mL;PR为纯化倍数;(HA)be为后萃取凝血活性,HU/mg,按1.2.6中方法测得;(HA)cr为粗提液凝血活性,HU/mg。
采用Origin 8.0和SPSS 18.0软件进行绘图、数据分析。
2 结果与分析
2.1 单因素结果
2.1.1 前萃取pH对反胶束萃取的影响
由图1可知,当pH为3~5时,纯化倍数随pH的增大而增大;当pH为5时,纯化倍数达到最大;当pH>6时,虽然仍有较高的蛋白回收率但纯化倍数开始降低,可能是由于杂质蛋白被大量萃取而凝集素相对萃取率降低所导致。
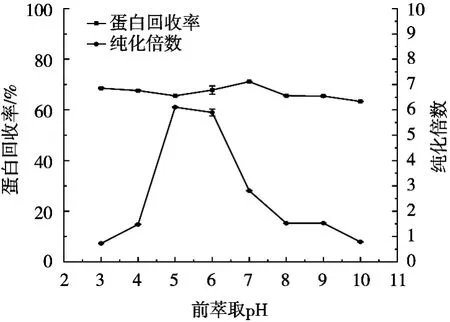
图1 前萃取pH对反胶束萃取的影响
2.1.2 前萃取AOT浓度对反胶束萃取的影响
由图2可知,当AOT浓度在50 mmol/L以下时,蛋白回收率和纯化倍数均增加,此时随着AOT浓度的增加反胶束水池数量增加,故溶液对凝集素的萃取率提高,进一步提升AOT浓度,或许是过多的反胶束交联在一起,使得蛋白萃取回收率下降。
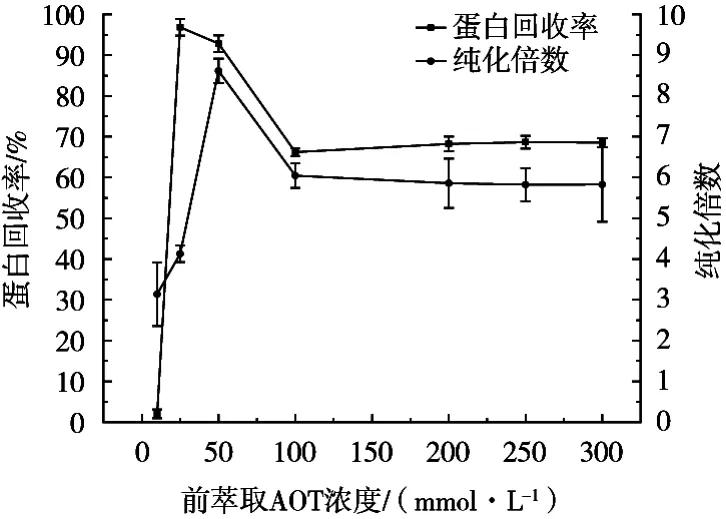
图2 前萃取AOT浓度对反胶束萃取的影响
2.1.3 前萃取离子强度对反胶束萃取的影响
由图3可知,当前萃取离子强度<50 mmol/L时,蛋白回收率和纯化倍数均较低,且在试验过程中水相和有机相界面浑浊,不利于两相分离。随着离子强度提升,离子力增强,纯化倍数和蛋白回收率随之升高。离子强度在50~100 mmol/L之间得到最大的纯化倍数,当离子强度>100 mmol/L时,或许是由于溶液中高离子强度导致的拜德长度降低,电荷屏蔽增大,导致目标蛋白和反胶束之间的静电吸引力下降,故纯化倍数降低[17]。
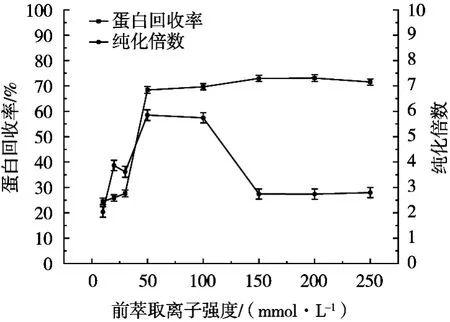
图3 前萃取离子强度对反胶束萃取的影响
2.1.4 前萃取时间对反胶束萃取的影响
由图4可知,当萃取时间在15 min至20 min之间时,纯化倍数显著增高,当时间达到20 min时,纯化倍数达到最大,此后随着时间的延长,纯化倍数下降,可能是杂质蛋白进入反胶束内导致的凝集素相对比例下降所导致。
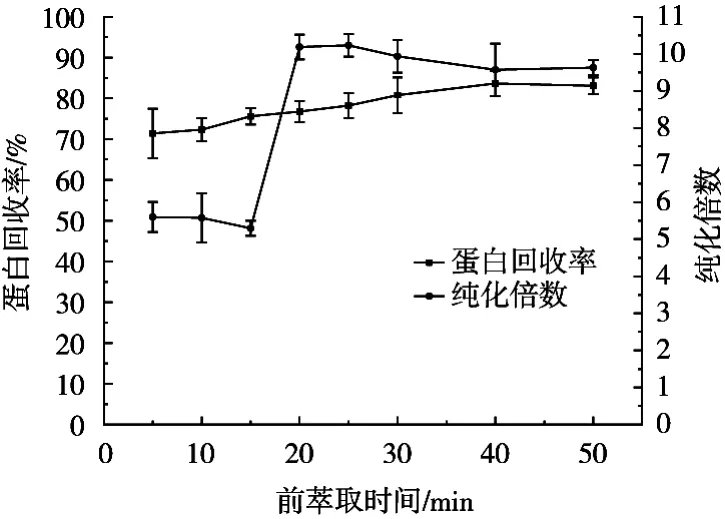
图4 前萃取时间对反胶束萃取的影响
2.1.5 后萃取pH对反胶束萃取的影响
由图5可知,当pH达到9时,凝集素纯化倍数达到最大;当pH>9时,在试验过程中可在两相界面处看到白色固体存在,可能是由于部分蛋白变性所导致,因而限制了凝集素的后萃取;当pH为8~12时,蛋白回收率无显著变化,说明此时蛋白的萃取可能是由疏水力而非静电力为主导。
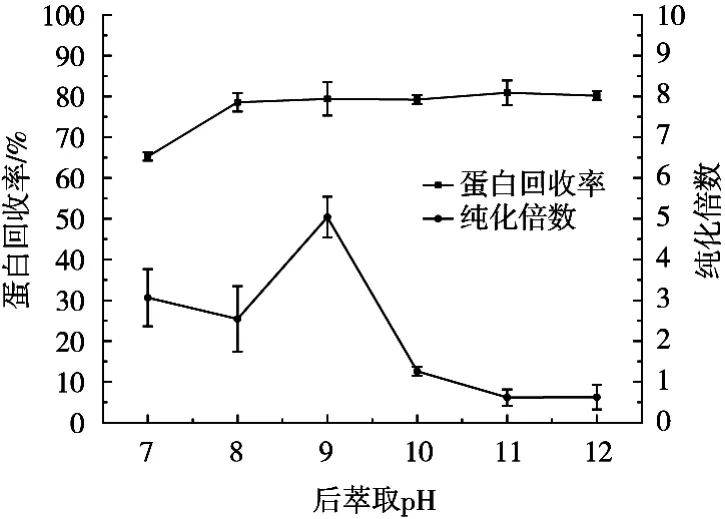
图5 后萃取pH对反胶束萃取的影响
2.1.6 后萃取离子强度对反胶束萃取的影响
由图6可知,当后萃取离子强度达到500 mmol/L时,纯化倍数达到最大;当离子强度高于500 mmol/L时,纯化倍数开始下降,或许是由于过高的盐浓度使凝集素失活,从而导致纯化倍数下降。
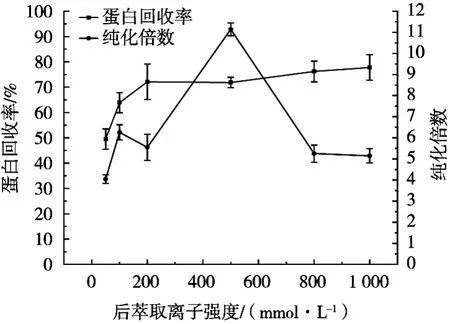
图6 后萃取离子强度对反胶束萃取的影响
2.2 响应面试验结果
2.2.1 结果及方差分析
响应面试验结果如表2所示,利用Design-Expert.V8.0.6软件对表中数据进行分析,得到各因素与响应值之间的多元二次回归模型:
蛋白回收率(Y1)=81.37-12.99A-7.09B+1.51C+3.70D-1.62AB-0.30AC+0.38AD+2.31BC+5.87BD+3.02CD-18.33A2-17.93B2-12.74C2-14.56D2
纯化倍数(Y2)=9.53-1.33A+0.92B-0.14C+0.38D+0.046AB-0.036AC+0.13AD-0.10BC-0.067BD+0.050CD-2.92A2-2.53B2-1.77C2-1.65D2
对结果进行方差分析,结果如表3所示。蛋白回收率回归模型F=5.04,p=0.002 3<0.01,失拟项p=0.290 1>0.05,纯化倍数回归模型F=4.24,p=0.005 3<0.01,失拟项p=0.835 8>0.05,说明各因素与响应面之间建立的模型极显著,方程对试验模拟情况好,试验误差小。
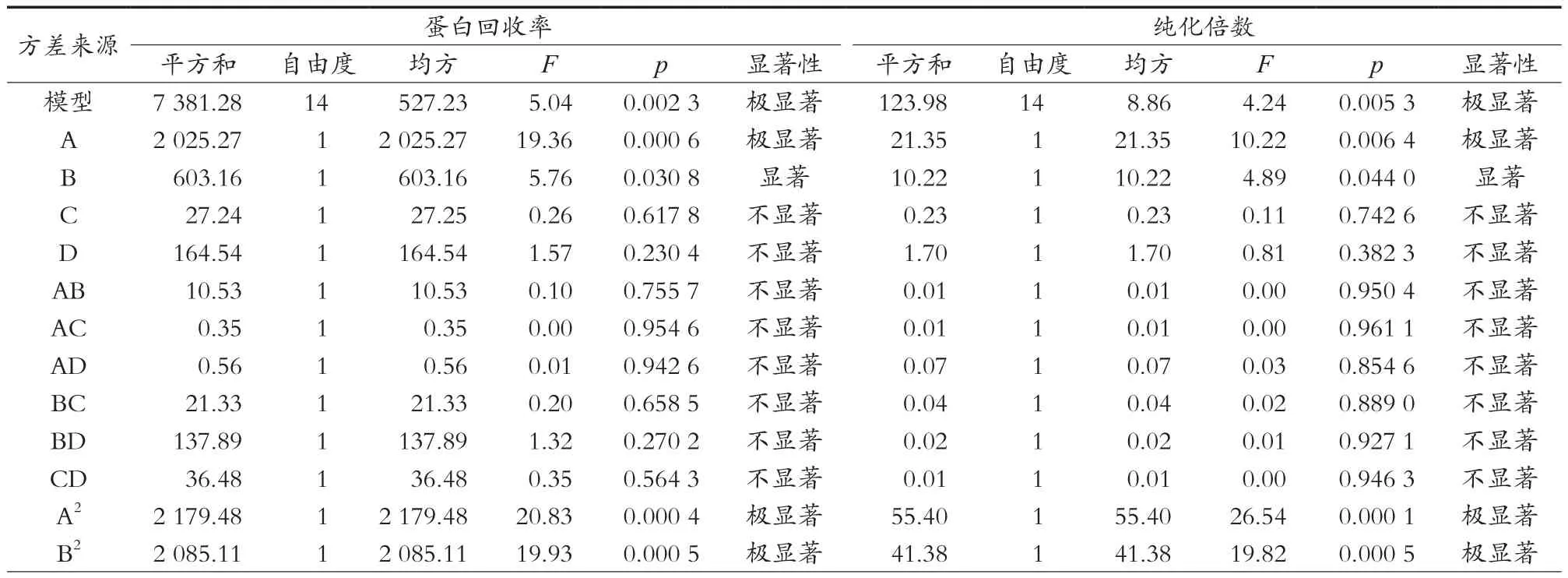
表3 回归模型方差分析
由方差分析可知,一次项A对蛋白回收率和纯化倍数的影响均极显著(<0.01),B对蛋白回收率和纯化倍数的影响均显著(<0.05),二次项A2、B2、C2、D2对蛋白回收率的影响均极显著,A2、B2、C2对纯化倍数的影响极显著(<0.01),D2对纯化倍数的影响显著(<0.05)。由F值可知,各因素对蛋白回收率和纯化倍数的影响依次为A>B>D>C,即前萃取pH>AOT浓度>后萃取离子强度>后萃取pH。
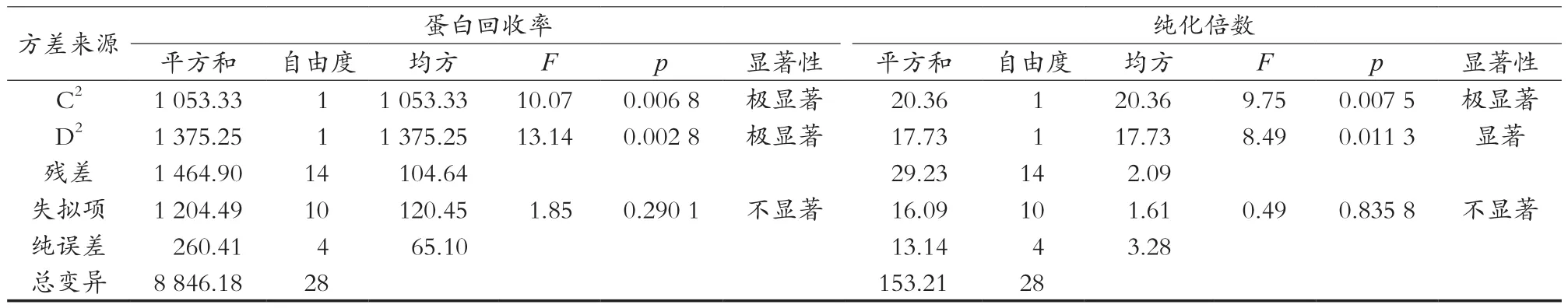
接表3
2.2.2 响应面优化验证
通过回归模型预测,得到反胶束萃取紫花芸豆凝集素的最佳条件:前萃取pH 5.78、AOT浓度59 mmol/L、后萃取pH 8.96、后萃取离子强度530 mmol/L。该条件下预测的蛋白回收率为81.77%,纯化倍数为9.79。根据实际条件调整为前萃取pH 5.8、AOT浓度60 mmol/L、后萃取pH 9.0、后萃取离子强度530 mmol/L,所得蛋白回收率为82.66%,纯化倍数为9.65倍,与预测值相比,蛋白回收率相对误差为1.07%,纯化倍数相对误差为1.41%,验证了该模型的有效性,可以利用响应面对反胶束萃取进行预测与分析。
3 结论
此次试验证明了反胶束萃取法可用于紫花芸豆凝集素的分离纯化,利用响应面可确定反胶束法萃取紫花芸豆凝集素的最佳条件:前萃取离子强度50 mmol/L、萃取时间20 min、前萃取pH 5.8、AOT浓度60 mmol/L、后萃取pH 9.0、后萃取离子强度530 mmol/L。在该条件下,蛋白回收率为82.66%,纯化倍数为9.65倍,接近预测值,验证了该模型的有效性,可以利用响应面对反胶束萃取进行预测与分析。
今后可从热或酸碱处理对紫花芸豆凝集素构象的影响、凝集素糖结合位点、结构域的分析或空间结构预测等方面进行进一步研究,以探究紫花芸豆凝集素的性质和生物学信息,为紫花芸豆凝集素的应用提供理论支持。
