维生素E/抗菌肽缓释微胶囊的制备及表征
2021-11-25王新新许令侠卢艳慧曲芙生李迎秋梁艳
王新新,许令侠,卢艳慧,曲芙生,李迎秋,梁艳
齐鲁工业大学(山东省科学院)食品科学与工程学院(济南 250353)
维生素E作为一类脂溶性活性物质,在抗氧化方面表现突出,但因其对紫外线、氧、酸碱等外部因素较为敏感,无法直接进行使用。被称为新型抗菌剂的抗菌肽是一类由12~100个氨基酸残基所构成的两亲性阳离子肽,无交叉抗性和病原菌耐药性。研究表明,抗菌肽具有多重生物活性,如抗病毒、广谱抗菌等,并在热稳定性、耐酸碱性、对高等动物正常细胞毒副性小等方面表现优异[1-4]。虽然抗菌肽作为抗生素替代品具有巨大的发展潜力,但因为生物体内存在的蛋白酶对抗菌肽具有一定水解作用,导致其利用率及抗菌性能大打折扣,在实际应用中严重受限。
微胶囊技术是微量物质包裹在聚合物薄膜中的技术,是一种储存固体、液体、气体的微型包装技术。该技术因可增强产品稳定性、提高产品缓释性能以及改善产品物理性质等特点,而被广泛应用在食品、医药、生物技术等多个领域[5]。复合凝聚微胶囊技术选择高分子材料(带相反电荷)作为壁材,将芯材分散于壁材溶液中,通过pH调节,使相反电荷间通过静电自组装在芯材表面形成固化膜,并利用溶解度改变后的相分离现象而获得的微胶囊[6]。该技术所生产的微胶囊由疏水性的芯材和亲水性的壁材所构成,具备高载量、耐高温的特性,并在芯材的缓控释方面优势显著[7]。
试验以氨基-β-环糊精和阿拉伯胶为壁材,以维生素E/抗菌肽为芯材,通过构建复合凝聚体系,制备一种维生素E/抗菌肽复合凝聚微胶囊[8-10]。通过单因素试验对微胶囊制备工艺进行优化处理,并利用红外、形貌表征、粒径分析、抗菌肽体外试验及活性验证对所制备维生素E/抗菌肽微胶囊进行表征,以期实现维生素E和抗菌肽在体内利用率的提升及抗菌性能的缓慢释放[11]。
1 材料与方法
1.1 材料与试剂
氨基-β-环糊精(山东滨州智源生物科技有限公司);阿拉伯胶(上海阿拉丁生化科技股份有限公司);维生素E(上海阿拉丁生化科技股份有限公司);抗菌肽(上海玉博生物科技有限公司);吐温80(上海麦克林生化科技有限公司);人体胃液(福州飞净生物科技有限公司)。
1.2 仪器与设备
ESR-500X高速剪切乳化机(南通博莱德机械科技有限公司);FS-1高速匀浆机(常州市凯航仪器有限公司);GY-GTGZJ喷雾干燥机(上海归永电子有限公司);Quanta 200扫描电镜(FEI公司);TENSOR红外光谱仪(广东晟泽科技有限公司);马尔文3000激光粒度仪(深圳市倍钠德科技有限公司);BT-1001智能粉体特性测试仪(丹东百特仪器有限公司);BGG-9035A鼓风干燥箱(上海精宏实验设备有限公司)。
1.3 试验方法
1.3.1 复合凝聚微胶囊的制备与优化
1.3.1.1 微胶囊芯材的制备
准确称取200 g维生素E油和适量的吐温80(调节HLB值在10~13.5)置于高压剪切乳化机中,以2 000 r/min转速高速分散处理10 min后,将等质量的抗菌肽水溶液缓慢滴入其中,并以3 000 r/min转速进行乳化分散处理30 min,获得含抗菌肽的复合凝聚微胶囊芯材。
1.3.1.2 复合壁材溶液的制备
将适当比例氨基-β-环糊精、阿拉伯胶按照一定比例混合后倒入200 mL蒸馏水中,45 ℃气浴恒温摇床(水浴锅)中加热搅拌至溶解以形成复合凝聚微胶囊壁材。
1.3.1.3 复合凝聚微胶囊的制备[12-13]
取100 g壁材溶液置于高速匀浆机中,以2 000 r/min速度高速搅拌10 min后缓慢滴入复合凝聚微胶囊芯材溶液,并提高转速至10 000 r/min进行分散处理。5min后将混合液转移到高压均质机中进行二次混合处理,处理条件:30 MPa下10 min,49 MPa下5 min,获得分散均一的微胶囊预备液。利用1 mol/L HCl溶液将体系调至pH 4.5左右后继续反应10 min,降温至15 ℃以下并用0.2 mol/L NaOH溶液调节pH 6.0进行固化处理。将所制备的复合凝聚微胶囊分散液静置20~24 h后,弃去上清液得到微胶囊湿囊,并利用离心喷雾干燥得到试验所需的复合凝聚微胶囊[14]。喷雾干燥的条件设置为:进料流速500 mL/h,进风口、出风口温度分别为180 ℃和80 ℃[15-16]。
1.3.2 微囊包埋率测定[17]
从泉州志愿服务开展的情况看,大部分志愿活动是由政府部分机构组织的,志愿者也是由政府机关工作人员组成。政府主导和行政推动的方式虽然有利于启动志愿服务活动,但过分依靠行政推动往往会出现“被志愿”或志愿服务形式化或运动化的问题。[7]由于长期的行政化主导,一方面让民众产生误解,以为志愿服务是政府行为;一方面很容易形成运动式,出现形式化的问题;一方面“被志愿”者在心理上对志愿服务活动会产生抵触情绪。
通过索氏提取法测定总油含量。准确称取2.0 g微囊固体M0,用9 cm滤纸进行包裹,研磨使其充分粉碎,称取质量为M1,将包裹后的样品用石油醚进行索氏提取,8 h后80 ℃烘干得到质量M2。总油含量按式(1)计算。

表面油含量测定:准确称取2 g粉体M0加入45 mL石油醚,轻摇1 min抽滤,洗涤漏斗,抽滤,将抽滤后的液体烘干,称取质量M1。表面油含量按式(2)计算,包埋率按式(3)计算。

1.3.3 微胶囊粒径测定
利用激光粒度仪来测定微胶囊的粒径大小并表征其粒径分布。将微胶囊分散在适量去离子水中制成悬浮液,超声处理30 s后,在激光粒度仪上进行粒径的测定。
1.3.4 微胶囊形貌表征
从微观层面表征微胶囊的结构,采用加速电压5 keV的JEOL JSM-6700F场发射扫描电子显微镜进行测试(测试前对样品作喷金处理)。
1.3.5 微胶囊红外表征
傅里叶变换红外光谱被用来检测形成微胶囊后阿拉伯胶、氨基-β-环糊精、维生素E特征官能团的变化情况,从侧面验证所制备微胶囊对芯材的包埋情况。
1.3.6 复合凝聚微胶囊的体外释放试验及抗菌肽活性验证
模拟人的胃液,以此为模型,以释放出来的维生素E含量和抗菌肽为指标,测试成分含量变化。
2 结果与讨论
2.1 微胶囊制备工艺优化
复合凝聚微胶囊制备过程中,以维生素E包埋率为指标,依次以氨基-β-环糊精与阿拉伯胶比例(3∶1,5∶1,7∶1,9∶1和11∶1)、吐温80添加量(0.5%,1.0%,1.5%,2.0%和2.5%)、芯材添加量(25%,35%,45%,55%和65%)和抗菌肽添加量(0.5%,1.0%,1.5%,2.0%和2.5%)作为变量,进行单因素试验,从而分析各因素对微囊包埋率影响。
从图1(a)可知:氨基-β-环糊精和阿拉伯胶之间的配比直接影响维生素E油的包埋效果,二者比例为5∶1时,包埋率达到最高值,表明在该比例下氨基-β-环糊精和阿拉伯胶之间可形成稳定的阴阳离子配对体系,包埋率达到最大值[18];但随着氨基-β-环糊精比例逐步增加,因环糊精间静电斥力及空间位阻的存在,破坏原本稳定的阴阳离子配对体系的稳定性,最终导致微胶囊因壁材体系的不稳定产生包埋率下降的问题[19]。
由图1(b)可以看出:相对于氨基-β-环糊精和阿拉伯胶比例而言,吐温80添加量对包埋效果来说,影响相对较小。随着吐温80添加量逐步增加,包埋效果并没有发生很大的变化;微胶囊的包埋率在吐温80添加量1.5%时达到最大,吐温80添加量增加至2.0%和2.5%时,微胶囊包埋率下降。产生这种现象的原因是吐温80的加入仅对乳化效果产生影响,对包埋率的影响微乎其微,但随着添加量逐渐增加,因壁材在总体系中所占比例逐步下降,造成微胶囊“漏油”现象的出现,使包埋率呈现下降趋势。因此,选取添加量1.5%作为微胶囊制备的最佳乳化剂使用量。
作为试验的主承载体,芯材添加量的变化对包埋效果的影响较大,随着芯材添加量增加,包埋效果呈现先升高后下降趋势,芯材添加量35%时,包埋率达到最大值,如图1(c)所示。但随着芯材添加量再度增加,因壁材在体系中比例逐步下降,使复合凝聚反应所形成的囊壁越来越薄,微胶囊力学性能大幅降低。由此可知,在微胶囊制备过程中,芯材添加量设定35%时,达到最大包埋率(83.2%),包埋效果最好。
众多抗菌肽微胶囊研究中表明,抗菌肽的浓度直接关系到该微胶囊的实际应用效果。据相关文献报道,抗菌肽虽然具有很强的抵抗病毒或真菌、抑制或杀伤肿瘤细胞等功能,但其在人体的吸收量相对较少。因此分别选取0.5%,1.0%,1.5%,2.0%和2.5%作为抗菌肽的添加量,并研究不同添加量对微胶囊包埋率的影响情况。从图1(d)中可以看出,抗菌肽添加量对微胶囊包埋率的影响总体呈现先增加后减小趋势(添加量1.5%时,包埋率最高可达81.5%),但相对于壁材配比、芯材添加量而言,抗菌肽添加量对微胶囊包埋率的影响总体偏小。

图1 氨基-β-环糊精和阿拉伯胶比例(a)、吐温80用量(b)、芯材用量(c)、抗菌肽添加量(d)对包埋率的影响
2.2 微胶囊粒径分析及形貌表征
微胶囊的微观结构、粒径大小对其稳定性、机械性能和粉体特性具有不同程度的影响。试验用激光粒度分析仪测量、表征微胶囊的粒径大小和分布,用扫描电镜来表征微胶囊的微观形态(图2)。由图2(a)可知,所制备微胶囊的平均粒径为2.823±0.11 μm,处于亚微囊区域,PDI为0.322,粒径分布集中且正态分布良好,表明所制备的微胶囊大小均一、分散性良好[20]。由图2(b)可以看出所制备微胶囊为表面规则,无裂纹的球体颗粒,表面无撕裂迹象[21]。但喷雾干燥过程中,高温、高压的制备条件易对一些囊壁薄的颗粒产生不利影响,最终导致胶囊破裂现象的出现,如图2(c)所示。破裂微胶囊内部存在空穴,囊壁具有一定的厚度且结构致密。这表明氨基-β-环糊精和阿拉伯胶通过复合凝聚体系所形成的微胶囊壁可将芯材完美的包埋于其中,保证所制备微胶囊的高包埋率。
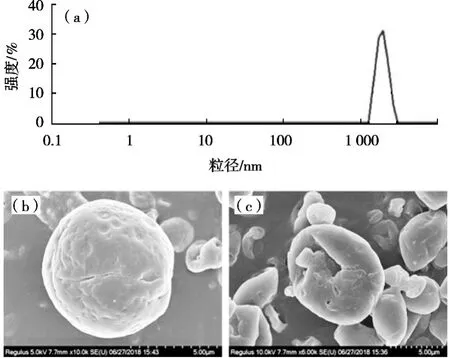
图2 微胶囊粒径及形貌表征图
2.3 红外光谱表征
氨基-β-环糊精因特有的疏水性空腔结构,使其能够将脂溶性物质包埋在空腔内部形成具有相对稳定结构的微胶囊体系。包埋过程中,由于疏水作用、静电相互作用等非共价键的存在,使原料活性官能团的红外特征峰发生不同程度变化。由图3可知,阿拉伯胶的特征吸收峰中1 758 cm-1代表羰基伸缩振动峰、1 573 cm-1代表芳香环骨架振动峰;氨基-β-环糊精中3 324 cm-1代表氨基伸缩振动峰;维生素E的特征吸收峰主要包括甲基不对称伸缩振动峰(2 954 cm-1)、羰基伸缩振动峰(1 761 cm-1)、甲基弯曲振动峰(1 368 cm-1)及C—O—C反对称伸缩振动峰(1 208 cm-1)[20]。由图3(d)所示,在形成复合凝聚微胶囊后,阿拉伯胶、氨基-β-环糊精及维生素E的特征峰呈现出不同程度的强度变化。其中,以维生素E的变化最大:位于2 954 cm-1、1 761 cm-1的特征峰完全消失、1 368 cm-1和1 208 cm-1处特征峰变小,表明维生素E被有效的包埋于氨基-β-环糊精和阿拉伯胶所形成的微胶囊中。
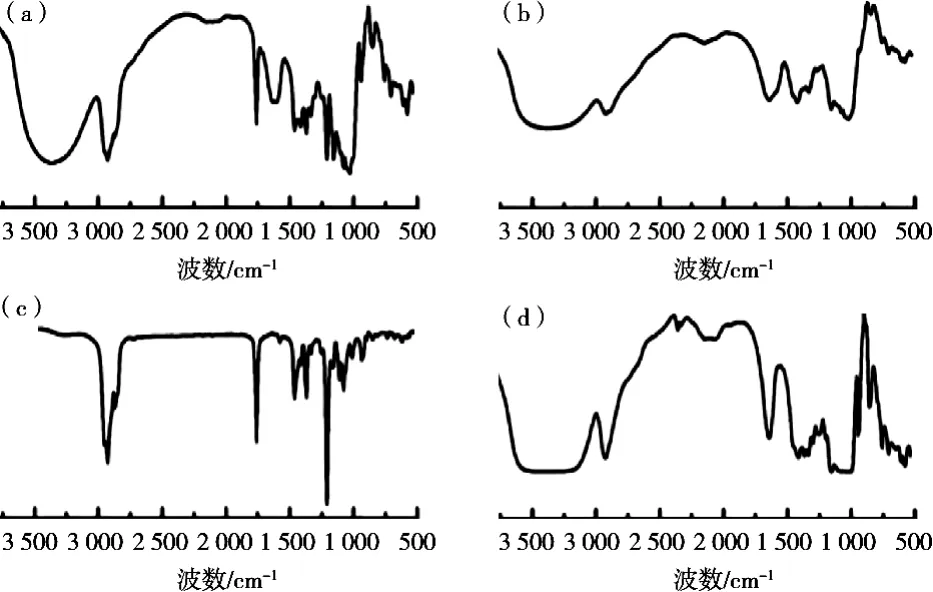
图3 阿拉伯胶(a)、氨基-β-环糊精(b)、维生素E(c)、微胶囊(d)的红外光谱图
2.4 微胶囊稳定性研究
理想的微胶囊是保护芯材中的活性物质不受体内酶的破坏,并保证其可在体内缓慢释放被人体所吸收。因此,微胶囊在模拟胃液中的稳定性是保证微胶囊对活性物质具有保护作用的重要指标。从经模拟胃液对微胶囊进行消化处理后的维生素E释放情况和抗菌肽活性2个方面对微胶囊稳定性进行研究。
如图4所示,在模拟人体胃液的环境中,通过复合凝聚法制得的微胶囊缓释性比简单的物理共混具有显著提高。结果表明,4 h后微胶囊中维生素E的释放率仅34%,而物理共混的释放率达92%,直到18 h后微胶囊体系内维生素E才达到完全释放。这意味着经微囊化处理的维生素E具有抵抗外部因素影响的能力,产品稳定性得以提高,且缓释效果显著,可达到在体内缓慢释放的功效[22]。

图4 不同混合方式的维生素E在模拟胃液释放率
由大肠杆菌抑制性结果来看,如图5所示,基于复合凝胶体系所制备的微胶囊对于活性成分抗菌肽具有很高的保护性,导致微胶囊在抗菌性上明显低于未被微囊包裹的抗菌肽。据相关文献报道,阻碍人体吸收抗菌肽类物质的主要障碍为蛋白酶对其的水解作用,因此进一步研究微胶囊的蛋白酶耐受性来验证所制备微胶囊的稳定性[23]。从蛋白酶的耐受性来看,微胶囊化后的抗菌肽耐受性相比于常规抗菌肽提高73%,意味着抗菌肽已经成功包埋于壁材或者内腔中,使抗菌肽的蛋白酶耐受性大幅提升。总的来说,利用复合凝聚微胶囊技术对抗菌肽进行包埋,虽然一定程度上抑制其抗菌活性,但这种影响相比于对抑制蛋白酶降解来讲可忽略不计。
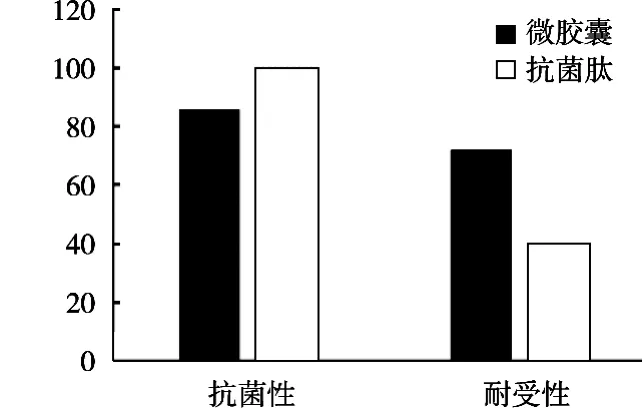
图5 不同制备方式的抗菌肽抑菌性和耐受性比较
3 结论
试验利用复合凝聚微胶囊体系对维生素E/抗菌肽进行稳定性包埋处理,单因素试验结果表明,所制备的微胶囊在氨基-β-环糊精和阿拉伯胶添加比例5∶1、吐温80添加量1.5%、芯材添加量35%,芯材中抗菌肽添加量1.5%时包埋率达到最大,包埋效果显著。红外光谱结果表明氨基-β-环糊精和阿拉伯胶间通过静电相互作用、疏水作用等非共价键间所形成的壁材可有效实现芯材包埋;粒径分布及扫描电镜结果表明所制备微胶囊平均粒径为2.823±0.11 μm,分布集中且正态分布良好;稳定性试验表明4 h后微胶囊芯材释放率仅34%,18 h后芯材可完全释放;抗菌肽活性验证结果表明经微胶囊化处理后的抗菌肽相比于未处理的抗菌肽,在耐受性有所提升,而抗菌活性有所抑制,但影响较小。由此可知,通过微胶囊化处理后的维生素E/抗菌肽完全可以满足当前对于维生素E和抗菌肽等活性物质体内缓释需求,在食品、医药等领域具有巨大应用潜力。
