盐酸头孢噻呋无菌检查方法的建立
2021-11-25刘霄飞徐恩民冯修光章安源
刘霄飞,徐恩民*,张 琦,冯修光,郭 腾,章安源,王 燕
(1.山东省畜产品质量安全中心,济南 250102;2.山东省饲料兽药检测中心,济南 250102)
盐酸头孢噻呋,别名头孢噻呋盐酸盐,盐酸头孢替呋,头孢替呋盐酸盐,属于第三代头孢菌素类抗生素。头孢噻呋作为第一个专门用于动物的第三代头孢菌素类抗生素,因其具备抗菌活性强,β-内酰胺环稳定性好,毒副作用小,残留量低,不易产生耐药性或交叉耐药性等优点,其制剂在兽医临床上被广泛应用于防治猪、牛、羊及雏鸡的呼吸系统等疾病[1-3]。盐酸头孢噻呋在《中华人民共和国兽药典》尚未收载,其无菌检查的方法也未见报道。目前国内检测标准有农业部865号公告和1140号公告,且两个公告的检测对象为非无菌原料,均没有无菌检查项目。盐酸头孢噻呋无菌原料供无菌制剂使用时,存在一定的安全隐患。为了更好的对该无菌原料进行安全性评价和质量控制,确保其无菌制剂临床用药的安全性,本试验对盐酸头孢噻呋无菌原料的无菌检查方法进行研究,建立可靠的无菌检查方法并进行方法适用性试验。
1 材料与方法
1.1 材料
1.1.1 仪器设备 SHP150型生化培养箱(上海精宏试验设备有限公司);KB240型生化培养箱(德国BINDER);BT125D型电子天平(德国赛多利斯科学仪器有限公司);HTY-APL01型集菌仪(浙江泰林生物技术股份有限公司);HG-50型全自动灭菌锅(HIRAYAMA株式会社);KDGB330型全封闭无菌过滤培养器(浙江泰林生物技术股份有限公司)。
1.1.2 供试品 盐酸头孢噻呋无菌原料分别由艾美科健生物医药有限公司(批号:PS077-1802001);齐鲁晟华制药有限公司(批号:80671025A)。
1.1.3 试验菌种 金黄色葡萄球菌[CMCC(B)26003]、大肠埃希菌[CMCC(B)44102]、铜绿假单胞菌[CMCC(B)10104]、枯草芽孢杆菌[CMCC(B)63501]、生孢梭菌[CMCC(B)64941]、白色念珠菌[CMCC(B)98001]和黑曲霉[CMCC(B)98003],均购自中国食品药品检定研究院。
1.1.4 培养基与试剂 硫乙醇酸盐流体培养基(批号:180830)、胰酪大豆胨液体培养基(批号:180820)、胰酪大豆胨琼脂培养基(批号:180820)、沙氏葡萄糖液体培养基(批号:180731)、沙氏葡萄糖琼脂培养基(批号:180912)、0.85%无菌氯化钠溶液(批号:180226)和pH 7.0氯化钠-蛋白胨缓冲液(批号:180820),均购自北京陆桥技术股份有限公司。无水碳酸钠(批号:20180125)购自国药集团化学试剂有限公司。头孢菌素酶(β-内酰胺酶Ⅱ,规格:不少于200万单位/支,批号:7041837D)购自杭州北望生物科技有限公司。
1.2 方法
1.2.1 菌液制备 首先将试验所需的7种菌分别进行复苏复壮。再将金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、大肠埃希菌的新鲜培养物接种至胰酪大豆胨液体培养基中,将生孢梭菌的新鲜培养物接种至硫乙醇酸盐流体培养基中,30~35 ℃培养18~24 h;将白色念珠菌的新鲜培养物接种至沙氏葡萄糖液体培养基中,20~25 ℃培养24~48 h;将黑曲霉菌的新鲜培养物接种至沙氏葡萄糖琼脂斜面培养基上,20~25 ℃培养5~7 d,再加入3~5 mL含0.05%(mL/mL)聚山梨酯80的 0.85%无菌氯化钠溶液,将孢子洗脱,制成孢子悬液。上述培养物和孢子悬液均用0.85%无菌氯化钠溶液10倍稀释制成每1 mL含活菌数/孢子数<100 CFU的菌悬液,培养后活菌计数。
1.2.2 培养基适用性检查
1.2.2.1 培养基无菌性检查 随机取硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基各5支,置规定的温度下培养14 d。
1.2.2.2 培养基灵敏度检查 取每管装量为12 mL的硫乙醇酸盐流体培养基7支,分别接种<100 CFU的金黄色葡萄球菌、铜绿假单包菌、生孢梭菌各2支,另1支不接种作为空白对照,培养3 d;取每管装量为9 mL的胰酪大豆胨液体培养基7支,分别接种<100 CFU的枯草芽孢杆菌、白色念珠菌、黑曲霉各2支,另1支不接种作为空白对照,培养5 d。
1.2.3 供试品前处理 取供试品500 mg,加10 mL 2.6%无菌碳酸钠溶液使溶解,再转移至490 mL 0.85%无菌氯化钠溶液中,作为供试液过滤。
1.2.4 冲洗总量的考察 选择常用的pH 7.0无菌氯化钠-蛋白胨缓冲液为冲洗液,分别对供试品进行300、400、500 mL/膜的冲洗后,加入<100 CFU的金黄色葡萄球菌,30~35 ℃条件下培养24 h。
1.2.5 无菌检查法适用性试验(薄膜过滤法)
1.2.5.1 供试品阳性菌试验组 用建立的方法对供试品进行操作,在最后一次冲洗液中分别加入<100 CFU的菌液,过滤后,每个滤筒内灌注培养基,其中金黄色葡萄球菌、大肠埃希菌、生孢梭菌在硫乙醇酸盐流体培养基中,30~35 ℃条件下培养5 d,枯草芽孢杆菌、白色念珠菌、黑曲霉在胰酪大豆胨液体培养基中,20~25 ℃条件下培养5 d,各2组。
1.2.5.2 阳性菌对照组 取6个无菌封闭式滤筒,其中3个滤筒加入硫乙醇酸盐流体培养基,分别接种<100 CFU的金黄色葡萄球菌、大肠埃希菌、生孢梭菌,30~35 ℃条件下培养5 d;另3个滤筒加入胰酪大豆胨液体培养基,分别接种<100 CFU的枯草芽孢杆菌、白色念珠菌、黑曲霉,20~25 ℃条件下培养5 d。
1.2.5.3 供试品组 取供试品,除不加阳性菌外,与供试品阳性菌试验组同法处理。再分别加入硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基,置规定温度下培养5 d。
1.2.5.4 阴性对照组 取2个无菌封闭式滤筒,用0.85%无菌氯化钠溶液和pH 7.0无菌氯化钠-蛋白胨缓冲液冲洗,冲洗次数与冲洗量与试验组相同,向滤筒中分别加入硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基,置规定温度下培养5 d。
1.2.6 加酶与否的考察 与1.2.5.1项和1.2.5.3项同法操作,并在每筒培养基内加入一支用1 mL 0.85%无菌氯化钠溶液溶解的头孢菌素酶溶液进行考察。
2 结果与分析
2.1 活菌计数 活菌计数结果见表1。由表1可知,经倍比稀释后,7种菌的菌悬液活菌计数结果均符合要求,可作为试验菌液。
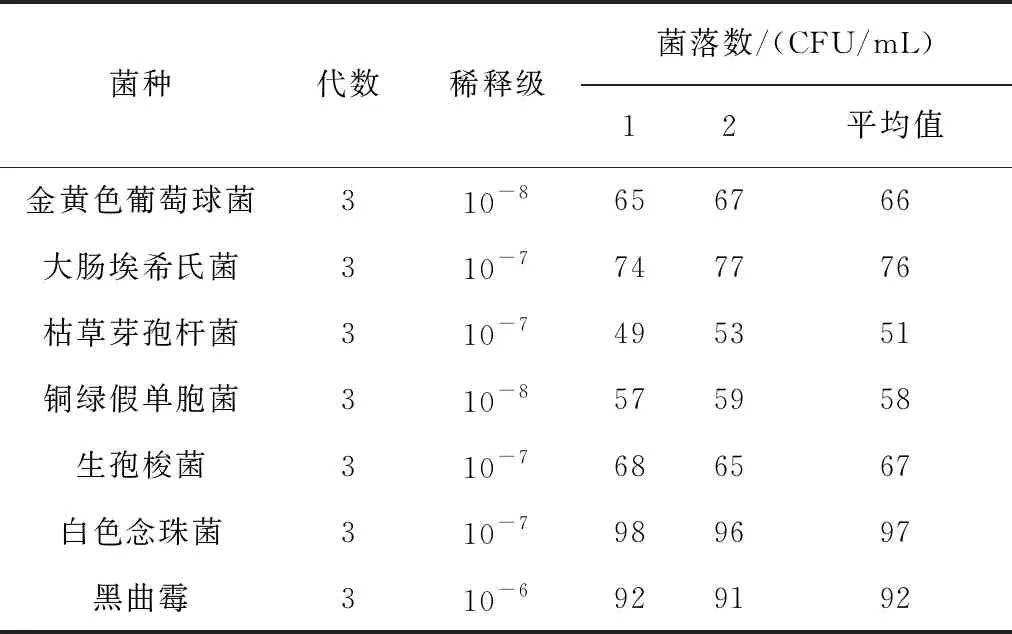
表1 活菌计数结果
2.2 培养基适用性检查
2.2.1 培养基无菌性检查 经培养,硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基均无菌生长,表明这两种培养基的无菌性检查符合要求。
2.2.2 培养基灵敏度检查 培养基灵敏度检查结果见表2。由表2可知,各试验菌株在对应的硫乙醇酸盐流体培养基和胰酪大豆胨液体培养基中,经特定的时间培养后均生长良好,空白对照管无菌生长,表明这两种培养基的灵敏度符合要求。

表2 培养基灵敏度检查结果
2.3 冲洗总量 试验结果见表3。由表3可知,300、400 mL/膜的冲洗筒,菌虽然生长,但较阳性对照筒生长得弱一些,500 mL/膜冲洗筒,菌生长良好,与阳性对照筒生长情况相同,表明供试品抑菌作用完全消除。因此,确定冲洗总量为500 mL/膜(每张滤膜每次冲洗量为100 mL,冲洗5次)。

表3 冲洗总量考察结果
2.4 方法适用性试验 方法适用性试验结果见表4、表5,由表4、表5可知,6种试验菌株均生长良好,表明该试验方法能有效消除盐酸头孢噻呋对各试验菌株的影响。
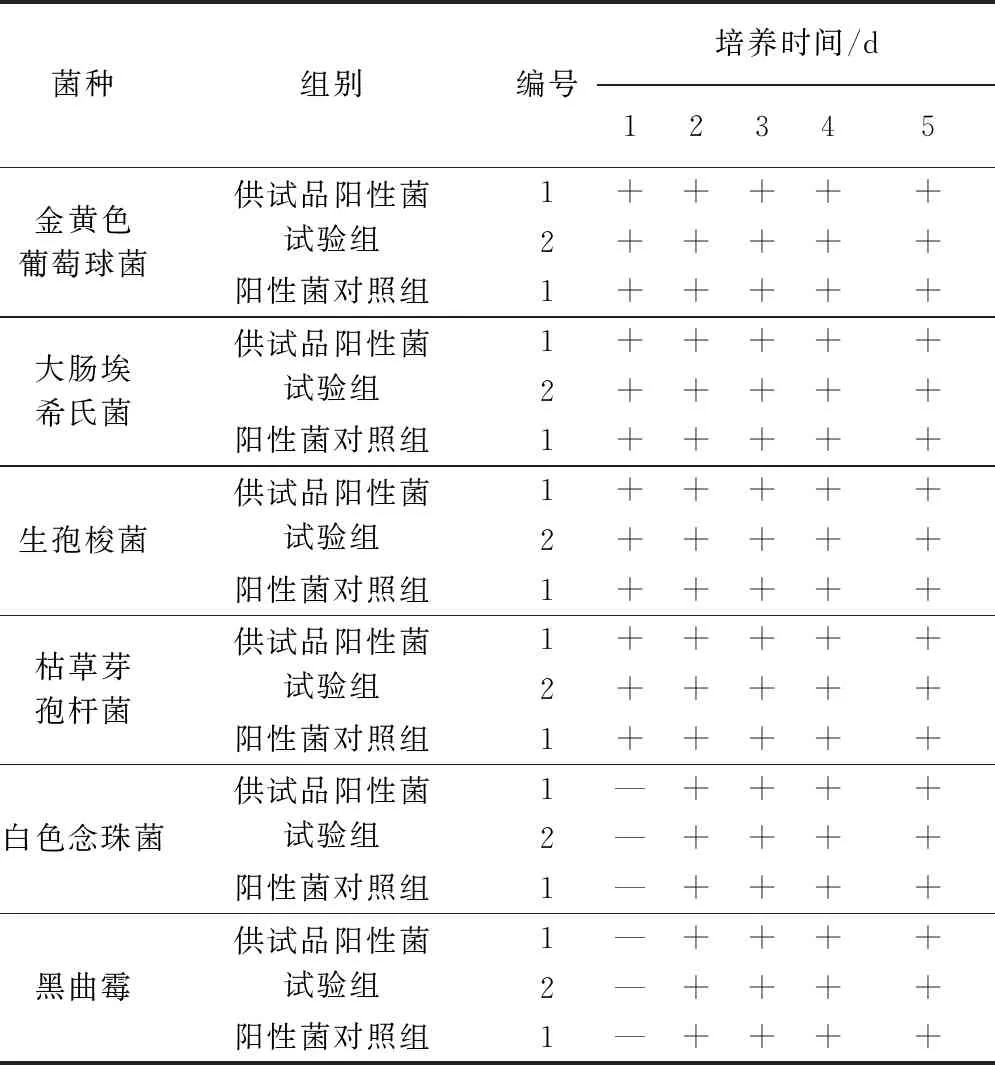
表4 方法适用性试验结果(供试品阳性菌试验组与阳性菌对照组)

表5 方法适用性试验结果(供试品组与阴性菌对照组)
2.5 加酶与否 通过加酶与否考察试验得出,加头孢菌素酶与不加头孢菌素酶,对试验结果没有影响,说明供试品经500 mL/膜pH 7.0无菌氯化钠-蛋白胨缓冲液充分冲洗后,可完全消除供试品自身的抑菌作用,不需另加头孢菌素酶来中和供试品的抑菌活性。
2.6 供试品无菌检查 分别取两个厂家的供试品,按照验证过的无菌检查方法进行检查。结果显示,阳性对照菌在24 h内均生长良好,阴性对照14 d内均澄清,无菌生长,供试品14 d内澄清,无菌生长,无菌检查结果符合规定。
3 讨论与结论
3.1 供试品的取样量及溶解介质 盐酸头孢噻呋不溶于水,由其分子式可知盐酸头孢噻呋在水中显酸性,经试验验证能够在碳酸钠溶液、氢氧化钠溶液中溶解[4]。考虑到溶解介质对微生物的影响并借鉴头孢噻呋的无菌检查方法[5],本试验选用2.6%无菌碳酸钠溶液作为溶解介质。供试品取样量依据无菌检查法供试品的最少检验量[5]的要求,选择了最少检验量500 mg,通过逐步增加溶解介质观察供试品溶解情况的方法,最终确定500 mg的供试品在10 mL 2.6%无菌碳酸钠溶液中完全溶解。
3.2 冲洗液的用量 无菌检查常见方法有直接接种法和薄膜过滤法,只要供试品性质允许,应采用薄膜过滤法[5]。薄膜过滤法是各国药典收载的无菌检查的首选方法,该方法具有操作简便、结果准确等优点[6]。薄膜过滤法每张滤膜总冲洗量不得超过1000 mL,以免滤膜上的微生物受损伤[5];一般要求固体供试品溶解后转移至不少于500 mL的0.9%无菌氯化钠溶液进行稀释后再过滤,因此,冲洗液的用量不能超过500 mL,使总过滤量不超过1000 mL,以保证微生物检出不受影响。
3.3 β-内酰胺酶的使用 盐酸头孢噻呋属于β-内酰胺类抗生素,具有很强的抑菌作用[7],具有抑菌活性的供试品无菌检查时可以加入中和剂或灭活剂来消除供试品的抑菌活性[8],本试验对加β-内酰胺酶与不加β-内酰胺酶两种方法做了比较,发现供试品经500 mL/膜pH 7.0无菌氯化钠-蛋白胨缓冲液充分冲洗后,可完全消除供试品自身的抑菌作用,不需要另加β-内酰胺酶中和,大大降低了试验成本,简化了试验步骤。
本试验成功建立了盐酸头孢噻呋无菌原料的无菌检查方法。在该无菌检查条件下可有效清除药物自身的抑菌活性,提高了检测效率,降低了检测成本,为该无菌原料的安全性评价和质量控制提供了科学、可靠的技术支持。
