两种碳酸系Fe-LDHs负载改性沸石对Cd(Ⅱ)吸附特性对比研究
2021-11-25胡美艳张翔凌姬筠森窦琰开夏世斌
胡美艳, 张翔凌*, 姬筠森, 薛 钰, 窦琰开, 金 溪, 夏世斌
1.武汉理工大学土木工程与建筑学院, 湖北 武汉 430070
2.武汉理工大学资源与环境工程学院, 湖北 武汉 430070
重金属镉(Cd)严重危害生态环境和人类健康[1],有资料[2]显示,我国土壤环境中Cd的点位超标率高达7.0%,在8种无机污染物中最高. 重金属Cd排入水体难以收集、回收和去除,并易通过食物链富集[3],破坏人体造血系统、生殖系统和免疫系统[4-5]. 目前,去除水中重金属Cd的常用方法包括生物处理、电化学处理、混凝及膜分离等[6],但均存在成本高、效率低等问题[7];吸附法被认为是处理含Cd(Ⅱ) 废水最佳的方法之一,可使用廉价合成或天然材料作为吸附剂[8]. 其中,天然沸石具有良好的离子交换性能,但吸附容量偏小、易饱和等缺点[9]限制了其应用范围.
新型功能材料层状双金属氢氧化物(layered double hydroxides, LDHs)也被称为水滑石或类水滑石,兼具比表面积大、离子交换能力强等特点,可用作电极表面改性剂、保护涂层、催化剂和吸附剂[10]. 已有研究表明LDHs的Cd(Ⅱ)吸附性能优良,如黄祺祺[11]分别合成了磁性氧化石墨烯/水滑石(MGL)和四氧化三铁@氧化石墨烯/水滑石用于吸附重金属离子,发现用量0.07 g、振荡时间240 min、pH为5.85时MGL对Cd(Ⅱ)最大吸附量为45.05 mg/g;Mallakpour等[12]使用超声波辅助共沉淀技术制备MgAl-LDHs原位生长于多壁碳纳米管表面,并添加表面活性剂R-PET形成新的复合材料,对Cd(Ⅱ)最大吸附容量为38.91 mg/g. 但LDHs多以纳米晶体形态存在,运用于实际工程存在难以固液分离和回收等问题.
笔者所在课题组前期曾尝试将LDHs负载于沸石表面,以解决天然沸石易吸附饱和的问题,发现氯系LDHs改性沸石对Cd(Ⅱ)的去除效果良好[13-15]. 由于碳酸根是自然界中LDHs最常见的层间阴离子,LDHs的双金属层板对其亲和力较氯离子更强,因此理论上碳酸系LDHs改性沸石对Cd(Ⅱ)的吸附应更具优势,且在制备及应用时不受环境中CO2的影响. 虽已有学者对纯CO3-LDHs的Cd(Ⅱ)吸附性能开展研究[16],但将其负载于沸石以提升Cd(Ⅱ)的吸附容量,及其结构中不同二价金属离子对改性沸石吸附Cd(Ⅱ)的影响研究尚鲜见报道;另外,三价铁化合物廉价易得,且与所选两种二价金属离子半径相近,所制备LDHs的结构应更为稳固,因此该研究拟采用碳酸系Fe-LDHs负载于原始沸石表面,对比ZnFe-LDHs负载改性沸石(ZFLZ)、MgFe-LDHs负载改性沸石(MFLZ)和原始沸石(OZ)对Cd(Ⅱ)的吸附效果,研究不同温度和吸附时间对改性沸石吸附Cd(Ⅱ)的影响,揭示两种改性沸石对Cd(Ⅱ)吸附机理的差异,以期为筛选适合的LDHs负载方式用于改性填料的高效除Cd提供理论依据.
1 材料与方法
1.1 试验材料
试验所用天然沸石:粒径2~4 mm,表观密度2.089 g/cm3,空隙率50.5%. 改性所用试剂为硝酸锌、硝酸铁、硝酸镁、氢氧化钠和碳酸钠;检测所用试剂为浓硫酸、碘化钾、抗坏血酸、聚乙烯醇-1750、罗丹明B、硫酸镉;上述试剂均购自国药集团化学试剂有限公司. Cd(Ⅱ)标准溶液和检测试剂采用超纯水配制.
1.2 Fe-LDHs负载改性沸石的制备
采用水浴-共沉淀法制备两种碳酸型Fe-LDHs负载改性沸石. 以MFLZ为例:称取800 g OZ于1 L烧杯并放入80 ℃恒温水浴锅;将2 mol/L硝酸镁溶液和1 mol/L硝酸铁溶液各200 mL加入烧杯搅拌均匀;投加25% NaOH和0.5 mol/L Na2CO3混合溶液,调节pH稳定在11.0±0.5左右,持续搅拌2 h后置于干燥箱陈化24 h;去离子水多次洗涤后干燥即得到MFLZ. ZFLZ制备过程同上.
1.3 原始及改性沸石的表征
采用场发射扫描电子显微镜(Zeiss Ultra Plus, 德国卡尔蔡司股份公司)对改性前后沸石表面形貌进行表征;采用能谱分析仪(JEM-2100F, 日本电子株式会社)对元素组成进行定量分析;采用X射线衍射仪(D8 Advance, 德国布鲁克公司)分析纯MgFe-LDHs、吸附Cd(Ⅱ)前后MFLZ和OZ的晶体类型及其结构特征;采用傅里叶红外光谱仪(Nicolet6700, 美国赛默飞世尔科技公司)检测吸附Cd(Ⅱ)前后MFLZ和OZ的官能团种类变化.
1.4 等温吸附试验
分别称取1 g某种沸石于不同具塞锥形瓶,配制浓度梯度为0、0.1、1.0、4.0、8.0、16.0、32.0 mg/L的Cd(Ⅱ)溶液各100 mL加入上述锥形瓶,置于温度288 K、转速160 r/min恒温水浴振荡器振荡24 h后测定Cd(Ⅱ)浓度. 另外,同步检测吸附试验前后溶液的pH.
Cd(Ⅱ)浓度的检测方法:采用分光光度法[17]在最大吸收波长600 nm时进行测定.
1.5 解吸附试验
初始Cd(Ⅱ)浓度为8 mg/L的等温吸附试验结束后,用去离子水洗涤沸石表面附着Cd(Ⅱ),重新加入0.5 mol/L的NaCl解吸液100 mL,置于温度288 K、转速160 r/min恒温水浴振荡器振荡6 h后测定Cd(Ⅱ) 浓度.
1.6 吸附动力学与吸附热力学试验
吸附动力学试验:分别称取1 g某种沸石于不同具塞锥形瓶;各加入8 mg/L的Cd(Ⅱ)溶液100 mL,置于温度288 K、转速160 r/min恒温水浴振荡器振荡;设定5、10、15、30、45、60、120、240、360、480、720、960、1 200、1 440 min等不同时间点取出测定 Cd(Ⅱ)浓度.
吸附热力学试验;除将恒温水浴振荡器温度分别设定为288、298、308、318 K外,其他步骤同1.4节等温吸附试验.
1.7 竞争离子吸附影响试验
称取MFLZ各1 g于不同具塞锥形瓶,分别加入16 mg/L的Cd(Ⅱ)溶液和某种竞争离子(Mg2+、K+、NH4+、NO3-、HPO42-)溶液各50 mL,置于温度288 K、转速160 r/min恒温水浴振荡器振荡24 h后测定Cd(Ⅱ) 浓度.
1.8 pH吸附影响试验
称取MFLZ和OZ各1 g于不同具塞锥形瓶,分别加入8 mg/L的Cd(Ⅱ)溶液(pH为3、4、5、6、7、8、9、10)100 mL,置于温度288 K、转速160 r/min恒温水浴振荡器振荡24 h后测定Cd(Ⅱ)浓度.
2 结果与讨论
2.1 不同沸石的表观特征及化学成分变化
由图1可见,改性前后沸石表面存在较为明显的差异. OZ表面附着凹凸不平的颗粒,存在大量孔隙;ZFLZ表面更为平整;MFLZ相较OZ有较为明显的结晶体附着,出现排列规律的层状物,这与郭效军等[18]制备的MgFe-LDHs粉末表观特征相似. 这说明经Fe-LDHs 负载改性,沸石表面发生变化,且不同金属合成的LDHs对改性沸石形貌特征产生了不同影响.

图1 ZFLZ、MFLZ和OZ的SEM图
由图2可知,相较于OZ,ZFLZ和MFLZ中的Zn和Mg元素均分别从无到有. 这说明将Fe-LDHs负载于沸石表面,不仅使沸石的化学成分新增了对应特定元素,而且不同改性方式也使沸石的元素含量有所不同.

图2 ZFLZ、MFLZ与OZ的EDS图谱
分别对纯MgFe-LDHs、MFLZ和OZ进行XRD分析,结果如图3所示. 由图3可见,纯MgFe-LDHs的图谱在11°、23°、35°、39°、47°、60°和62°处有7个衍射峰,分别对应LDHs的典型特征衍射峰(003)(006)(012)(015)(018)(110)和(113)[19]. 而MFLZ图谱中,除具有OZ图谱的特征峰外,对应新增了上述7个减弱的纯MgFe-LDHs特征峰,证明该试验的改性方式成功合成了LDHs并有效负载于沸石表面.

图3 纯MgFe-LDHs、MFLZ和OZ的XRD图谱
2.2 等温吸附试验
分别采用Langmuir、Freundlich和Temkin等温吸附模型〔见式(2)~(4)〕对试验结果进行拟合.
qe=(C0-Ce)V/m
(1)
(2)
(3)
qe=BlnCe+BlnA
(4)
式中:Ce为吸附平衡时Cd(Ⅱ)浓度,mg/L;C0为初始Cd(Ⅱ)浓度,mg/L;qe为平衡吸附量,mg/kg;V为溶液体积,L;m为填料质量,g;qm为理论最大饱和吸附容量,mg/kg;KL为Langmuir等温吸附模型平衡常数;1/n为非线性系数;KF为Freundlich等温吸附模型常数,L/kg;B=R′T/b,其中b为Temkin等温吸附模型常数(kJ/mol),R′为通用气体常数,取值为 8.314 J/(mol·K),T为热力学温度(K);A为平衡结合常数.
不同初始Cd(Ⅱ)浓度下ZFLZ、MFLZ和OZ对Cd(Ⅱ)的平衡吸附量如图4所示,ZFLZ、MFLZ和OZ的等温吸附模型拟合结果如表1所示. 由图4和表1可见:不同初始Cd(Ⅱ)浓度下MFLZ对Cd(Ⅱ)的平衡吸附量均大于ZFLZ和OZ,其吸附效果更优;MFLZ和ZFLZ的Langmuir等温吸附模型拟合参数R2更高,均在0.980 0以上,OZ的Freundlich等温吸附模型拟合参数R2更高,说明改性沸石对Cd(Ⅱ)的吸附符合具有表面吸附位点均匀的单分子层吸附,而原始沸石趋于吸附力由内向外逐步降低的多分子层吸附,因而其对表层Cd(Ⅱ)的吸附力较低.
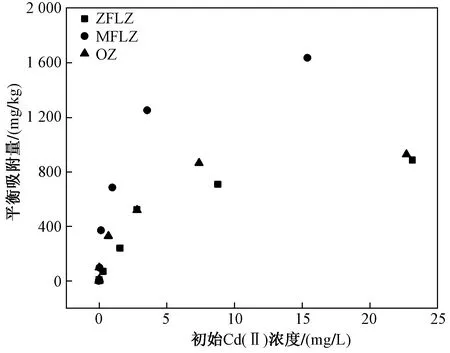
图4 不同初始Cd(Ⅱ)浓度下ZFLZ、MFLZ和OZ对Cd(Ⅱ)的平衡吸附量
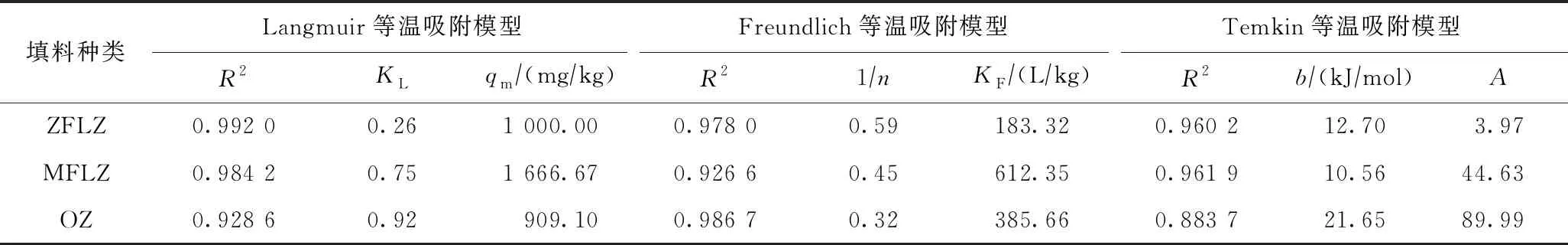
表1 ZFLZ、MFLZ和OZ的等温吸附模型拟合参数
两种改性沸石对Cd(Ⅱ)的理论最大饱和吸附容量较原始沸石均有一定幅度提升,尤其是MFLZ,其值为OZ的1.5倍以上,而ZFLZ提升效果不明显. 究其原因可能是: ① Mg2+的离子半径小于Zn2+,因而MgFe-LDHs层板上金属离子电荷密度更大,与层间CO32-、水分子、—OH的作用力更强[20],导致层板上Mg2+具有较高极化能,对层间吸引力更大而不易移位;②由于MgFe-LDHs结晶度高于ZnFe-LDHs[21],层板金属离子排列更有序,Cd(Ⅱ)进入层间阻力减小[22],同晶替代等层间反应易于进行,因此MFLZ表现出更好的Cd(Ⅱ)吸附效果. 另外,从KF值的大小对比也可发现,MFLZ的Cd(Ⅱ)吸附性能更优.
OZ、MFLZ和ZFLZ在初始Cd(Ⅱ)浓度为0 mg/L的等温吸附试验结束后,溶液中pH分别为7.80、9.71、9.44,而初始Cd(Ⅱ)浓度为8 mg/L等温吸附试验结束后,溶液中pH分别为7.48、8.11、8.03,说明Cd(Ⅱ)的加入使溶液pH下降. 这是由于表面带负电的沸石会吸引并结合水中H+至表面而排斥OH-,Cd(Ⅱ)与OH-结合生成Cd(OH)3-、Cd(OH)+等配合体,以及Cd(OH)2表面沉淀. 另外,OZ的pH变化不大,且pH<8时Cd(Ⅱ)在水中以二价离子形式存在,不参与上述化学反应. 这也进一步证实,FLZ对Cd(Ⅱ)以化学吸附为主,而OZ以物理吸附为主.
Temkin等温吸附模型描述的能量关系为吸附热随吸附量呈对数降低,仅适用于化学吸附. 如表1所示,MFLZ和ZFLZ的拟合度均高于OZ,间接说明MFLZ和ZFLZ对Cd(Ⅱ)的吸附更符合化学吸附特性. 有研究[23]表明,氢键在能量上的变化分为3个区间,即4.81~16.74 kJ/mol属于弱氢键、16.74~62.75 kJ/mol属于中等强度氢键、62.75~167.36 kJ/mol属于强氢键,而离子交换机制的典型键能范围为8~16 kJ/mol. 基于Temkin等温吸附模型所得吸附热值(见表1)可知,MFLZ和ZFLZ与Cd(Ⅱ)的作用力属于弱氢键和离子交换,OZ属于中等强度的氢键,即MFLZ和ZFLZ对Cd(Ⅱ)的吸附过程以离子交换和化学吸附为主.B与吸附潜能有关,其值越大吸附潜能越高;3种沸石B值大小表现为MFLZ(0.23)>ZFLZ(0.20)>OZ(0.11),表明MFLZ具有更高的吸附潜能.
2.3 吸附-再生试验
初始Cd(Ⅱ)浓度为8 mg/L的等温吸附试验结束后,对OZ、MFLZ和ZFLZ进行解吸附试验,计算其解吸率〔见式(5)〕.
(5)
式中:E为解吸率,%;Ce为吸附平衡时溶液Cd(Ⅱ)的浓度,mg/L;C1为解吸附试验后溶液中Cd(Ⅱ)的浓度,mg/L;Ve、V1分别为吸附液和解吸液的体积,L.
由图5可见,3次吸附-解吸附后,MFLZ、ZFLZ和OZ对Cd(Ⅱ)的平衡吸附量分别为644.01、507.50、455.45 mg/kg,其解吸率大小表现为OZ>MFLZ>ZFLZ,即OZ的解吸附能力高于MFLZ和ZFLZ. OZ对Cd(Ⅱ)主要通过物理吸附,活性点位被占据后则依靠静电吸附,因而更易被解吸附;MFLZ和ZFLZ对Cd(Ⅱ)以化学吸附为主,所吸附Cd(Ⅱ)更为稳固,难以被解吸附. MFLZ和ZFLZ解吸率存在差异的原因是,Zn2+离子半径大于Mg2+,Zn—OH键能较Mg—OH更高,结构单元也更牢固,因此所吸附Cd(Ⅱ)不易被解吸附[24].

图5 吸附-解吸附循环时ZFLZ、MFLZ和OZ对Cd(Ⅱ)的解吸率
2.4 吸附热力学试验
分别在288、298、308和318 K下进行等温吸附试验,对试验结果采用Langmuir等温吸附模型拟合并计算理论最大饱和吸附容量,结果如图6所示. 由图6 可见:不同反应温度下MFLZ对Cd(Ⅱ)的理论最大饱和吸附容量均高于ZFLZ和OZ;随反应温度的升高,MFLZ和ZFLZ对Cd(Ⅱ)的理论最大饱和吸附容量均增加,OZ则减小,说明反应温度升高对改性沸石吸附Cd(Ⅱ)起到促进作用,对OZ则是抑制作用. Cd(Ⅱ)与水发生的水合反应会使Cd(Ⅱ)钝化,使其接受电子的倾向减小[25],从而抑制改性沸石吸附Cd(Ⅱ)过程中的络合反应、螯合反应、同晶替代等;同时,水合离子在被吸附前会发生脱水[26],脱水反应为吸热反应,因而温度升高可促进Cd(Ⅱ)水合离子的脱水反应,从而提升对Cd(Ⅱ)的吸附效果.

图6 不同反应温度下ZFLZ、MFLZ和OZ对Cd(Ⅱ)的理论最大饱和吸附容量
采用热力学参数吉布斯自由能(ΔG,kJ/mol)、焓变(ΔH,kJ/mol)和熵变〔ΔS,J/(mol·K)〕反映热力学效应,各参数计算公式如下:
(6)
ΔG=-RTlnK
(7)
(8)
ΔG=ΔH-TΔS
(9)
式中,K为热力学平衡常数,α为斜率.
ZFLZ、MFLZ和OZ吸附Cd(Ⅱ)的热力学方程拟合结果如表2所示. 由表2可见,不同反应温度下ZFLZ、MFLZ的ΔH均为正值,吸附过程为吸热反应,而OZ为放热反应,这说明ZFLZ、MFLZ对Cd(Ⅱ)的吸附具有化学吸附特征[27],且提供能量将促进吸附反应的进行. 另外,OZ的ΔS小于0,而ZFLZ、MFLZ的ΔS均大于0,说明ZFLZ、MFLZ与溶液的固液面混乱度和随机度较OZ有所增加. ZFLZ、MFLZ和OZ的ΔG均为负值,表明在选定范围内 Cd(Ⅱ) 吸附过程是自发的;与OZ不同,ZFLZ、MFLZ的ΔG均随反应温度升高而降低,说明吸附过程涉及化学反应和温度键合反应[28];同时,不同反应温度下MFLZ的ΔG均小于ZFLZ,说明其吸附过程中所需能量较ZFLZ更少.

表2 ZFLZ、MFLZ和OZ吸附Cd(Ⅱ)的热力学拟合参数
2.5 吸附动力学试验
进行吸附动力学试验,将所得数据采用准一级动力学模型〔见式(10)〕、准二级动力学模型〔见式(11)〕、Elovich动力学模型〔见式(12)〕和颗粒内扩散模型〔见式(13)〕进行拟合.
ln(qe1-qt)=lnqe1-k1t
(10)
(11)
qt=A+Blnt
(12)
qt=Ks×t1/2+c
(13)
式中:qe1为准一级动力学模型的平衡吸附量,mg/kg;qe2为准二级动力学模型的平衡吸附量,mg/kg;t为吸附时间,min;qt为t时刻的吸附量,mg/kg;k1为准一级动力学模型的吸附速率常数,min-1;k2为准二级动力学模型的吸附速率常数,g/(mg·min);A、B均为Elovich方程吸附速率常数,单位分别为mg/kg、mg/(kg·min);Ks为颗粒内扩散模型的速率常数,mg/(kg·min0.5).
图7为ZFLZ、MFLZ和OZ的吸附动力学试验结果. 由图7可见,ZFLZ、MFLZ在前200 min的吸附速率均高于OZ,其后相继达到饱和,且平衡吸附量均大于OZ. 通过对初始Cd(Ⅱ)浓度为8 mg/L的动力学吸附试验拟合模型相关系数(R2)的对比发现:ZFLZ、MFLZ的准二级动力学模型相关系数(R2)均大于 0.990 0,而OZ更符合准一级动力学模型,进一步说明Fe-LDHs负载改性沸石吸附过程以化学吸附为主. 在Elovich动力学模型中,ZFLZ、MFLZ的相关系数(R2)均在 0.960 0 以上,表明其为多种吸附类型相结合的非匀质扩散过程[29];OZ的相关系数(R2)为 0.902 8,其值较小,说明吸附类型相对单一.

图7 ZFLZ、MFLZ和OZ的吸附动力学曲线随吸附时间的变化
分别对ZFLZ、MFLZ和OZ的吸附动力学试验数据在0~360和360~1 440 min进行两段拟合,发现各拟合线均未过原点,说明颗粒内扩散不是唯一限速步骤[30]. 由拟合结果(见表3)可知,ZFLZ、MFLZ和OZ的Ks2较Ks1均有所降低,可能是由于溶液中Cd(Ⅱ)浓度降低,导致颗粒扩散速率及孔道扩散速率均降低. MFLZ具有更低的C值及更高的Ks值,在第1和第2阶段C大小均表现为MFLZ

表3 ZFLZ、MFLZ和OZ的颗粒内扩散模型拟合参数
2.6 竞争离子对吸附的影响
选用Cd(Ⅱ)吸附性能更佳的MFLZ开展竞争离子吸附影响试验,结果如图8所示. 有研究[33]表明,LDHs层间阴离子交换能力表现为CO32->OH->SO42->HPO42->F->Cl->NO3-,由图8可见,NO3-对吸附Cd(Ⅱ) 无明显影响,金属层对CO32-亲和度更高,NO3-难以将其交换出来;HPO42-的交换能力虽低于CO32-,但会与Cd(Ⅱ)结合生成Cd(H2PO4)2,影响Cd(Ⅱ)的迁移能力,从而增大MFLZ对Cd(Ⅱ)的吸附难度. 而阳离子(Mg2+、K+、NH4+)对Cd(Ⅱ)吸附效果均有一定程度的抑制作用,这主要源于阳离子会与Cd(Ⅱ)竞争表面吸附位点.

图8 不同竞争离子存在时MFLZ对Cd(Ⅱ)的平衡吸附量
2.7 pH对吸附的影响
选用MFLZ和OZ进行不同pH的等温吸附试验,不同pH下MFLZ和OZ对Cd(Ⅱ)的平衡吸附量如图9所示. 由图9可见:当pH为3~6时,OZ对Cd(Ⅱ) 的平衡吸附量随pH升高而增加;当pH≥7时,OZ对Cd(Ⅱ)的平衡吸附量维持在较高值且不随pH发生明显变化. 一方面是由于OZ表面Zeta电位随pH增大而降低,低Zeta电位对带正电荷的水合重金属离子在OZ上的吸附具有促进作用[34];另一方面,高pH促进了Cd(Ⅱ)生成氢氧化物沉淀.

图9 不同pH下MFLZ和OZ对Cd(Ⅱ)的平衡吸附量

2.8 机理分析
对吸附试验前后的OZ和MFLZ进行XRD分析,结果如图10所示. 由图10可见,OZ吸附Cd(Ⅱ)前后的XRD图谱变化不大,仅在2θ为27.46°和34.96°处增加了两个Cd(OH)2特征峰,说明OZ吸附Cd(Ⅱ)的过程对其结构无明显影响,新增特征峰则表明有部分化学反应参与其中. 而MFLZ吸附Cd(Ⅱ)后,LDHs典型晶面(006)和(012)发生了偏移,其层间距发生了变化,层间重构. 这主要是由于在LDHs层间生成CdCO3沉淀,且Cd(Ⅱ)与层板中Mg2+发生同构取代. 另外,在2θ为30.25°和32°处新增2个明显的Cd(OH)2和CdCO3特征峰,CdCO3对应2θ=49.67°处峰值也明显增强,表明吸附过程发生了表面络合及层间沉淀反应.

图10 OZ和MFLZ吸附Cd(Ⅱ)前后的XRD图谱
图11为MFLZ吸附试验前后及OZ吸附试验后的FT-IR图谱. 由图11可见,相较于OZ吸附 Cd(Ⅱ)前[36],吸附后的FT-IR图谱在534 cm-1处吸收峰出现较明显增强,571 cm-1处新增一个吸收峰,这是O—M、O—M—O (M为Cd)弯曲振动所致[37]. MFLZ吸附Cd(Ⅱ)前,1 300 cm-1附近处出现明显吸收峰,表明改性过程中成功插层CO32-;1 640 cm-1处出现强吸收峰,为H2O变角振动所致;3 600 cm-1处出现—OH伸缩振动对应的吸收峰,表明改性后新增大量氢键;912和 1 000 cm-1处新增2个吸收峰,且在800、688和534 cm-1处吸收峰出现明显偏移和增强,是O—M或O—M—O (M为Mg、Fe)弯曲振动所致. MFLZ吸附Cd(Ⅱ)后,1 300 cm-1处的CO32-反对称伸缩峰对有所偏移,3 600 cm-1处峰值显著降低,表明—OH、CO32-参与了Cd(Ⅱ)的吸附;648、534和430 cm-1附近处的吸收峰为O—M或O—M—O (M为Mg、Fe)弯曲振动,在吸附前后发生较为明显偏移和减弱,可认为是Cd(Ⅱ)通过同构取代层板上的Mg2+所致.
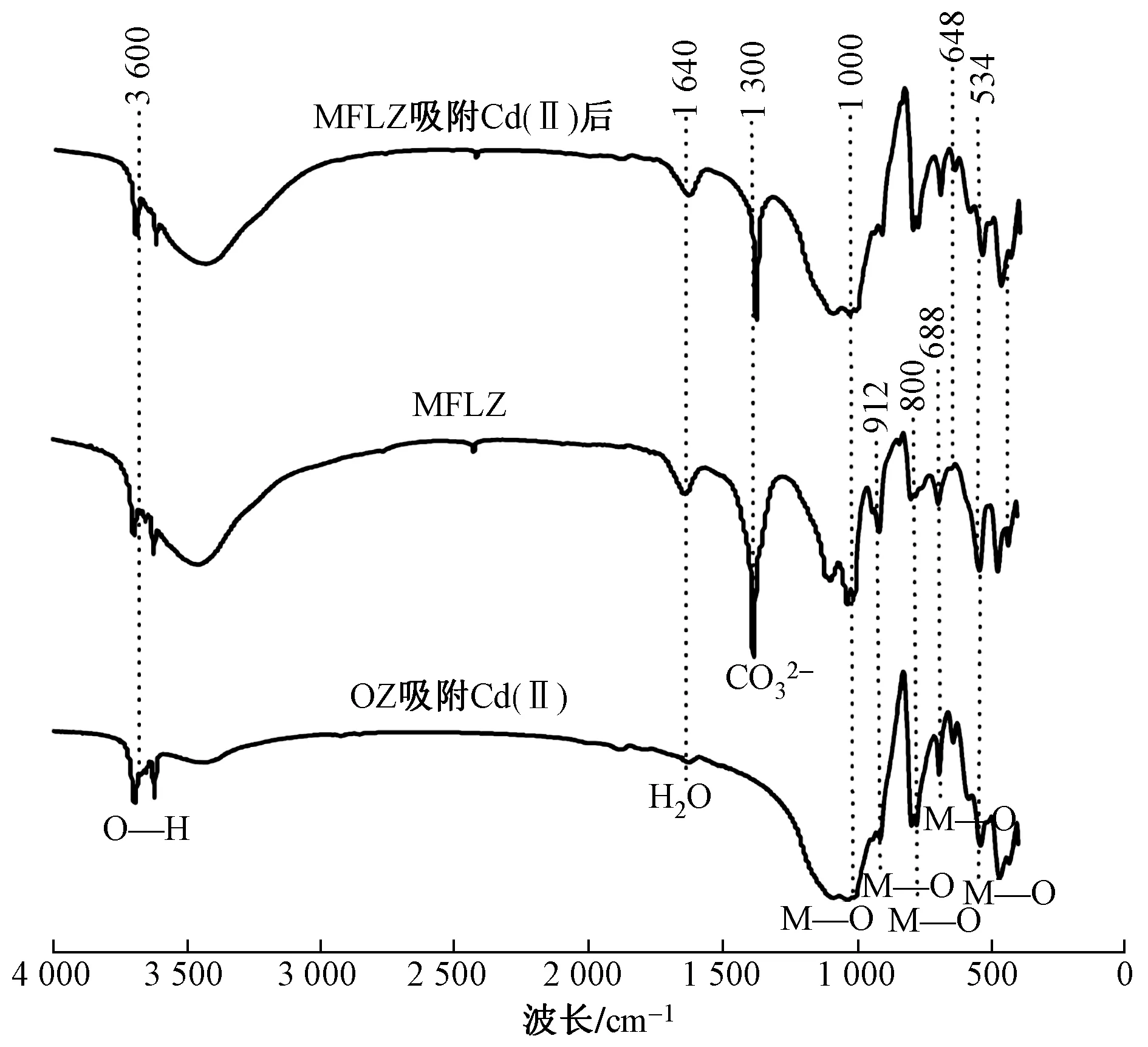
图11 MFLZ吸附Cd(Ⅱ)前后及OZ吸附Cd(Ⅱ)后的FT-IR图谱
3 结论
a) 碳酸系Fe-LDHs的负载改性增强了OZ对Cd(Ⅱ) 的吸附性能,尤其是MFLZ,理论最大饱和吸附容量较OZ提高了1.5倍以上;两种Fe-LDHs负载改性沸石的Cd(Ⅱ)吸附过程均符合Langmuir等温吸附模型和准二级动力学模型,属于单分子层的化学吸附;OZ为多分子层的物理吸附. 3种沸石的Cd(Ⅱ) 吸附过程均受膜扩散和颗粒内扩散共同控制,其中MFLZ扩散速率更高.
b) 碳酸系Fe-LDHs负载改性沸石对Cd(Ⅱ)的吸附为自发吸热过程,温度升高对吸附效果有促进作用,不同温度下MFLZ吸附容量均大于其他两种沸石.
c) MFLZ主要通过化学吸附、表面络合、离子交换及同晶替代等作用去除Cd(Ⅱ),其在常规水体pH范围及常见阴阳离子共存的情况下,能保持良好的吸附除镉能力,具有作为有效吸附材料应用于实际水处理工程的潜力.
