有氧运动调节副交感神经及其受体改善心梗大鼠心脏功能机制探讨
2021-11-25王友华滑艺杰田振军
王友华,马 美,陈 伟,滑艺杰,田振军
据《中国心血管报告2018》统计显示,心血管病死亡占居民总死亡构成的40%,严重威胁人类健康。研究表明,3/4心肌缺血患者存在交感神经和副交感神经失衡。心肌梗死后副交感神经功能减弱,交感神经功能增强,导致自主神经失衡,进而诱发心力衰竭及猝死。副交感神经功能障碍可严重损害心梗患者的心脏功能,常表现为压力反射时延长、心率变异性降低、室性心律失常以及发生炎症反应(Vaseghi et al.,2017)。副交感神经对心脏的调控是以M2受体在心脏负性肌力的调控中占主导地位。另外,副交感神经具有抗炎效应。研究表明,副交感神经递质ACh通过与α7受体结合,抑制多种炎性因子释放(Hou et al.,2018)。因此,调节副交感神经可作为预防和治疗心肌梗死的重要干预手段。
运动训练可提高心脏副交感神经活性并促进ACh释放,进而提高副交感神经对心脏的调控能力。运动训练还可以提高心率变异性(heart rate variability,HRV)和压力反射敏感性(arterial baroreflex sensitivity,BRS)(Bhati et al.,2018;Pearson et al.,2018)。前期研究表明,有氧运动可改善大鼠心脏功能,上调M2受体和胆碱能神经,推测有氧运动引起心脏功能的改善可能与运动诱导心脏副交感神经调节的变化有关(王友华等,2009)。此外,运动训练可以减弱由高脂血症引起的心功能不全,降低炎症细胞因子以及上调胆碱酯酶阳性神经的表达(Wang et al.,2010a)。然而,有关有氧运动对心肌梗死大鼠副交感神经及其M2和α7受体的影响及保护心脏的分子机制鲜见报道。本研究通过对各组大鼠血流动力学变化、胆碱能神经主要受体的表达研究,探讨运动训练对心梗大鼠心脏功能变化的副交感神经调控规律。
1 材料与方法
1.1 仪器和试剂
仪器:多导生理记录仪,病理组织包埋机(BM-II),酶标仪,电泳仪(北京六一),光学显微镜(Olympus BX51),生物组织摊烤片机(YT-6C)等。
试剂:兔单克隆抗体AChRα7(美国bioworld),鼠单克隆抗体M2(abcam),BCA蛋白定量试剂盒(西安晶彩),山羊抗兔二抗、山羊抗小鼠二抗等。
1.2 实验动物与分组
3月龄SD雄性大鼠36只,体质量180~220 g,购于西安交通大学实验动物中心。适应饲养1周后,随机分为假手术组(Sham)、心肌梗死组(MI)、心梗+有氧运动组(ME),每组12只。MI组和ME组左冠状动脉前降支结扎法制备MI模型,ME组在心梗成功1周后进行运动训练。大鼠分组后,分笼饲养,每笼6只,自由进食饮水。
1.3 心梗模型制备与有氧运动方案
MI模型制备:大鼠采用戊巴比妥钠(5%,30 mg/kg)麻醉,带小动物呼吸机,呼吸频率调至60次/min,呼吸比为2:1,潮气量为15 mL,连接心电图。开胸,结扎左心耳和肺动脉圆锥交界下缘2 mm处的左冠状动脉前降支。结扎处远端心肌颜色变浅或变白,并且心电图S-T段抬高或T波倒置为造模成功,常规逐层缝合关胸。
有氧运动方案:参照Xu等(2018)的研究进行,术后7天,ME组大鼠使用机动啮齿动物跑步机(DSPT-202,中国杭州丽泰科技公司)进行为期8周的有氧运动,另两组则在整个实验期间保持久坐不动。为了逐步适应运动压力,训练先以10 m/min的速度在5°倾斜的情况下每天进行10 min(5天/周)。在第2周期间,速度和时间逐渐增加到16 m/min每天50 min(包括10 m/min的5 min预热),一直持续到第8周结束(16 m/min,50 min/天,5天/周)。训练强度约为最大摄氧量(V·O2max)的55%。这种运动方案对MI大鼠耐受性良好。在有氧运动的8周内没有死亡。
1.4 血流动力学检测
8周训练后次日,腹腔注射麻醉大鼠。将压力传感器导管从右颈总动脉逆向插进左心室腔,利用生理信号采集系统记录心室内各项血流动力学参数,如心率、收缩压(SBP)、舒张压(DBP)、左室收缩压(LVSP)、左室舒张末压(LVEDP)和左室压力最大上升和下降速率(±dp/dtmax),评价心脏功能。之后迅速开胸取心脏,用注射器沿主动脉向心脏内注入中性甲醛,每组取3颗心脏放于甲醛固定48 h后,进行形态学实验。另取6颗心脏置于液氮中,24 h后移至-80℃超低温冰箱,用于Western Blot分子生物学实验,其中在左心室边缘区每组(3只)每只各取1 mm3用于电镜观察。剩下的每组3颗心脏用于伊文思蓝-TTC染色。
1.5 伊文思蓝-TTC染色、Masson染色和H.E.染色
伊文思蓝-TTC染色:开胸后钳夹左前降支,于颈静脉注射2%伊文思蓝2~3 mL,确定未缺血区和缺血区。经耳缘静脉推注10%KCl,使心脏停于舒张期。剪下心脏,用生理盐水洗净心脏后,用刀片小心将心脏横切置于培养皿中,用1%TTC溶液37℃避光染色10~15 min,取出心脏,小心将心脏翻面,继续37℃避光染色10~15 min。使用数码相机拍照留取图片,观察梗死组织。将心脏从甲醛中取出,石蜡包埋切片(5 μm),H.E.、Masson染色,光学显微镜下观察并拍摄。
1.6 免疫组织化学染色和超微结构观察
实验严格按照SABC免疫组化染色试剂盒说明书步骤进行。石蜡切片,烤片机预热,脱蜡至水,PBS清洗。3%H2O2浸泡10 min以消除内源性过氧化物酶,抗原修复用山羊血清封闭液37℃孵育60 min,滴加一抗(eNOS抗体,TNF-α抗体,M2抗体,α7抗体),4 ℃冰箱过夜。次日室温复温30 min。PBS清洗,滴加二抗,湿盒中37℃孵育60 min,PBS清洗。滴加SABC复合物(37℃,30 min),DAB显色,三级水洗涤终止反应,常规脱水透明中性树胶封片。快速剪取各组大鼠心脏左心室组织(每组3只),放入电镜固定液固定,送至西安交通大学包埋,切片,JEM-2000EX(日本)透射电镜观察心肌梗死边缘区毛细血管、闰盘和线粒体结构并拍照。
1.7 Western Blotting
取心肌组织50~60 mg,加500 μL RIPA裂解液提取蛋白,手持式匀浆机匀浆6次,4℃离心12 000 rpm×20 min,取上清,BCA试剂盒蛋白定量。常规制胶,点样,电泳,转膜,丽春红染色,5%BSA封闭,孵育一抗(M2抗体,α7抗体)4℃过夜,次日复温30 min,TBST漂洗,孵育二抗1 h,TBST洗二抗,ECL发光。
1.8 数据处理
组织切片显微镜观察。Western Blot实验结果采用Image Lab分析处理。所得数据用Gragh Pad Prism 6.01软件转换作图。所有数据均采用SPSS 19.0进行处理,结果以平均值±标准误表示,采用单因素方差分析进行显著性差异分析,P<0.01为差异极显著,P<0.05为差异显著。
2 实验结果
2.1 心脏功能检测结果
血流动力学结果显示,与S组比较,MI组LVSP、±dP/dtmax均显著降低(P<0.05,P<0.01),LVEDP显著升高(P<0.01);与MI组比较,ME组LVSP、±dP/dtmax均显著上升(P<0.05,P<0.01),LVEDP显著下降(P<0.05),结果表明,MI后心脏功能显著降低,有氧运动可显著改善心脏功能(表1)。

表1 心肌梗死及有氧运动对大鼠的影响特征及血流动力学参数Table 1 Effects of Myocardial Infarction andAerobic Exercise on Rats and Hemodynamic Parameters
2.2 伊文思蓝-TTC染色结果
染色结果显示,正常心肌呈深红色,缺血区未梗死心肌呈蓝黑色,梗死心肌组织为灰白色。与Sham组相比,MI组呈现明显的蓝黑色缺血区及灰白色坏死区。与MI组相比,ME组灰白色梗死区及蓝黑色缺血区有所减少。结果表明,有氧运动可减轻心梗后心肌组织坏死,改善心脏功能(图1)。

图1 各组大鼠心脏伊文思蓝-TTC染色结果Figure 1. Results of Cardiac Evans Blue-TTC Staining in Rats
2.3 H.E.染色观察结果
H.E.染色结果显示,Sham组大鼠心肌细胞排列整齐,紧密,结构清晰。MI组大鼠梗死区心肌细胞大量坏死,心肌纤维排列紊乱,出现替代性纤维化,形成瘢痕组织。ME组大鼠梗死边缘区有新的心肌生成,表明有氧运动可以促进梗死边缘区心肌生成,降低梗死面积(图2)。
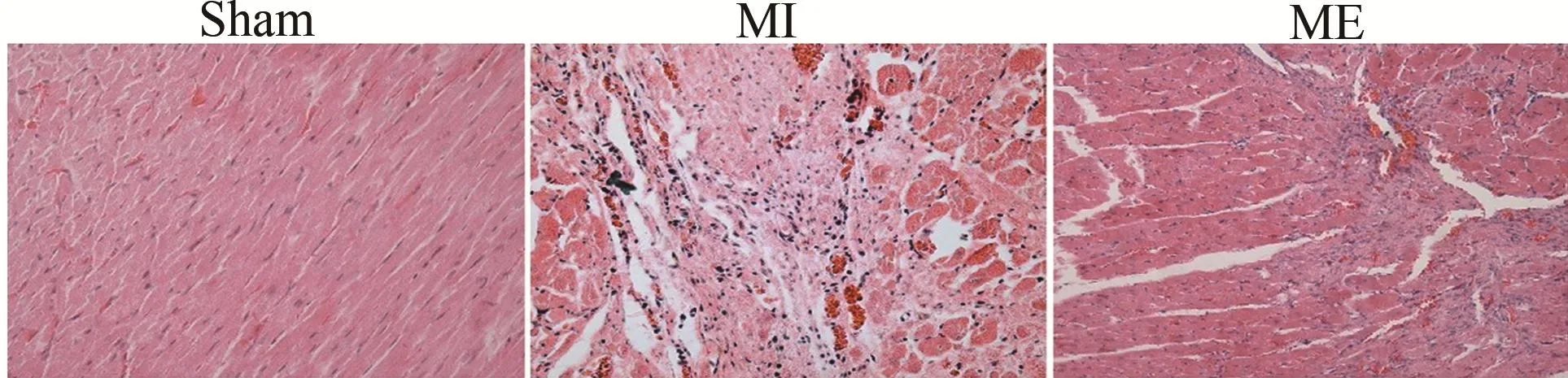
图2 各组大鼠心肌组织H.E.染色结果(×400)Figure 2. Results of H.E.Staining in Cardiac Tissue of Rats
2.4 Masson染色观察结果
Masson染色结果显示,Sham组大鼠红色心肌纤维排列整齐,蓝色胶原纤维少见。MI后心肌细胞坏死,心肌组织结构紊乱,梗死区可见大面积蓝色胶原纤维。ME组大鼠心肌组织结构有一定程度改善,梗死区红色心肌细胞与蓝色胶原交互分布,胶原纤维明显减少,表明8周有氧运动可减轻MI后心肌纤维化程度(图3)。
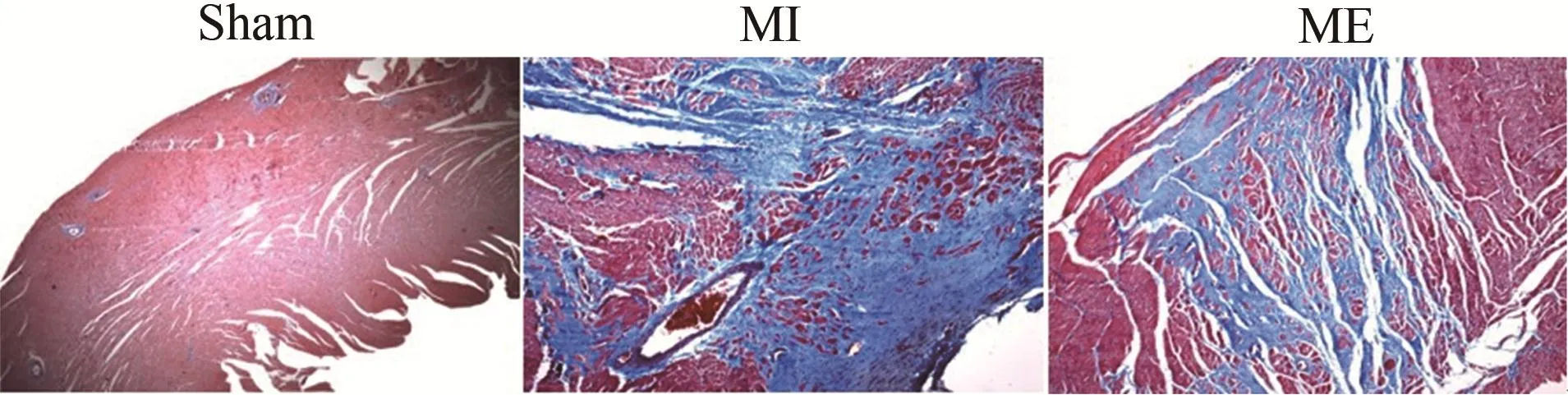
图3 各组大鼠心肌组织Masson染色结果(×400)Figure 3. Results of Myocardial Tissue Masson Staining in Rats
2.5 免疫组化结果
大鼠心肌M2受体和TNF-α免疫组化染色结果显示,与Sham组相比,MI心肌组织中可见M2受体和TNF-α阳性颗粒显著增加。与MI组比较,ME组M2受体和TNF-α蛋白表达显著下降。表明有氧运动可以下调心梗大鼠M2受体和TNF-α蛋白的表达,抑制炎症反应,改善心脏功能(图4)。大鼠心肌eNOS和α7受体免疫组化染色结果显示,与Sham组相比,MI心肌组织中可见eNOS和α7受体表达的阳性颗粒显著减少。与MI组比较,ME组eNOS和α7受体表达显著增加。结果表明,有氧运动可增加心梗大鼠eNOS和α7受体的表达,改善心脏功能(图5~图7)。
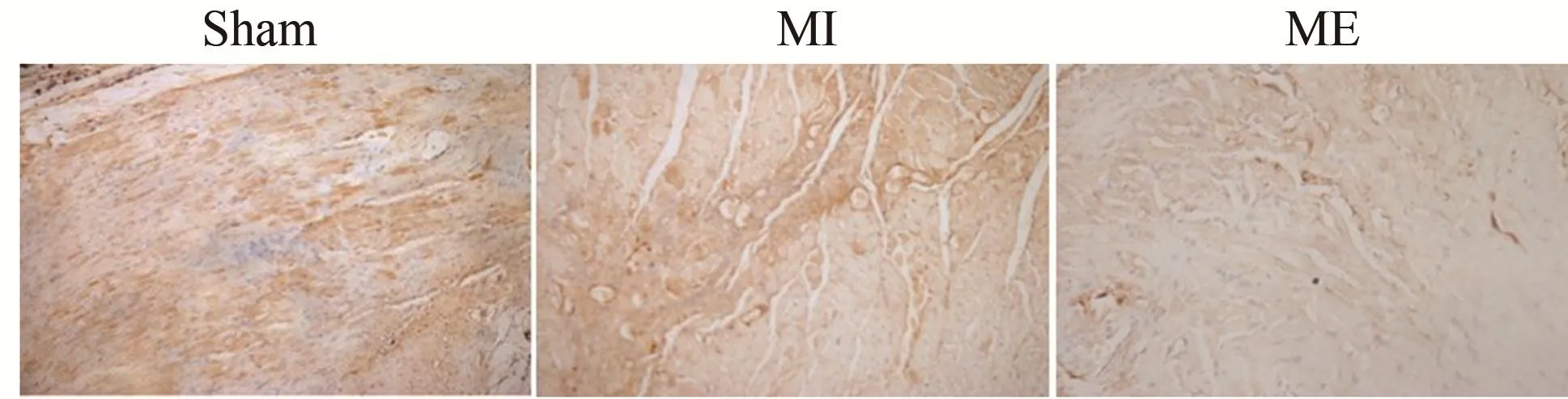
图4 各组大鼠心肌TNF-α免疫组化染色结果(×400)Figure 4. Results of TNF-α Immunohistochemical Staining in Rat Heart Muscle

图5 各组大鼠心肌eNOS免疫组化染色结果(×400)Figure 5. Results of eNOS Immunohistochemical Staining in Rat Myocardium

图6 各组大鼠心肌M2免疫组化染色结果(×400)Figure 6. Results of M2Receptors Immunohistochemical Staining in Rats Myocardial

图7 各组大鼠心肌α7免疫组化染色结果(×400)Figure 7. Results of α7 Receptors Immunohistochemical Staining in Rats Myocardial
2.6 各组实验大鼠左心室梗死边缘区超微结构观察结果
Sham组大鼠毛细血管内皮细胞排练整齐、胞膜完整、平滑。MI组大鼠毛细血管内皮细胞有脱落现象,细胞膜突起、断裂,其外周胶原纤维增多,管壁增厚。ME组大鼠内皮细胞脱落减少,薄膜趋于完整平滑,其外周胶原纤维减少,管壁较MI组明显变薄(图8)。Sham组心脏鼠闰盘结构清晰,连接完整,较多。MI组闰盘发生扭曲,盘旋重叠,模糊、不连续并有极度扩张现象。ME组闰盘较MI组明显增多,结构清晰,连接较完整(图9)。Sham组线粒体内膜内陷形成的线粒体嵴密集、有序。MI组线粒体水肿和空泡样变性,线粒体嵴消失,还可见胞浆内堆积大量溶酶体。ME组线粒体空泡样变性减少,溶酶体减少,线粒体嵴结构趋于正常(图10)。结果表明,有氧运动可改善左心室梗死边缘区毛细血管、闰盘和线粒体形态结构,从而改善心梗大鼠心脏功能。

图8 大鼠心肌梗死边缘区毛细血管超微结构观察结果(×5 000)Figure 8. Ultrastructural Observation of Capillaries in the Marginal Zone of Myocardial Infarction in Rats

图9 大鼠心肌梗死边缘区闰盘超微结构观察结果(×20 000)Figure 9. Ultrastructural Observation of the Disc in the Marginal Zone of Myocardial Infarction in Rats

图10 大鼠心肌梗死边缘区线粒体超微结构观察结果(×25 000)Figure 10. Ultrastructural Observation of Mitochondria in the Marginal Zone of Myocardial Infarction in Rats
2.7 Western Blotting结果
Western Blotting结果显示,与Sham组比较,MI组M2受体显著上调(P<0.01)。与MI组比较,ME组M2受体显著减少(P<0.01)。与Sham组比较,MI组α7受体显著下调(P<0.05,P<0.01),与MI组比较,ME组α7受体显著增加(P<0.05)。结果表明,MI心脏副交感神经M2受体显著增加,α7受体表达显著降低,有氧运动可显著降低MI心脏M2受体及增加α7受体的表达(图11)。

图11 大鼠心肌M2受体及α7受体表达结果Figure 11. Expression of M2Receptor and α7 Receptor in Rat Myocardial
3 讨论与分析
3.1 心肌梗死后心脏功能降低的副交感神经的调控机制
心肌梗死后大鼠心脏功能明显受损(Ranjbar et al.,2018)。调节心脏功能的自主神经系统的两个主要分支是副交感神经系统(parasympathetic nervous system,PSNS)和交感神经系统(sympathetic nervous system,SNS)。PSNS和SNS的平衡是维持正常心脏功能和血液动力学稳态的关键因素(Lacroix et al.,2008)。心肌梗死后副交感神经活性降低和交感神经活性增加,最终导致心脏功能降低。心梗后高发的危险因素还包括冠状动脉粥样硬化和持续性复杂室性心律失常(Yu et al.,2013b)。MI后患者心脏自主神经功能不平衡,通过心率变异性(副交感神经张力)降低来表现,HRV与患者的恶性室性心律失常、随后猝死及其他心血管事件风险增加有关(Oliveira et al.,2013)。副交感神经功能障碍已经间接地表现为异常压力反射敏感性(Vaseghi et al.,2017)。一般来说,压力反射控制主要由交感神经介导,心脏控制主要由副交感神经介导。PSNS对心脏的调节作用主要是由M2毒蕈碱乙酰胆碱受体和α7受体介导。在缺血再灌模型中,心室M2AChR mRNA和蛋白表达显著增加(Li et al.,2010)。迷走神经切断术后1周大鼠心脏中的M2AChR表达增加,此外,MI患者的心室区域毒蕈碱受体上调,是副交感神经去神经支配相关的适应性反应(Mazzadi et al.,2009)。副交感神经通过激活α7烟碱乙酰胆碱受体(α7nAChR)引发胆碱能抗炎途径(Intachai et al.,2018)。α7nAChR缺失导致的全身炎症反应与mTOR相关的自噬过程有关(Fang et al.,2019),α7nAChR减少可抑制血管的生成(Yu et al.,2013a)。结果表明,副交感神经α7nAChR和M2AChR在调节心脏功能中起着重要作用。
MI大鼠心肌线粒体和自噬小体数目增加,表明Parkin活性的降低导致线粒体自噬流障碍以及正常形态破坏(Wu et al.,2016)。已知M2受体作用于Parkin/PINK信号通路,本研究表明,MI后M2受体升高,推测MI后线粒体自噬流障碍,心脏功能受损,副交感神经功能降低,导致M2受体代偿性升高。实验结果表明,MI后线粒体结构破环,与前人研究一致。MI可造成心肌细胞内质网应激。当心肌细胞缺血缺氧时,就会导致氧自由基的产生以及钙离子稳态失衡,诱发未折叠蛋白反应,进一步发展为ERS。心脏I/R期间,M2受体的活化可以激活ERK1/2和PI3K/Akt信号传导途径以缓解ER应激反应和细胞凋亡(Liao et al.,2015)。MI后内质网应激和凋亡引起M2受体代偿性增加。MI后大鼠炎症反应和氧化应激增强。MI后炎症反应导致各种细胞因子的释放,包括TNF-α、IL-6、TGF-β和白细胞介素(ILs),这些细胞因子有助于心肌坏死、细胞凋亡、梗塞扩张、纤维化、左心室扩张、非梗死心肌肥大(Souri et al.,2019)。另外,大鼠MI后NF-κB显著升高,心脏功能受损(Han et al.,2018)。α7nAChR具有抗炎作用。本研究结果显示,α7受体在心肌梗死后显著降低,可能是TNF-α升高的原因之一。TNF-α还可通过刺激NADPH氧化酶减少eNOS的表达或加快NO的失活,降低NO的生物利用率,从而促进重构及缺血区及边缘区血管闭塞,微血管阻塞发生无复流现象。心肌缺血后闰盘结构紊乱,与前人一致。Cx43的表达能减少室性心律失常易感性,MI后Cx43在边缘区绝大部分已消失(Saffitz et al.,2012),推测Cx43降低导致闰盘形态及功能改变,心脏受损。
3.2 有氧运动通过激活副交感神经受体改善心梗大鼠心脏功能机制
近年,调节副交感神经活性作为治疗心肌梗死的研究增多。临床和基础研究均表明,运动可以增加副交感神经活性,改善心肌梗死心脏功能(Chen et al.,2010;Teixeira et al.,2017)。心肌梗死患者进行体育锻炼后BRS以及HRV参数增加,证实自主神经系统平衡向副交感神经活动的有益转变(Daniłowiczszymanowicz et al.,2013)。另外,老年心肌梗死患者早期进行运动训练后,自主神经调节和心率变异性改善,心脏功能改善,病死率降低。运动还可以减少MI后小鼠的炎症反应,包括炎症因子TNF-α、IL-6和IL-1的降低(Puhl et al.,2015)。而副交感神经受体α7nAChR是抗炎途径中的关键环节,本研究结果显示,运动后心肌梗死大鼠TNF-α降低以及α7nAChR显著升高,这有可能是运动改善MI大鼠心脏功能的重要靶点。运动对α7nAChR的激活可以募集酪氨酸激酶Jak2,激活转录因子STAT3和减少TNF-α和IL-6。α7nAChR也参与增强MI中胆碱诱导的毛细血管密度。表明α7nAChR参与血管生成(Li et al.,2010)。前期研究发现,有氧训练可通过上调胆碱能神经和M2受体改善大鼠心脏功能。本研究结果显示,MI后M2受体代偿性增加,有氧运动显著下调MI大鼠M2受体的表达,改善心脏功能。有氧运动可显著激活血管内皮型一氧化氮合酶(eNOS),增加内皮细胞NO含量的释放,促进血管内皮依赖性血管舒张(Wang et al.,2010b)。推测有氧运动可加大心梗大鼠边缘区毛细血管管壁通透性,促进血管舒张及降低血管纤维化,改善受损心脏。因此认为,有氧运动通过调节副交感神经M2受体和α7nAChR受体改善心梗大鼠心脏功能。
据报道,α7nAChR的激活导致促炎细胞因子的产生和释放下调,α7的激活通过干扰I-κB磷酸化和NF-κB转录活性来抑制NF-κB;激活α7以抑制STAT3磷酸化,使未磷酸化的STAT3(uSTAT3)结合NF-κB亚基p50和p65,并避免其核转位;α7活化引起的抗炎作用是由于Jak2/STAT3信号通路的激活,活化的STAT3诱导产生三效曲普瑞林(TTP),被认为是抗炎作用的中间体;另外提出的促炎反应的胆碱能调节机制包括由磷酸肌醇-3-激酶(PI3K)/Akt/Nrf-2途径激活介导的血红素加氧酶-1(HO-1)的上调(Báez-Pagán et al.,2015)。α7nAChR刺激可能通过 HO-1诱导的机制减少氧化应激(Navarro et al.,2015)。炎症转录因子NF-κB参与氧化应激过程,抑制NF-κB可以阻止氧化应激;α7nAChR的激活降低了缺血中风小鼠氧化应激和NF-κB活性(Han et al.,2014)。副交感神经递质ACh通过与α7亚型结合,抑制炎症因子TNF-α、IL-1等释放。α7nAChR的激活能促进心肌缺血大鼠中JAK2/Bcl-2和PI3K/Bcl-2级联改善BeClin1相关的自噬功能障碍,从而减轻心肌缺血中的心脏损伤(Hou et al.,2018)。有氧运动显著提高α7nAChR的表达,推测有氧运动通过激活副交感神经α7nAChR作用于其下游信号通路,起到抗炎、减少氧化应激、增强细胞自噬等作用,最终改善MI大鼠心脏功能。在缺氧复氧诱导的H9C2心肌损伤细胞中发现线粒体PINK1和Parkin水平降低,并伴随着自噬通量降低(LC3-II/LC3-I降低和p62增加)(Sun et al.,2016)。运动可以调节老年心梗小鼠线粒体信号生物标志物,引发线粒体自噬(Zhao et al.,2018)。运动可以畅通心梗后的线粒体自噬流,增加线粒体生物合成,改善心脏功能(Campos et al.,2017)。这可能是本实验结果中运动改善心梗心脏线粒体形态关键原因。有氧运动显著降低MI大鼠副交感神经M2受体,推测有氧运动通过增强副交感神经功能降低心肌内质网应激和细胞凋亡以及增加线粒体自噬流进而引起M2受体下调,从而改善MI大鼠心脏功能。本研究显示,有氧运动改善心梗心肌毛细血管和闰盘形态,这有利于心脏的冠脉循环及心肌血液供应。心脏功能改变与副交感神经的调控能力关系密切。本研究发现,心肌梗死心脏eNOS和α7受体表达降低,TNF-α和M2受体表达升高,可能是心肌梗死后副交感神经功能降低,心脏功能损伤导致的结果,而有氧运动干预使M2和炎性因子表达降低,提高eNOS和α7受体表达,可能是有氧运动提高心肌梗死大鼠心脏功能的潜在原因。
4 结论
心肌梗死后的心脏功能紊乱与心脏交感神经和副交感神经失衡,心肌副交感神经M2表达增加和α7受体表达下降密切相关。有氧运动可以通过上调α7受体和下调M2受体,增强副交感神经功能,改善心梗大鼠心脏功能。
