玉竹多糖对油酸诱导的HepG2脂肪堆积的改善作用及作用机制研究*
2021-11-24肖作奇邱盼子欧阳波
肖作奇,邱盼子,欧阳波
(湖南省妇幼保健院,湖南 长沙 410008)
脂代谢的紊乱会引起甘油三酯在肝脏内异常堆积,脂质堆积已经成为诱发肥胖、糖尿病及脂肪肝的主要原因之一。近年来,中药对高脂饮食导致的能量稳态失衡的治疗作用逐渐成为降脂护肝领域的关注热点[1-3]。玉竹是我国药食同源目录中的常用中药,临床广泛用于糖尿病(diabetes mellitus,DM)的防治,同时作为药膳其对糖脂代谢也有很好的调节作用[4]。现代药理学研究表明,玉竹有抗糖尿病活性,如玉竹多糖(polysaccharides of polygonatum,POP)有改善胰岛素抵抗的功能[5-6],玉竹提取物具有抗炎和免疫调节作用[7],且玉竹在抗氧化、护肝、抗肿瘤等方面都有潜在药用价值[8-9]。玉竹对糖尿病的药效作用明确,但其作用机制没有阐明,脂质代谢异常可能是诱发2型糖尿病胰岛素抵抗的主要因素之一,而目前玉竹多糖对于正常个体和肥胖个体脂代谢调节作用还鲜有报道。因此,研究玉竹多糖的降脂作用对开发降脂天然产物和指导肥胖人群预防糖尿病均有重要意义。本研究将人肝癌细胞(HepG2)作为模式生物对玉竹多糖的降脂活性及其作用机制进行探讨。脂肪变性的HepG2细胞可能产生显著的氧化应激损伤,并使炎症反应通路激活[10-11]。本实验通过评价细胞脂质积累程度,以及氧化应激指标超氧化物歧化酶(SOD)和活性氧(ROS)水平,基于NF-κB信号通路探究了玉竹多糖对油酸诱导的HepG2脂肪堆积的改善作用及其作用机制。
1 材 料
1.1 细胞 HepG2细胞(细胞编号:BNCC316757)购于北京北纳创联生物技术研究院。
1.2 药物与试剂 玉竹(批号:20170503)购于衡东县中药饮片厂,经湖南省妇幼保健院潘涛副主任中药师鉴定为Polygonatum odoratum(Mill.)Druce的干燥根茎。玉竹多糖由湖南省妇幼保健院药学制剂部制备,制备方法参照文献,多糖含量为87.9%[12]。洛伐他汀(Sigma-Aladdin,批号:E2014103);DMEM(货号:Gibco-1056904)、FBS(货号:Gibco-10099141C)、0.25%胰酶消化液(货号:Gibco-25200072)均购于赛默飞世尔科技(中国)有限公司;总胆固醇(TC)检测试剂盒(批号:2017S2KE1015)、甘油三酯(TG)检测试剂盒(批号:2017S2KE1013)、ROS检测试剂盒(批号:2017S2KEC1300-2)、SOD酶法检测试剂盒(批号:2017S1KE2011)、BCA 法蛋白定量试剂盒(批号:2017S2KP1513)均购于北京普利莱基因技术有限公司;CCK-8试剂盒(上海碧云天生物技术有限公司,批号:12189170716);油红O染色试剂盒(南京建成科技有限公司,批号:20160821);S-PAGE凝胶制备试剂盒(武汉赛维尔生物科技,批号:SW2017770801)。
1.3 主要仪器 BIO-RAD iMark酶标仪(美国Bio-Red公司);ICO型CO2培养箱(德国Memmert公司);SW-CJ-2D超净工作台(苏州净化);DP72奥林巴斯显微成像系统(日本OLYMPUS公司);D-37520高速离心机(Thermo Fisher Scientific);iBrightTMCL750凝胶成像系统(Thermo Fisher Scientific)。
2 方 法
2.1 细胞培养 使用T25培养瓶复苏HepG2细胞,细胞使用含10%胎牛血清的DMEM培养基培养,培养箱环境:5%CO2,37 ℃,饱和湿度。细胞经过1∶3传代3次后,经过0.25%胰酶-EDTA消化,用含5%FBS的DMEM重悬细胞并调节细胞密度至2×105/mL用于细胞实验。12孔板接种1 mL/孔。96孔板接种100 μL/孔或200 μL/孔。
2.2 油酸诱导的脂肪堆积模型 将100 μL油酸与215 μL DMSO混合均匀后,用含1%BSA的DMEM稀释混合液配制成含油酸10 mmol/L(含DMSO 0.68%)的母液备用。96孔板接种过夜后,弃去培养基,PBS洗3次,分别用含油酸(高、中、低浓度,根据油酸细胞毒性结果确定)的DMEM(含1% BSA,不含血清)孵育细胞24 h。用正常DMEM作为空白对照组。每组设置6孔。结合油酸细胞毒性试验和甘油三酯检测结果确认最佳造模浓度。
2.3 药物处置及分组 将实验设置为正常对照组、模型对照组、洛伐他汀组、玉竹多糖高剂量组、玉竹多糖低剂量组。采用96孔板实验,每组设置6孔,每孔细胞2×104个。接种过夜后,去除培养基,PBS洗3次,正常对照组和模型对照组加DMEM 100 μL,洛伐他汀组加含0.2 mmol/L洛伐他汀DMEM 100 μL,玉竹多糖低剂量组加100 μg/mL玉竹多糖100 μL,玉竹多糖高剂量组加200 μg/mL玉竹多糖100 μL;孵育2 h后,正常对照组加DMEM 100 μL,其他各组加入含造模浓度的油酸DMEM 100 μL。各组最终药物作用浓度:洛伐他汀组为0.1 mmol/L洛伐他汀,玉竹多糖低剂量组为50 μg/mL玉竹多糖,玉竹多糖高剂量组为100 μg/mL玉竹多糖。酶标仪设置低速混合5 min。采用12孔板,每组设置3孔,同法进行实验,每次加液体积500 μL。
2.4 CCK-8法检测细胞活力 96孔板检测油酸和DMSO细胞毒性,采用“2.2”配制的细胞母液,按96孔板接种过夜后,弃去培养基,PBS洗3次,采用正常DMEM作为对照,分别检测用含油酸0.1、1.0、2.0、2.5、4.0、5.0 mmol/L的DMEM(含1%BSA,不含血清)孵育细胞24 h后检测细胞活力。96孔板检测其他实验药物细胞毒性:0.1 mmol/L洛伐他汀和200 μg/mL玉竹多糖分别孵育细胞24 h检测细胞活力。按CCK-8试剂盒使用说明书操作,在450 nm下检测吸光度,得到细胞活性结果。细胞存活率=各组吸光度值/正常对照组吸光度均值×100%。
2.5 油红O染色 参考试剂盒方法并进行改良,主要操作步骤:12孔板完成实验后,弃培养基,PBS洗涤3次,加入4%多聚甲醛溶液室温固定4 h。双蒸水洗3次。加入试剂盒反应试剂1油红O染色,室温作用20 min,双蒸水洗3次,加入试剂2苏木素复染3 min。双蒸水洗6次。蜡封观察。
2.6 生化指标检测 96孔板完成药物处置培养后,去培养基,PBS洗3次,用细胞裂解液裂解细胞(冰浴)。收集所有细胞裂解液,于4 ℃,12 000 r/min离心5 min,收集上清。进行蛋白定量后,照试剂盒检测方法,检测各组细胞中TC和TG含量。分别按照试剂盒说明书测定样品总SOD活力水平,检测细胞内总ROS含量。
2.7 蛋白免疫印迹实验 12孔板完成实验后,弃培养基,PBS洗涤3次,加细胞裂解液,转移细胞样品至冰浴中,用匀浆器碾磨30 min,于4 ℃,12 000 r/min离心5 min,取上清液测总蛋白浓度。用10% SDS聚丙烯酰胺凝胶电泳分离蛋白样品,转膜封闭,孵育一抗NF-κB/TLR4,过夜,孵育二抗。显影成像。Image-J 6.0分析NF-κB/TLR4蛋白表达量。
2.8 统计学方法 采用Minitab17进行统计学分析,计量资料以“均数±标准差”()表示。多组间比较用单因素方差分析(ANOVA)进行统计评价,P<0.05为差异有统计学意义。
3 结 果
3.1 各组HepG2细胞活力比较 与正常对照组比较,0.1~4.0 mmol/L的油酸对细胞活力均无明显影响(P>0.05),5 mmol/L油酸(含0.34% DMSO,1% BSA)会明显降低细胞活力(P<0.05)。因此,后续实验选择油酸造模浓度为0.1、2.0、4.0 mmol/L。0.1 mmol/L洛伐他汀和200 μg/mL玉竹多糖对HepG2细胞均无明显细胞毒性(P>0.05)。(见表1)
表1 各组HepG2 细胞活力比较(,n=6)
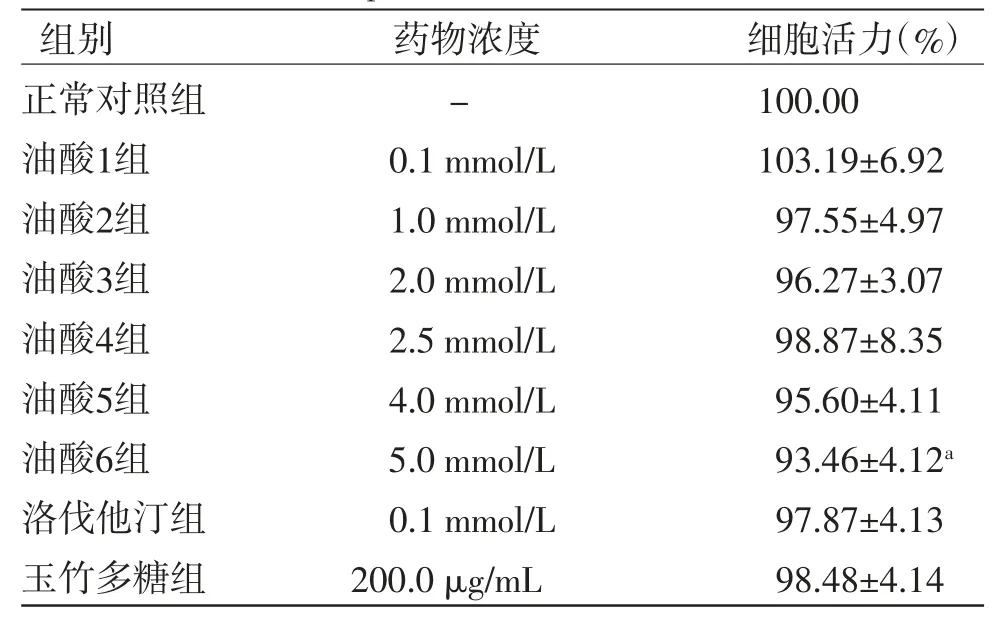
表1 各组HepG2 细胞活力比较(,n=6)
注:与正常对照组比较,aP<0.05
3.2 油酸孵育HepG2 24 h诱导的脂肪堆积 油红O染色结果显示,与正常对照组比较,油酸(0.1、2.0、4.0 mmol/L)均会诱导细胞产生明显的油脂堆积,而且呈剂量相关;4.0 mmol/L组细胞形态明显变圆。(见图1)

图1 不同浓度油酸诱导的HepG2 细胞脂肪堆积情况(油红O 染色,×200)
生化指标检测显示,2.0 mmol/L和4.0 mmol/L油酸能明显增加细胞内TC、TG的含量(P<0.01),且4.0 mmol/L油酸组HepG2细胞内TC、TG的含量与2.0 mmol/L油酸组比较,差异无统计学意义(P>0.05);0.1 mmol/L油酸组HepG2细胞内TC含量与正常对照组比较,差异无统计学意义(P>0.05),但TG含量明显高于正常对照组(P<0.05)。(见图2、表2)结合细胞毒性实验结果,后续实验选择油酸造模浓度为2.5 mmol/L。
表2 油酸孵育24 h 各组HepG2 细胞TC、TG 含量比较(,n=6)
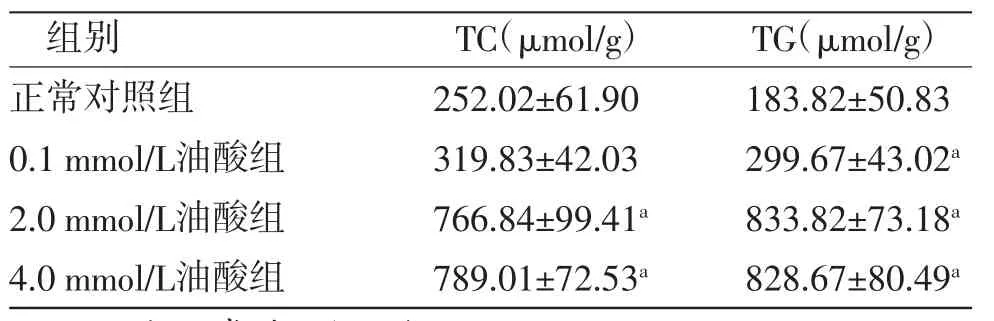
表2 油酸孵育24 h 各组HepG2 细胞TC、TG 含量比较(,n=6)
注:与正常对照组比较,aP<0.01
3.3 玉竹多糖对油酸诱导的HepG2细胞TC、TG含量影响 与正常对照组比较,模型对照组HepG2细胞TC、TG含量明显升高(P<0.01);与模型对照组比较,洛伐他汀组和玉竹多糖低、高剂量组HepG2细胞TC、TG含量明显降低(P<0.05或P<0.01),且玉竹多糖的效应呈剂量依赖性。(见表3)
表3 玉竹多糖孵育24 h 对脂肪堆积的HepG2 细胞TC 和TG 含量的影响(,n=6)
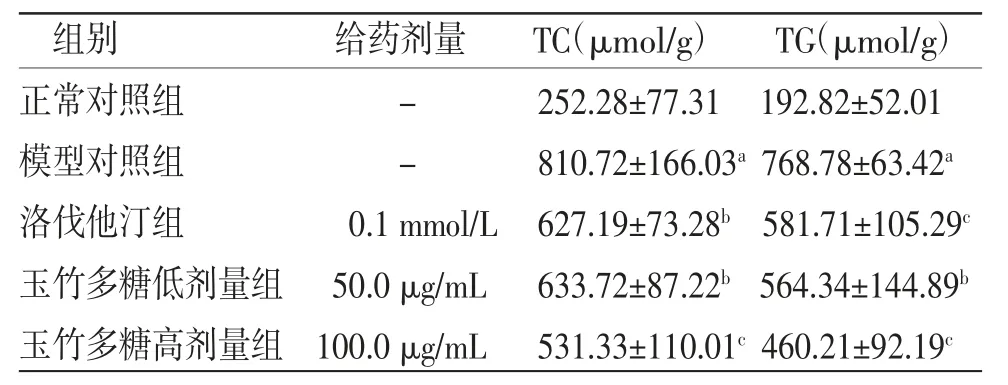
表3 玉竹多糖孵育24 h 对脂肪堆积的HepG2 细胞TC 和TG 含量的影响(,n=6)
注:与正常对照组比较,aP<0.01;与模型对照组比较,bP<0.05,cP<0.01
3.4 玉竹多糖对油酸诱导的HepG2细胞中脂滴含量的影响0.25 mmol/L油酸孵育HepG2细胞24 h后,经油红O染色,细胞内脂滴形成情况见图2。正常对照组HepG2细胞中未见明显脂滴,模型对照组HepG2细胞中出现大量脂滴。与模型对照组比较,洛伐他汀组和玉竹多糖低、高剂量组HepG2细胞脂滴均减少。图片经过Image-J 6.0分析红色脂滴含量,与正常对照组比较,模型对照组HepG2细胞中脂滴明显增多(P<0.01);与模型对照组比较,洛伐他汀组和玉竹多糖低、高剂量组HepG2细胞中脂滴均明显减少(P<0.05)。(见图2~3)

图2 各组HepG2 细胞脂质堆积情况(油红O 染色,×200)

图3 各组HepG2 细胞内脂滴含量水平比较(,n=3)
3.5 玉竹多糖对油酸诱导的HepG2细胞SOD和ROS水平的影响0.25 mmol/L油酸孵育HepG2细胞24 h后,与正常对组比较,模型对照组HepG2细胞SOD水平明显降低(P<0.01),而ROS水平明显升高(P<0.01);经过洛伐他汀和玉竹多糖处理后,与模型对照组比较,洛伐他汀组和玉竹多糖低、高剂量组HepG2细胞SOD水平明显升高(P<0.01或P<0.05),而ROS水平明显降低(P<0.01或P<0.05)。(见表4)
表4 各组HepG2 细胞SOD 和ROS 水平比较(,n=6)

表4 各组HepG2 细胞SOD 和ROS 水平比较(,n=6)
注:与正常对照组比较,aP<0.01;与模型对照组比较,bP<0.05,cP<0.01
3.6 各组HepG2细胞中NF-κB/TLR4蛋白相对表达量比较 与正常对照组比较,模型对照组HepG2细胞中NF-κB、TLR4蛋白相对表达量明显上调(P<0.01),提示油酸可能激活了NF-κB信号通路。与模型对照组比较,洛伐他汀组和玉竹多糖低、高剂量组HepG2细胞中NF-κB、TLR4蛋白相对表达量明显下调(P<0.05)。(见图4~5)
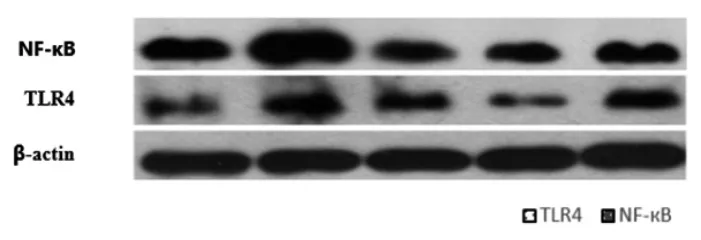
图4 各组HepG2 细胞中NF-κB/TLR4 蛋白表达Western blotting 图

图5 各组HepG2 细胞中NF-κB/TLR4 蛋白相对表达量比较(,n=3)
4 讨 论
油酸诱导的细胞内脂肪堆积模型被广泛用于脂质代谢紊乱的研究,研究表明,油酸作用于HepG2细胞24 h会使甘油三酯/胆固醇含量明显升高,且细胞内ROS水平明显升高[13]。ROS能改变细胞膜通透性,直接引起细胞损伤,细胞内ROS还会引起基因突变,继而激活NF-κB通路,导致胰岛细胞发生炎症细胞因子和趋化因子过表达,进一步活化NF-κB加重细胞损伤。同时细胞内ROS水平升高,会引起脂质代谢紊乱和细胞内脂质体堆积,从而诱发肝性胰岛素抵抗,具体表现为肝细胞肥大和葡萄糖代谢异常[14-15]。脂质代谢紊乱引起的氧化应激损伤可能使心脑血管病变、脂肪肝和胰岛素抵抗等脂代谢相关的风险明显增高[16-17],尤其是,过量的脂肪堆积产生大量ROS,可激活NF-κB信号通路,上调TLR4蛋白表达,增强炎症反应。脂质堆积引起的NF-κB信号通路活化可能是诱导产生胰岛素抵抗的重要原因[18]。POP能提高胰岛素抵抗的HepG2细胞SOD活力,减少ROS蓄积。玉竹对2型糖尿病的药效机制被认为与改善胰岛素抵抗有关,且作用机制是改善机体的氧化应激反应。POP能显著降低糖尿病大鼠体内有害物质低密度脂蛋白胆固醇(LDL-c)和丙二醛(MDA)蓄积[19-20]。本实验结果表明,POP能显著改善油酸诱导的HepG2细胞内的脂质堆积,并降低脂肪堆积HepG2细胞内ROS,提高SOD水平,进而达到降低TC和TG含量的作用。蛋白定量分析结果表明,POP能明显抑制脂肪堆积HepG2细胞内NF-κB/TLR4蛋白表达水平,这可能是通过ROS清除作用启动细胞内氧化应激损伤保护机制,抑制细胞炎症反应信号传递至核NF-κB,细胞可能通过炎症反应进行自我修复,或进一步降低细胞内氧化应激水平。综上所述,HepG2细胞油酸孵育刺激过程伴随严重的氧化应激损伤,过氧化产物会激活NF-κB信号通路。玉竹多糖可能是通过抑制NF-κB信号通路来拮抗细胞内ROS导致的氧化应激损伤,最终达到改善脂质堆积的作用。
