PET/MRI观察朗格汉斯细胞组织细胞增生症
2021-11-24张水花聂婕妤冷晓明
张水花,张 景,韩 佩,聂婕妤,冷晓明,陈 萍*
(1.广州全景医学影像诊断中心核医学部,广东 广州 510000;2.广州医科大学附属第三医院放射科,广东 广州 510150)
朗格汉斯细胞组织细胞增生症(Langerhans cell histiocytosis,LCH)罕见,患者多为儿童[1],组织学表现为朗格汉斯细胞的克隆增殖。朗格汉斯细胞起源于组织细胞树突状细胞,可通过募集协同炎症细胞触发强烈免疫反应[2-3]。LCH临床表现复杂多样,累及多系统时病程易反复,预后与病变累及范围密切相关;影像学早期评估、分型对于改善预后具有重要意义[4]。炎症细胞(如中性粒细胞、单核细胞/巨噬细胞家族)葡萄糖转运体表达水平较高,故可采用18F-FDG PET/CT评估LCH病灶活性并进行分期。PET/MRI兼有高分辨率解剖及功能成像双重优势,近年发展迅速,现已逐渐用于临床。本研究观察11例LCH的PET/MRI表现。
1 资料与方法
1.1 研究对象 回顾性分析2018年5月—2020年12月11例于广州全景医学影像诊断中心就诊的LCH患者,男6例,女5例,年龄1~22岁,中位年龄3岁;其中7例累及全身多系统,4例仅累及骨骼系统或垂体;临床随病变累及范围而表现为垂体柄增厚、骨质破坏、淋巴结增大、颌下腺肿大,甲状腺结节、肺囊泡、肝脏、脾脏增大及软组织受累等。纳入标准:于本院或既往于外院经病理学证实的初诊或复诊LCH患者。排除标准:①PET/MRI资料不完整;②合并风湿免疫病或其他遗传代谢疾病;③存在MR检查禁忌证。检查前患者或其监护人均签署知情同意书。
1.2 仪器与方法 采用Siemens Biography mMR 3.0T PET/MR扫描仪,18F-FDG放射性化学纯度>99%(原子高科股份有限公司)。检查前嘱患者禁食6 h以上,控制其空腹血糖4.5~8.5 mmol/L;对无法配合者酌情予10%水合氯醛口服,剂量0.5~0.8 ml/kg体质量。经肘静脉注射18F-FDG,剂量3.7 MBq/kg体质量,待患者静息60 min后行PET/MR扫描。扫描参数:T1WI,层厚3.0 mm,层间距0.62 mm,成人/儿童FOV 400 mm×400 mm/280 mm×280 mm,矩阵分别为288×216、224×168;T2WI,采用光谱衰减翻转恢复(spectral attenuated in-version recovery,SPAIR)脂肪抑制序列,层厚4~6 mm,层间距0.62 mm,头部FOV 260 mm×260 mm,成人/儿童颈部FOV 380 mm×380 mm/320 mm ×320 mm,胸部至股骨上段FOV 400 mm×400 mm/320 mm×320 mm,股骨至足FOV 280 mm×280 mm,矩阵320×320;弥散加权成像(diffusion weighted imaging,DWI),层厚6 mm,层间距0,成人/儿童FOV 400 mm×286 mm/270 mm×192 mm,矩阵134×134/118×118,b=50、800 s/m2;同步获得PET及MRI数据,共5个床位,扫描范围自颅顶至足部。
1.3 图像分析 由2名具有5年以上工作经验的核医学医师独立阅片,意见不同时由科室会诊讨论决定。观察病灶数目、部位及形态;采用Siemens Syngo.via后处理工作站,于病灶摄取最高区域自动勾画ROI,获得病灶最大标准摄取值(maximum standard uptake value,SUVmax)。
2 结果
11例LCH中,PET/MRI共检出40个病灶;其中8例症状或影像学未缓解,3例(病例2、3、11)为影像学缓解病例。7例(病例4~10)病变累及全身多系统;3例(病例1~3)仅累及骨骼,其中2例(病例2、3)为复诊患者,病灶FDG未见增高;1例复诊患者(病例11)病变仅累及垂体,PET/MRI示神经垂体高信号消失,垂体柄增厚减轻,FDG未见摄取增高。PET/MRI共于8例未缓解病例中检出38个病灶,多呈不同程度FDG摄取增高,SUVmax为1.23~13.00。见图1、2及表1。

表1 11例LCH患者一般资料及PET/MRI表现
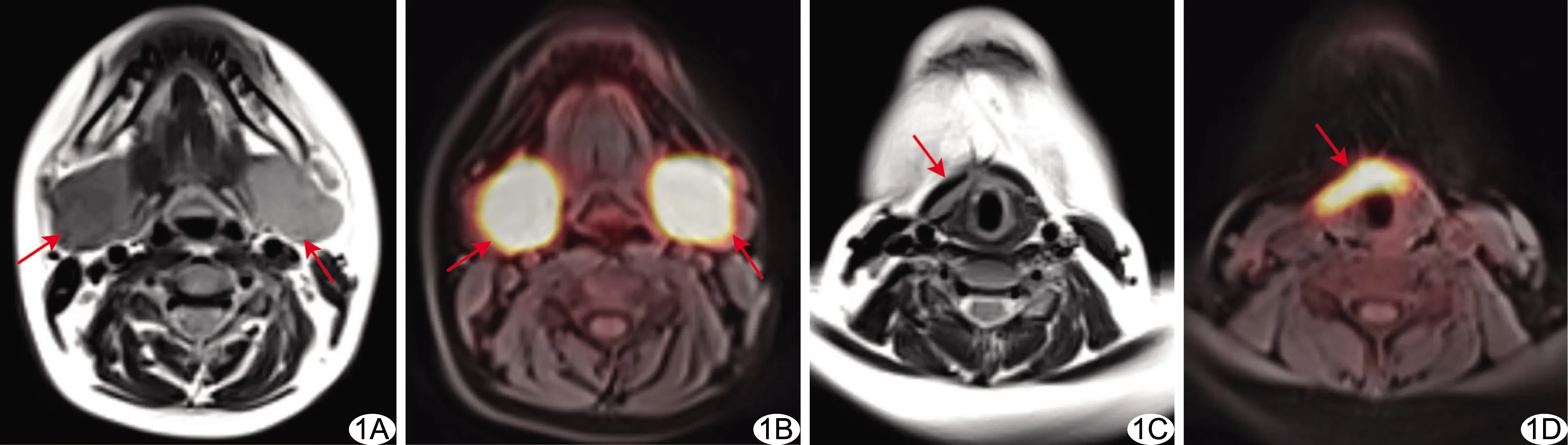
图1 患儿男,12岁,多系统LCH(病例8) A、B.MR T2WI(A)示双颌下腺(箭)对侧性增大,呈高信号,PET/T1WI融合图(B)示病灶FDG摄取增高(箭);C、D.MR T2WI(C)显示颈前软组织增厚(箭),呈高信号,PET/T1WI融合图(D)示病灶FDG摄取增高(箭)
3 讨论
LCH临床可分为单系统、高危多系统、低危多系统及特定部位4种类型[5-7]。单系统LCH主要表现为树突状细胞良性增生,预后良好;多系统LCH则呈侵袭性生长,可迅速累及多个器官及系统,预后较差,易复发[6]。本组11例LCH中,7例累及全身多系统,3例仅累及骨骼,1例仅累及垂体;8例未缓解病例中,PET/MRI共显示38个病灶,多表现为不同程度FDG摄取增高。

图2 患者女,22岁,多系统LCH(病例7) A、B.MR T2WI(A)显示甲状腺左叶结节呈高信号(箭),PET/T1WI融合图(B)示病灶FDG摄取增高(箭);C、D.治疗1年后复查,脂肪抑制T2WI(C)示L5信号增高(箭),伴周围软组织反应性水肿,PET/T1WI融合图(D)示病灶FDG摄取增高(箭)
LCH具有炎症与肿瘤的双重特征[8],累及骨骼系统时,应与骨原发恶性肿瘤或转移癌相鉴别。本组1例(病例4)术前CT及MRI均诊断为肩胛骨恶性肿瘤,术后病理诊断为LCH;全身PET/MRI评估发现腋窝淋巴结肿大及足舟骨病变,提示多系统LCH。LCH累及垂体时易误诊为鞍区生殖细胞肿瘤,本组1例(病例8)尿崩症患儿经外院MRI诊断为鞍区生殖细胞肿瘤,经立体定向伽马射线放射治疗后,PET/MRI提示多系统LCH,后经颌下腺活检病理证实;本次PET/MRI于垂体柄强化区未见FDG摄取增高,推测系因放疗抑制朗格汉斯细胞克隆活性状态,进而降低了炎性细胞浸润,使病灶活性改变早于MRI形态学改变。MUELLER等[9]认为摄取18F-FDG是活动性病变的标志,而病变水肿及强化常由治疗后组织重塑或再生引起。MRI具有高空间分辨率及软组织分辨率,可检出微小骨浸润,对于平均直径≤1.2 cm的骨髓病变,其整体敏感度高于PET[9]。本组1例(病例9)T2WI可见髓内高信号病变,但PET未见FDG摄取增高,可能与朗格汉斯细胞克隆增殖及炎性细胞浸润程度低和病变侵袭性较低,以及髓内病变较小有关。此外,病变椎体显著或完全塌陷时,病变组织代谢趋于不活跃,FDG异常摄取可能消失。本组1例(病例1)PET/MRI提示椎体塌陷病变,但FDG未见摄取增高,与既往报道[10]相符。LCH累及肺部主要表现为结节、囊泡或伴发肺间质改变[11],本组2例(病例7、8)LCH肺部病变均表现为多发囊泡。许秦风等[12]认为表现为肺部结节的LCH经治疗后可缩小或消失,而囊泡的产生和发展则不可逆;但本组1例(病例7)肺部多发囊泡经治疗后消失,与之相悖,有待进一步观察、验证。
除诊断及分型外,LCH管理中的另一项主要挑战为监测治疗反应及评估预后。LCH可自发消退,也可快速进展甚至导致患者死亡,亦可产生慢性后遗症或反复发作[13]。本组1例(病例7)PET/MRI初诊为多系统LCH,首次疗程结束时,甲状腺左叶及右侧髂骨病变缓解,新发L5骨质破坏伴周围软组织反应性水肿;经激素、化学治疗及手术综合治疗2年后全身无活动性病变,继发双侧股骨头早期缺血坏死及体脂增高。
LCH患者预后取决于危险器官(肝、脾、造血系统)受累情况及其对治疗的反应性。常规影像学检查如X线、CT及MRI通常仅针对某些层面或局部病变,而全身成像可作为评价活动性疾病的首选影像学方法[7,9]。全身MRI评价LCH累及骨髓或软组织具有较高敏感度,是辅助进行LCH早期分期、评估中枢神经系统受累程度及制定活检计划的重要影像学手段,但对于评估化学治疗后病变活性的价值有限[9]。另一方面,PET识别化学治疗后病变活性的特异性较高,可避免因误判疾病活性而导致不必要的治疗,且对于风险分层具有重要意义[14]。
综上所述,LCH临床表现多样;一体化PET/MRI 对诊断LCH、分型、分期及监测治疗反应均有较高应用价值,尤其适用于对辐射敏感的年轻人群。但本研究样本量过小,未能分析不同累及部位FDG摄取的差异,亦未行PET/MRI与PET/CT 等的对照研究,有待累积病例加以完善。
