AdipoRon减轻对乙酰氨基酚诱导的小鼠急性肝损伤
2021-11-24何小姣
何小姣,黄 崧
(1.武警重庆总队医院药剂科,重庆 400061;2.陆军军医大学第一附属医院急救创伤中心,重庆 400038)
药物性肝损伤在临床实践中常常发生,其中以非甾体类抗炎药物滥用最为常见[1-2]。对乙酰氨基酚(acetaminophen,APAP)又名扑热息痛,在临床上主要用来解热镇痛、抗炎,然而因患者不遵医嘱、误服或过量使用等,可引起肝小叶中央型细胞坏死,进而引发一系列病理生理学改变,甚至肝衰竭死亡,是引起肝毒性的常见药物之一[3-5]。研究新的肝保护药物对APAP诱导的急性肝损伤具有重要的临床意义。
脂联素是机体含量丰富的脂肪因子,在维持内环境能量平衡中发挥着关键作用,其可通过抑制糖异生而提高胰岛素的敏感性,被认为是治疗糖尿病的有效靶点[6-7]。多项国内外研究显示,脂联素在肥胖、代谢综合征、非酒精性脂肪肝和动脉粥样硬化的治疗中均有良好的效果,能够延缓疾病的发展进程[7-11]。脂联素除了具有代谢调节功能外,在炎症的调节中也起着重要的作用。在肥胖患者中,脂联素的下调与各种炎症标志物的升高有关[12];在脓毒症引起的急性肺损伤、急性缺血性肾损伤以及急性胰腺炎动物模型中,采用脂联素干预均可抑制促炎细胞因子的产生,进而减轻炎症损伤[13-15];另外在体外细胞实验中,脂联素对体外培养的巨噬细胞和内皮细胞均具有抗炎作用[16-17]。然而,因脂联素半衰期短,限制了其在临床上的开发应用。AdipoRon是一种合成且半衰期长的小分子脂联素受体激动剂,其药物作用与脂联素在治疗糖尿病和动脉粥样硬化中的有益作用相似,并且也能减轻脊髓损伤动物的炎症反应[18-20]。而其在APAP诱导的急性肝损伤中的作用及相关机制未见报道。因此,本研究探讨AdipoRon对APAP诱导的急性肝损伤、炎症反应、肝细胞凋亡和动物生存率的影响,以期为临床提供参考。
1 材料与方法
1.1 主要试剂与仪器
APAP和AdipoRon购自Sigma公司(美国);丙氨酸转氨酶(alanine transaminase,ALT)、天冬氨酸转氨酶(aspartate transaminase,AST)、总胆红素(total bilirubin,TBIL)、乳酸脱氢酶(lactate dehydrogenase,LDH)、髓过氧化物酶(myeloperoxidase,MPO)检测试剂盒购自南京建成生物工程研究所;肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)酶联免疫吸附试验检测试剂盒购自深圳欣博盛生物科技有限公司;内参β-actin、Cleaved-Caspase-3一抗及二抗均购自Cell Signaling公司;凋亡原位检测试剂盒购自美国罗氏公司;BCA蛋白定量分析试剂盒购自美国Thermo公司;化学发光ECL试剂盒购自美国Advantsta公司。
1.2 实验动物与分组
雄性C57BL/6小鼠128只,6~8周龄,体质量18~22 g,购于陆军军医大学实验动物中心,实验动物生产许可证号:SCXK(渝)2017-0002。在IVC动物房内给予水、食物1周,12 h昼夜交替,环境温度控制在(24±2)℃,待小鼠适应环境后进行实验。所有动物实验操作均严格按照大学动物实验中心动物伦理规范进行,并经动物伦理委员会批准。
动物实验分组:48只C57BL/6小鼠按随机数字表法分为对照组、AdipoRon组、APAP模型组、AdipoRon低剂量(50 mg/kg)+APAP模型组、AdipoRon中剂量(100 mg/kg)+APAP模型组和AdipoRon高剂量(200 mg/kg)+APAP模型组,每组8只。AdipoRon低剂量+APAP模型组、AdipoRon中剂量+APAP模型组和AdipoRon高剂量+APAP模型组小鼠分别每天固定时间给予50、100和200 mg/kg DSMO∶食用玉米油(1∶9)溶剂灌胃,AdipoRon组给予200 mg/kg DSMO∶食用玉米油溶剂灌胃,对照组和APAP模型组给予等量DSMO∶食用玉米油溶剂灌胃,连续3 d后,参考文献[2]建立急性肝损伤模型,禁食水后腹腔注射APAP(400 mg/kg),6 h后麻醉处死小鼠,收集血清和肝组织备用。
1.3 生存实验
80只小鼠按随机数字表法分为4组,每组20只:正常对照组(给予等量DSMO∶食用玉米油溶剂)、AdipoRon组(200 mg/kg)、APAP模型组(400 mg/kg)、AdipoRon(200 mg/kg)+APAP模型组,观察并记录各组小鼠72 h生存率,采用Kaplan-Meier法绘制小鼠生存率曲线图。
1.4 肝损伤相关指标检测
按照试剂盒说明书操作要求,首先制备上样样本(根据实际情况稀释相应倍数),依次加样与相应试剂,直至最后一步显色,酶标仪下相应波长得到OD值,根据换算公式得出ALT、AST、LDH、TBIL和MPO的含量。
1.5 酶联免疫吸附试验检测血清TNF-α含量
按酶联免疫吸附试验检测试剂盒说明书提前制作加样样本,根据操作步骤,依次完成各种试剂与上样样本的加样,直至最后一步显色,记录酶标仪450 nm波长下各样本OD值,根据标准曲线换算各样本实际含量。
1.6 HE染色观察肝组织结构
在4%多聚甲醛中固定肝组织,依序脱水、包埋、切片、HE染色、封片,光学显微镜下观察肝组织结构并记录保存。
1.7 TUNEL染色检测细胞凋亡
按照产品说明及操作步骤,逐步完成每一项操作,直至末端转移酶反应最终产生深棕色沉淀物(即凋亡细胞的细胞核染成棕黄色),然后切片用苏木精轻度复染,光学显微镜下观察组织结构并记录保存。
1.8 Western blot法检测Caspase-3蛋白水平
根据蛋白提取试剂盒说明书,称取相同质量于-80 ℃储存的肝组织,冰上超声匀浆,以低温高速12 000 g离心10 min后,取上清液制作蛋白上样样本,制备12.5%浓度的SDS-PAGE胶,恒压80 V电泳,250 mA电流电转至NC膜,5%脱脂牛奶封闭2 h,4 ℃冰箱孵育一抗(1∶1 000或1∶4 000)过夜,第2天室温下与相应二抗(1∶2 000)孵育,ECL发光,U盘保存图片,后期根据图片中条带灰度值检测目的蛋白相对表达量。
1.9 统计学方法
2 结果
2.1 AdipoRon改善APAP诱导的急性肝损伤
与对照组相比,AdipoRon组小鼠血清各生化指标均无明显变化(P>0.05),APAP模型组ALT、AST、TBIL和LDH水平明显升高(P<0.05);与APAP模型组相比,AdipoRon高剂量+APAP模型组的ALT、AST、TBIL和LDH水平均下降,AdipoRon中剂量+APAP模型组的ALT、AST水平下降,AdipoRon低剂量+APAP模型组仅AST水平下降,差异具有统计学意义(P<0.05),见表1。HE染色结果显示,对照组肝细胞形态正常,无变性坏死,肝小叶结构完整清晰,肝索、肝窦分界明显;APAP模型组肝组织局部肝细胞肿胀、变性坏死,小叶结构遭到明显破坏,肝条索结构模糊甚至消失,中央静脉或其周围存在大量红细胞及相应坏死病灶,并伴随炎性细胞浸润;AdipoRon低、中、高剂量处理后各组肝组织充血肿胀减轻,肝条索走向变清晰,细胞坏死面积明显减少,表明APAP可使肝组织产生严重的组织病理学变化,而AdipoRon干预后可改善组织病理学表现(图1)。在动物生存率分析实验中,因AdipoRon(200 mg/kg)+APAP模型组生化指标均显著降低,故采用高剂量AdipoRon干预做生存率分析,结果显示AdipoRon(200 mg/kg)+APAP模型组72 h的生存率高于APAP模型组,差异具有统计学意义(P<0.05),见图2。
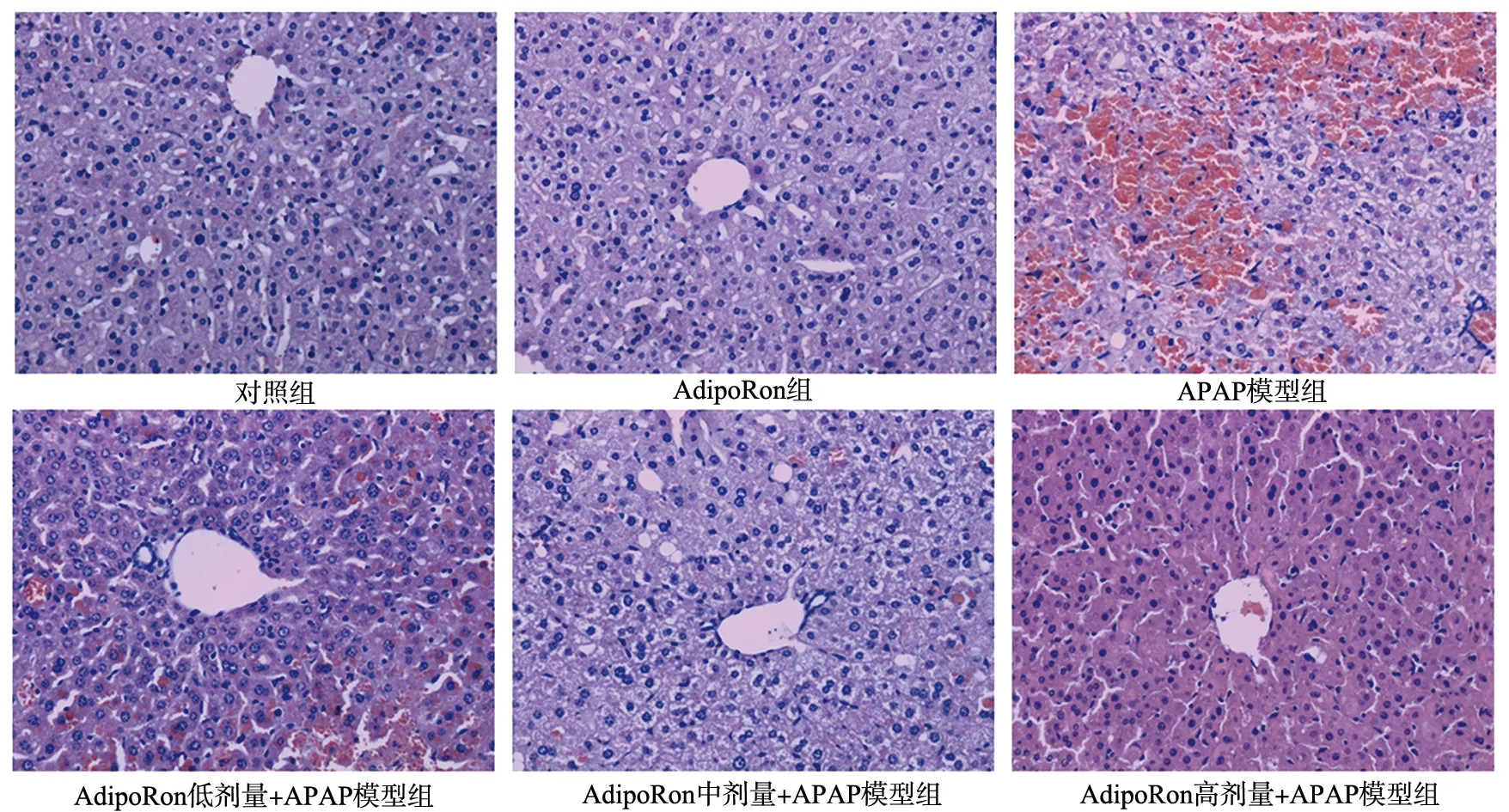
图1 各组小鼠肝组织HE染色结果(×200)
表1 各组小鼠血清ALT、AST、TBIL、LDH含量比较

*:与APAP模型组比较,P<0.05
2.2 AdipoRon减轻APAP诱导的急性肝损伤炎症反应
与对照组相比,APAP模型组小鼠血清TNF-α水平明显升高(P<0.05);与APAP模型组相比,AdipoRon高剂量+APAP模型组血清TNF-α水平明显降低(P<0.05),而AdipoRon中、低剂量处理组血清TNF-α水平无明显变化(P>0.05)。与对照组相比,APAP模型组肝组织中MPO水平明显升高;与APAP模型组相比,AdipoRon高剂量+APAP模型组肝组织中MPO水平降低,而AdipoRon中、低剂量处理组MPO水平无明显变化(P>0.05),见表2。

表2 各组小鼠TNF-α、MPO含量比较
2.3 AdipoRon通过抑制Caspases-3蛋白激活减轻肝细胞凋亡
APAP模型组肝组织中可见大量TUNEL阳性的凋亡细胞,细胞核呈褐色;AdipoRon高剂量+APAP模型组细胞核中TUNEL阳性细胞的数量减少(图3)。Western blot结果表明,APAP模型组Cleaved-Caspase-3含量高于对照组,而AdipoRon高剂量+APAP模型组Cleaved-Caspase-3含量低于APAP模型组(P<0.05),见图4。
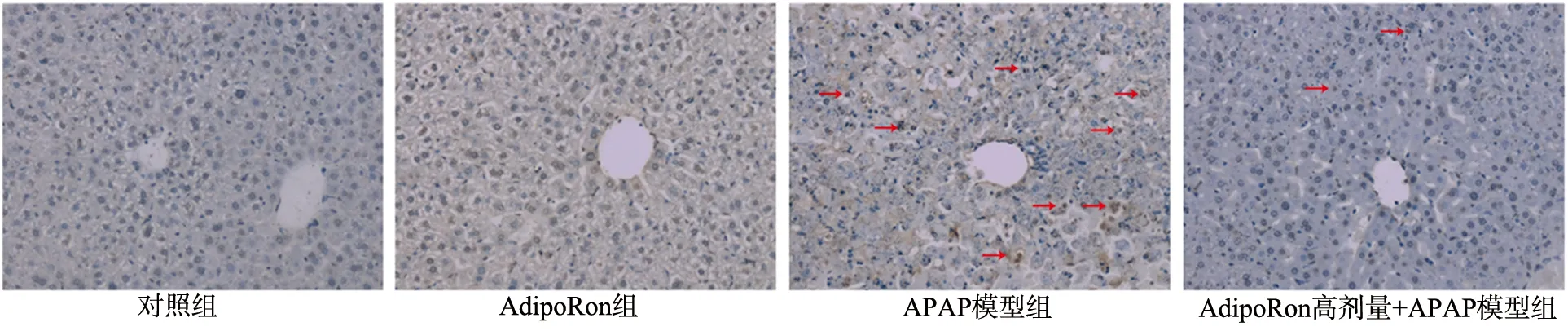
图3 各组小鼠肝组织TUNEL染色结果比较(×200)
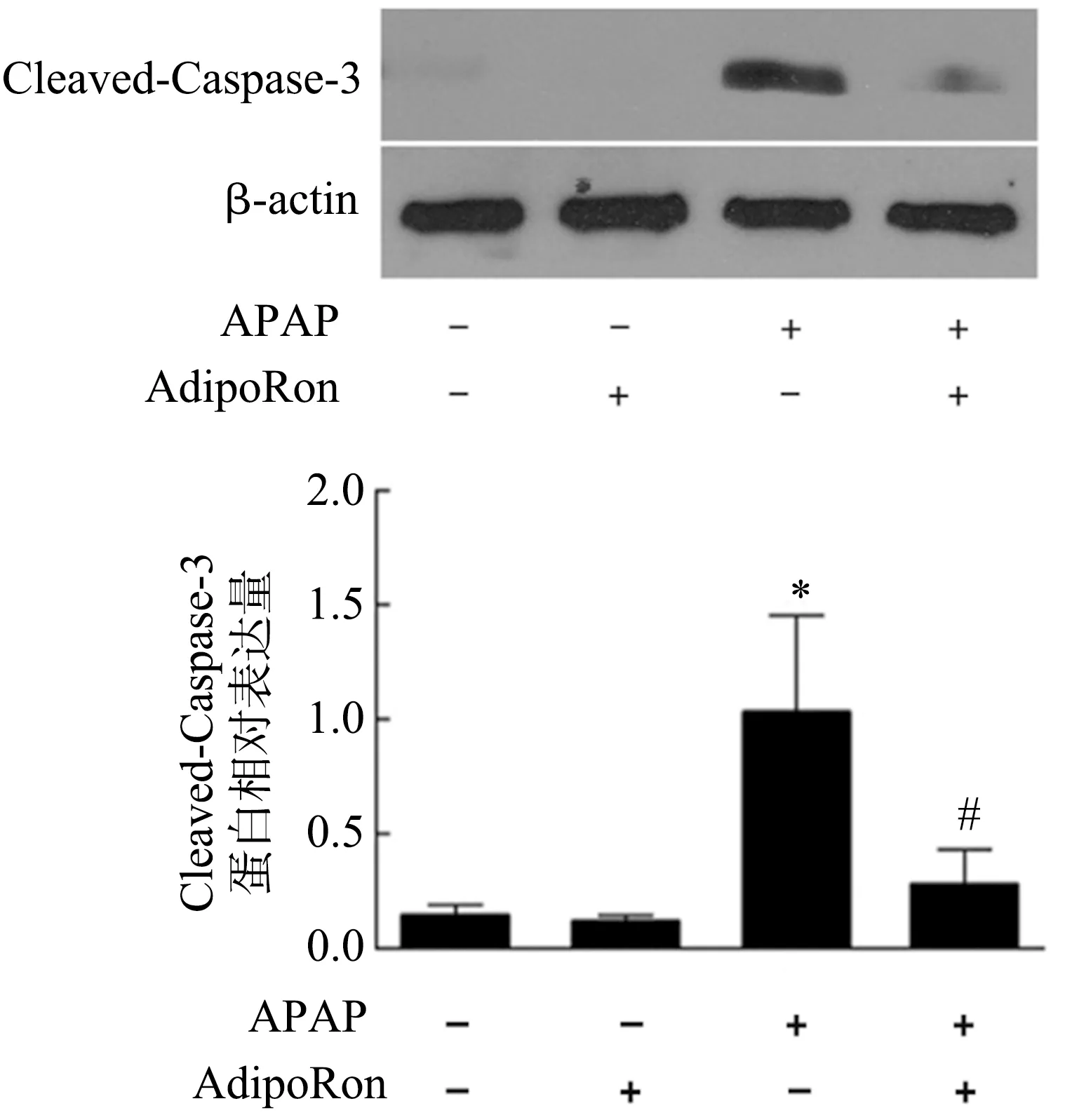
*:与对照组比较,P<0.05;#:与APAP模型组比较,P<0.05
3 讨论
肝是人体最大的代谢与免疫器官,在维护机体健康中发挥着重要作用[21]。药物性肝损伤在临床上时有发生,而APAP作为解热镇痛药物,在临床实践中被广泛使用,若使用不当,可能会引发急性肝细胞损伤,甚至导致不可逆性肝衰竭而死亡[22]。因此,研究药物性肝损伤的发病机理及新型保肝药物对于制定临床治疗策略尤为重要。
脂联素是一种重要的脂肪因子,在代谢和炎症中发挥着多种调节作用[7-15]。有研究发现,在肥胖患者中脂联素不仅可以调节糖脂代谢,而且可以抑制各种炎症标志物的升高[12]。还有研究显示,脂联素可以在体内外发挥抗炎作用[13-17]。然而脂联素半衰期短,导致其临床开发应用受到限制。AdipoRon是一种小分子脂联素受体激动剂,可在糖尿病等多种代谢性疾病中发挥改善作用[18]。多项研究显示AdipoRon可减轻炎症损伤,抑制促炎细胞因子的分泌[12-15]。本研究发现,AdipoRon能抑制APAP诱导的小鼠ALT、AST、TBIL和LDH升高,减轻肝细胞损伤,减少炎症因子分泌,同时提高小鼠生存率。因此,AdipoRon可能在APAP诱导的急性肝损伤中发挥保护作用,这对于临床肝保护药物研发具有潜在的应用价值。
在APAP诱导的急性肝损伤模型中,促炎细胞因子TNF-α的诱导在肝损伤的病理发生发展过程中起着非常重要的作用[23]。而体内外的多项研究均显示AdipoRon具有抗炎作用[13-17],且AdipoRon对肾小管上皮细胞、心肌细胞以及内皮细胞中TNF-α的产生均具有抑制作用[17,24-25]。在本研究中,AdipoRon可抑制APAP诱导产生的TNF-α,其结果与MPO的结果相一致,MPO活性的增加被认为是炎症损伤中中性粒细胞活化和积聚的代表性指标,AdipoRon高剂量+APAP模型组MPO的含量显著低于APAP模型组,表明AdipoRon的抗炎作用能够减轻APAP诱导的急性肝损伤。
脂联素不仅具有抗炎作用,而且在多种疾病中发挥着抗凋亡作用。多项研究表明,脂联素可以减轻血管内皮细胞、神经元细胞的凋亡[26-28]。而在动物实验中也表现出相同的作用,其可抑制缺血后心肌细胞凋亡和糖尿病诱导的肾细胞凋亡[29-30]。本研究采用AdipoRon预处理后,Western blot结果显示AdipoRon可抑制肝Caspases凋亡蛋白的激活,抑制Caspase-3的裂解,并减少TUNEL阳性细胞的数量。因此,AdipoRon对APAP诱导的急性肝损伤的保护作用可能与其抗炎和抗凋亡有关。
综上所述,AdipoRon可降低APAP诱导的炎症反应和肝细胞凋亡,从而减轻肝损伤,提高生存率。AdipoRon可能成为一种治疗急性肝炎的潜在药物,但其在急性肝炎中起保护作用的分子机制仍有待进一步研究。
