酶法测定尿液草酸和枸橼酸的方法学性能验证及分析前影响因素研究*
2021-11-24秦东芳龚珂王学晶张曼北京大学民航临床医学院检验科北京0023首都医科大学附属北京世纪坛医院检验中心北京00038尿液细胞分子诊断北京市重点实验室北京00038
秦东芳,龚珂,王学晶,张曼(.北京大学民航临床医学院检验科,北京0023;2.首都医科大学附属北京世纪坛医院检验中心,北京00038;3.尿液细胞分子诊断北京市重点实验室,北京00038)
我国肾结石发病率为5.8%,尤其某些南方地区可高达10%[1]。该病复发率高,给家庭和社会都带来巨大的经济负担[2]。肾结石患者多伴有不同程度的代谢异常,如高钙尿、高草酸尿、高尿酸尿和低枸橼酸尿等。研究表明,伴有代谢异常的结石患者,其复发率要高于无代谢异常的患者[3]。欧洲泌尿外科学会(EAU)指南[4]和亚洲泌尿外科学会(AUA)指南[5]均建议对复发高风险的结石患者进行代谢评估,其中最主要就是24 h尿液成石危险因素分析。我国学者也推荐对于结石复发高风险人群进行血、尿代谢物的评估[6]。
草酸和枸橼酸等小分子物质检测可能受到较多的干扰,尤其草酸盐溶解度低,还受到维生素C等草酸前体物质转化的影响[7]。近期研究表明[8],即使是国际著名的医院实验室测量同一份样本,也会因方法学和样本前处理不同,导致草酸测量结果差异很大。因此,采用经过验证的样本前处理方法以及性能良好的检测方法,其测量结果方可准确评估患者的代谢情况,也可以在不同的研究中进行比较。
北京协和医院泌尿外科团队2017年建立了检测尿液草酸和枸橼酸的液相色谱串联质谱(LC-MS/MS)方法,建立了泌尿系结石代谢评估数据库并开展长期追踪研究[9-11]。相对于质谱法,酶法适用范围更广。本研究将对酶法检测尿液草酸和枸橼酸的分析前因素和性能进行探讨,以保证测量结果具有准确性、可比性,为将来用于结石风险分层、健康管理,以及制定相关共识指南打下良好的实验室基础。
1 材料与方法
1.1 主要仪器与试剂 7600全自动生化分析仪(日本日立公司);草酸酶法检测试剂盒及配套校准品及质控品(批号32395,BioSystems公司);枸橼酸酶法检测试剂盒及配套校准品及质控品(批号2032019002AC,重庆博士泰公司)。
1.2 精密度和正确度验证
1.2.1 验证物质 采用中国计量院草酸标准物质BWZ8042-2016(标准值:0.199 7 mol/L,约8 990.50 mg/L)和枸橼酸标准物质BWZ8040-2016(标准值2.00%,约95.18 mmol/L)。用纯水稀释得到1水平,厂商提供的质控品作为2水平,分别分装15份,于-20℃保存,用于精密度验证。上述标准物质用纯水经倍比稀释得到低、高2浓度水溶液,各分装10份,于-20℃保存,用于正确度验证。
1.2.2 验证方法 参考行业标准WS/T 492—2016[12]文件方案,将精密度验证物质连续测定5 d,每天测定3次,分别计算2个水平的重复性及实验室内不精密度,评价其精密度水平;将正确度验证物质连续测定5 d,每天测定2次,计算均值、标准差、偏倚以及均值的95%置信区间。
1.3 线性范围验证
1.3.1 线性范围验证物质 将标准物质经倍比稀释得到的H草酸(浓度约210 mg/L)和L草酸(浓度约1.6 mg/L)、H枸橼酸(浓度约17.85 mmol/L)和L枸橼酸(浓度约0.19 mmol/L)分别按一定体积比配制成不同浓度梯度的样品,进行草酸和枸橼酸的线性范围验证。
1.3.2 线性范围验证方法 参考行业标准WS/T 408—2012[13]文件方案,将H和L按H、5H∶1L、4H∶2L、3H∶3L、2H∶4L、1H∶5L、L制成7个浓度梯度的样本,每一浓度重复测量3次,检查离群值和重复性,计算均值。用SPSS软件分别拟合一次、二次和三次多项式方程,判断线性。
1.4 干扰实验
1.4.1 干扰物质 用纯水破坏洗涤红细胞,制成系列浓度的血红蛋白干扰物质。采用北京柏定公司总蛋白标准品水溶液,稀释后制成系列浓度总蛋白干扰物质,用于干扰验证。
1.4.2 干扰验证方法 根据行业标准WS/T 416—2013《干扰实验指南》[14],将标准干扰物与不同浓度尿液标本以1∶19的比例混合,每一浓度重复测量3次,计算均值和偏倚。
1.5 分析前影响因素评价
1.5.1 样本来源 选取北京大学民航临床医学院检验科当日剩余尿液标本。
1.5.2 放置时间和温度对草酸和枸橼酸浓度的影响 不加任何防腐剂,将尿液分别置于室温、4℃和-20℃保存24 h。室温和4℃保存的标本分别在0、2、4、8、24 h各测量1次,-20℃保存的标本在24 h测量1次。以室温0 h为对照,比较24 h内尿液草酸和枸橼酸浓度变化情况。
1.5.3 尿液前处理方法的探讨 将20例无结石对照者和20例泌尿系结石患者的随机尿液标本,一组按100∶1和50∶1的比例即刻加入6 mol/L HCl后室温保存24 h,另一组于室温24 h后再分别按100∶1和50∶1的比例加入6 mol/L HCl。比较不同时间、加入不同剂量HCl对草酸和枸橼酸测定的影响。
1.5.4 标本冻存稳定性评价 收集24 h尿液当日剩余标本,每例分装6份,1份于当天检测草酸和枸橼酸,剩余冻存于-20℃,分别于1、3、7、14、30 d时检测草酸和枸橼酸,检测前按50∶1的比例加入6 mol/L HCl酸化。
1.6 统计学分析 采用excel和SPSS 20.0软件进行统计学分析。符合正态分布的资料以¯x±s表示,用重复测量资料的方差分析和t检验进行数据分析;以P<0.05为有统计学意义。
2 结果
2.1 精密度和正确度验证 由于行业标准尚未规定草酸和枸橼酸的精密度和正确度质量指标,故根据文献[15],草酸以小于1/2 24 h尿草酸基于生物学变异的不精密度范围(10.7%)和允许偏倚(5.9%)作为本研究的性能验证标准,枸橼酸则以不精密度5%和偏倚5%作为质量标准,以保证临床可接受。
草酸和枸橼酸试剂的精密度和正确度验证结果见表1、2。草酸的不精密度<10.7%,枸橼酸的不精密度<5%,均可满足临床应用。草酸和枸橼酸2个水平的标准物质测量结果显示,测量均值的95%置信区间均覆盖验证物质赋值。草酸的偏倚<5.9%,枸橼酸的偏倚<5%,测定结果在允许范围内。
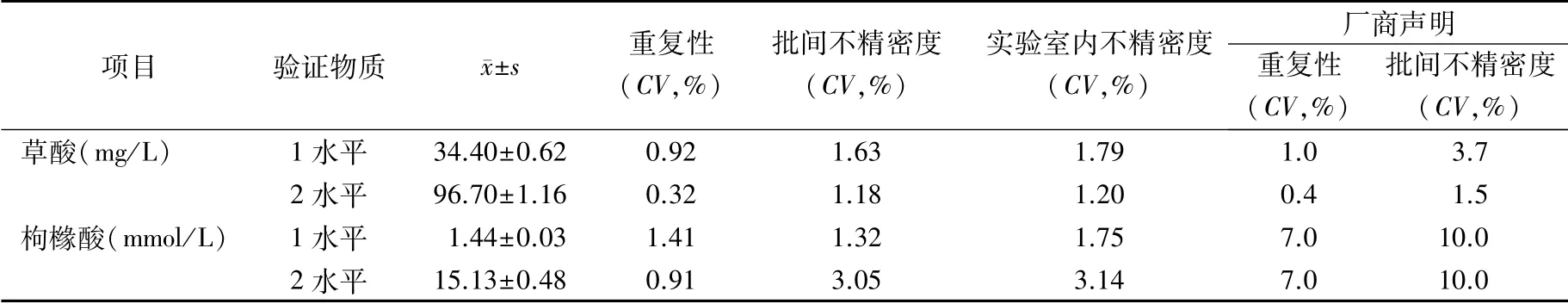
表1 草酸和枸橼酸酶法试剂的精密度验证

表2 草酸和枸橼酸酶法试剂的正确度验证
2.2 线性范围验证 草酸线性验证最佳拟合方程为一次方程Y=0.993X-0.216(R2=0.999,P<0.001),理论值与实测值的平均偏差为1.54%,在1.65~210.71 mg/L范围内线性良好,略优于厂商声明的线性范围(1.8~180 mg/L)。
枸橼酸线性验证最佳拟合方程为一次方程Y=0.953X+0.044(R2=0.999,P<0.001),理论值与实测值平均偏差为4.99%,在0.19~17.85 mmol/L范围内线性良好,也优于厂商声明的线性范围(0.2~13 mmol/L)。
2.3 干扰实验 见表3、4。以偏倚<10%为干扰判定标准。血红蛋白干扰与草酸和枸橼酸的浓度有关,高浓度下抗干扰性更强,低浓度时易受干扰。对高浓度草酸,血红蛋白干扰的临界值为2 g/L,但低浓度时仅为1 g/L。对于高浓度枸橼酸,血红蛋白干扰的临界值为5 g/L,但低浓度时为3 g/L。总蛋白为1.5 g/L以下时对草酸和枸橼酸均没有干扰。
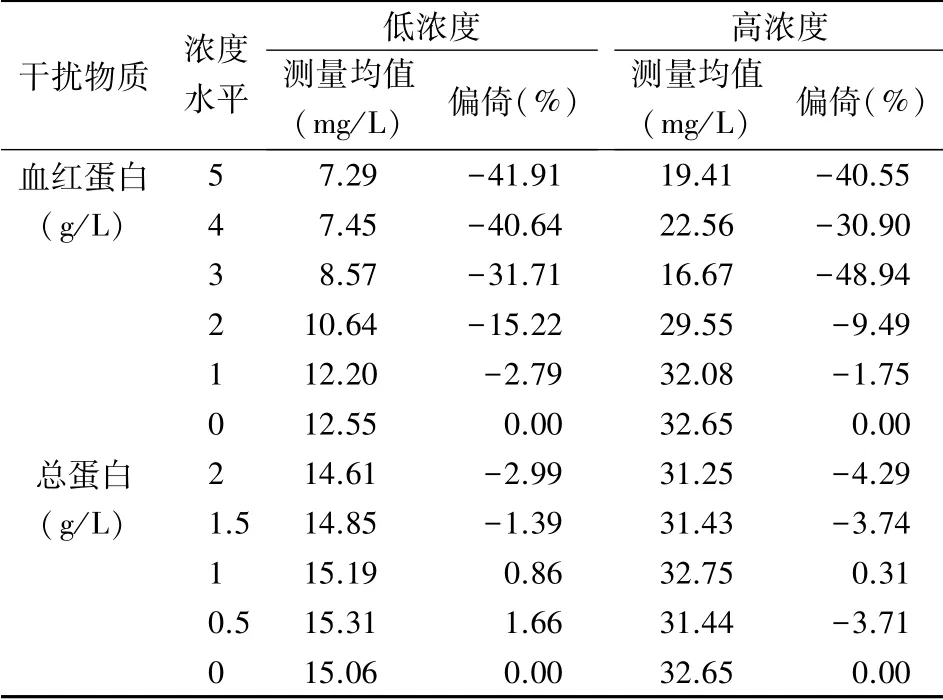
表3 血红蛋白和总蛋白对草酸检测的干扰

表4 血红蛋白和总蛋白对枸橼酸检测的干扰
2.4 分析前影响因素评价
2.4.1 放置时间及温度对尿液草酸和枸橼酸浓度的影响 见表5。室温和4℃条件下,不加任何防腐剂,放置0、2、4、8、24 h测得的草酸浓度和枸橼酸浓度差异均有统计学意义(P均<0.05)。2 h后草酸浓度即明显降低。枸橼酸在室温和4℃放置24 h的平均变化分别为3.33%和2.67%,比较稳定。-20℃保存24 h后,草酸浓度[(17.24±3.56)mg/L]显著低于0 h(P<0.05),而枸橼酸浓度[(2.91±2.31)mmol/L]与0 h差异无统计学意义(P>0.05)。

表5 不同条件下保存24 h对草酸和枸橼酸浓度的影响
2.4.2 尿液前处理方法的探讨 每例标本分为4组(A~D),分别按100∶1(即刻,A)、50∶1(即刻,B)、100∶1(24 h后,C)和50∶1(24 h后,D)加入6 mol/L HCl酸化。无论在无结石对照组还是结石组,草酸D组测量结果与B组差异均无统计学意义(P均>0.05),而A组、C组与B组相比均降低(P均<0.05)(图1a),枸橼酸A、C、D组与B组相比差异均无统计学意义(P均>0.05)(图1b)。
Bland-Altman分析显示,草酸B组和D组检测结果有97.5%(39/40)的点在95%一致性界限范围内(图1c),枸橼酸B组和D组检测结果有95.0%(38/40)的点在95%一致性界限范围内(图1d)。因此,在尿液收集即刻和24 h后按50∶1的比例加入6 mol/L HCl两种处理方法具有较好的一致性。

图1 标本收集前后加入不同比例HCl对草酸和枸橼酸浓度的影响
2.4.3 标本冻存稳定性评价 尿液标本在-20℃条件下冻存1、3、7、14、30 d。标本解冻后,按50∶1的比例加入6 mol/L HCl酸化,分别检测草酸和枸橼酸,结果见图2和图3。与0 d时相比,检测结果的偏倚均在-10%~10%之间,稳定性良好,临床样本不能及时检测时可在-20℃条件保存30 d。

图2 草酸在-20℃冻存条件下的稳定性

图3 枸橼酸在-20℃冻存条件下的稳定性
3 讨论
本研究系统评价了两种酶法检测尿液草酸和枸橼酸的试剂性能,以及分析前尿液标本的前处理对于被测量的影响。本研究草酸和枸橼酸试剂盒分别在1.8~180 mg/L和0.2~13 mmol/L范围内具有良好的线性关系。与协和医院团队[9-10]建立的LC-MS/MS方法比较,本研究采用的酶法线性范围更宽。初步在20例对照者和20例肾结石的人群中进行草酸和枸橼酸的测定,草酸的范围为7.89~41.36 mg/L,枸橼酸的范围为0.4~5.7 mmol/L,均在酶法的线性范围内,而部分枸橼酸浓度则超出了LC-MS/MS法的线性范围。对草酸和枸橼酸的LC-MS/MS法和酶法检测结果进行的比对显示,二者准确度相当(N=20,R值分别为0.93和0.97)[9-10]。酶法检测草酸和枸橼酸具有在临床推广使用的可靠性能。本团队基于酶法初步对77例肾结石患者的24 h尿液代谢评估显示,低枸橼酸尿为最常见的代谢异常,占80.5%,33.8%存在高草酸排泄,为寻找病因和制定预防策略提供了依据。
检测尿液草酸时,不同的实验室采用不同的前处理方法,包括过滤、超速离心等,目的是为了去除可能干扰。我们探讨了血红蛋白和总蛋白对尿液草酸和枸橼酸酶法检测的干扰。研究发现,枸橼酸检测方法相对抗干扰能力较强,而血红蛋白对尿液草酸检测干扰较大。血红蛋白浓度超过2 g/L时,将显著低估尿液草酸浓度,可能造成临床上对草酸代谢异常的误诊。临床上结石患者可能伴随其他疾病,因此,应加强试剂盒抗干扰能力,或者制定合适的前处理方法,来保证被测量不受干扰。
国外指南[4-5]建议高复发风险的尿石症患者连续收集两次24 h尿液标本进行代谢评估,而24 h尿液收集和保存对于草酸和枸橼酸检测的准确性非常重要。本研究发现,在不加任何防腐剂的前提下,无论室温还是4℃保存,24 h后测得的草酸浓度均显著降低。这可能是由于尿液中草酸盐溶解度低,而酸性溶液不但有利于草酸盐溶解,还可有效抑制维生素C等草酸前体物质向草酸转化[7]。欧洲泌尿外科指南[16]、中国泌尿外科疾病诊断指南[17]和全国临床检验操作规程[18]均要求用于草酸和枸橼酸检测的24 h尿液标本需用HCl保存。
Braiotta等[19]认为按照100∶1的比例加入HCl,无论在24 h尿液收集前还是收集后,对于草酸浓度的检测没有区别。但是本研究中按100∶1的比例加入6 mol/L HCl,无论收集即刻还是24 h后酸化,均不能使尿液中草酸盐完全溶解,导致检测结果偏低;按照50∶1的比例加入6 mol/L HCl,无论在尿液收集即刻还是收集后24 h加入,均可保证草酸浓度稳定,与Ferraz等[20]得出的结论一致。这可能是所用HCl的浓度不同所致。Ferraz等[20]发现尿液收集24 h后再按50∶1的比例加入6 mol/L HCl酸化测得的枸橼酸浓度轻微下降(健康对照5.9%,结石样本3.1%),但小于实验方法的总变异系数,不会影响临床低枸橼酸尿症的诊断。
在临床实践中,尿石症患者的代谢评估需要用24 h尿液检测一系列项目,如pH、钾、钠和氯要直接检测,而检测尿酸则需碱化尿液。若24 h尿液收集前加入酸,则不能检测尿酸等其他项目。本研究发现,尿液收集24 h后再酸化不影响草酸和枸橼酸测量,更具实用性,保证患者留取一次24 h尿液可检测多种代谢标志物。
综上,尿液草酸和枸橼酸的酶法检测试剂盒的性能良好,可以满足临床诊断和治疗监测需求;收集尿液24 h后按50∶1的比例加入6 mol/L HCl酸化可用于草酸和枸橼酸的检测。建议临床实验室常规开展24 h尿液草酸和枸橼酸的检测,辅助肾结石的临床诊疗、风险评估和预防管理,以降低结石发生率和复发率。
