TGFβ1/Smad3信号通路在帕瑞昔布钠对CCI模型大鼠神经病理性疼痛影响中的作用
2021-11-24刘建辉张帮建李定海
刘建辉 张帮建 李定海
(1.攀枝花市仁和区人民医院麻醉科,四川 攀枝花 617061;2.攀枝花市中心医院麻醉科,四川 攀枝花 617067)
神经病理性疼痛是以异常性疼痛、痛觉过敏和自发性疼痛为特征的一种慢性神经系统疾病,发病率约为3.3%~17.9%[1]。神经病理性疼痛主要是由物理性伤害、感染和自身免疫等因素引起的神经损伤或功能障碍导致,严重影响患者的健康和生活质量,且目前仍然缺乏有效的治疗方法。研究发现,帕瑞昔布钠是一种环氧合酶-2(cyclooxygenase-2,COX-2)的高选择性抑制剂,通过抑制花生四烯酸向前列腺素转化,从而降低神经炎症,对于神经病理性疼痛具有较好的缓解作用,但是其作用机制尚缺乏研究[2-3]。多项研究证实,转化生长因子β1(transforming growth factor β1,TGFβ1)可以有效的抑制小胶质细胞增殖和活化,下调神经炎症水平[4-5]。因此,本研究认为TGFβ1及下游的Smad3信号通路可能通过抑制小胶质细胞介导的神经炎症,从而在神经病理性疼痛中发挥负调节效应,并证实帕瑞昔布钠通过激活TGFβ1/Smad3信号通路缓解大鼠神经病理性疼痛,为帕瑞昔布钠的临床治疗提供了新的理论基础。
1 材料与方法
1.1 实验动物与分组 SPF级健康雄性SD大鼠40只,8~12周龄,体重180~220g,购于上海斯莱克实验动物有限责任公司。饲养条件:室内温度22~24℃,相对湿度50%~60%,自然照明,自由饮食和饮水,定时更换垫料和笼具,适应性饲养1周。将SD大鼠按照随机数字表法分为假手术组(SC组)、神经病理性疼痛组(CCI组)、帕瑞昔布钠组(PAR组)、帕瑞昔布钠+TGFβ1抑制剂1D11组(1D11组)4组,每组各10只。本研究对大鼠的处置符合动物伦理要求,并经医院伦理委员会审核同意。
1.2 大鼠神经病理性疼痛模型的构建 参照文献报道[6]通过慢性坐骨神经结扎(chronic sciatic nerve constriction injury,CCI)制备大鼠神经病理性疼痛模型。采用10%的水合氯醛腹腔注射诱导大鼠麻醉,俯卧位固定,剃去右大腿的毛发并消毒,沿股骨外侧纵向切开皮肤,钝性分离肌层,将坐骨神经主干游离出约7 mm,采用4-0铬制肠线分别环扎4道,间隔约1 mm,结扎后可见小腿肌肉轻度颠动,将肌肉与皮肤逐层缝合。
1.3 各组处理方法 SC组仅游离坐骨神经,不进行结扎,CCI组、PAR组与1D11组均行神经病理性疼痛造模。PAR组在造模后给予10 mg/kg的帕瑞昔布钠(4 mg/mL,美国Pfizer公司,批号85820012)腹腔注射,连续7天,给药剂量与时间根据文献报道与预实验确定[3,7]。1D11组在造模后给予10 mg/kg的帕瑞昔布钠与1 mg/kg的1D11(0.4 mg/mL,美国R&D Systems公司,MAB1835)腹腔注射,连续7天。SC组、CCI组则给予同体积的生理盐水腹腔注射。
1.4 行为学检测机械痛阈和热痛阈 分别在术前1天(首次给药前1天)、术后3天(首次给药后3天)、术后7天(首次给药后7天)、术后14天(首次给药后14天)时,对各组大鼠的机械痛阈和热痛阈进行检测。①机械痛阈:将大鼠放置于金属的网格笼子中30 min,使其适应实验环境后,采用Electronic von Frey触觉测痛仪(美国IITC公司,Series 2392)对大鼠的右足底中部进行刺激,当大鼠出现舔足、缩足、抬足等躲避动作时记录刺激力度,即为机械痛阈,每只大鼠重复测量3次,每次间隔时间大于10 s,取平均值。②热痛阈:将大鼠放置于透明的玻璃箱子中30 min,使其适应实验环境后,采用热测痛仪(美国IITC公司,Series 8)对大鼠的右足底中部进行照射,当大鼠出现舔足、缩足、抬足等躲避动作时记录照射时间,即为热痛阈,每只大鼠重复测量3次,每次间隔时间5 min,取平均值。
1.5 蛋白质免疫印迹检测TGFβ1/Smad3信号通路的表达 在术后14d完成行为学检测后,腹腔注射10%水合氯醛300 mg/kg麻醉,将大鼠断头处死,分离手术侧L4-6节段的脊髓背角组织。加入RIPA裂解液(上海碧云天生物技术有限公司,P0013)对组织进行匀浆,4℃下12000 r/min离心10 min,留取上清液,保存于-80℃冰箱。采用BCA蛋白定量试剂盒(上海碧云天生物技术有限公司,P0012)测定蛋白浓度,取30 μg总蛋白进行聚丙烯酰胺凝胶电泳分离,将目的蛋白电转膜至PVDF膜,5%的脱脂奶粉室温封闭2 h,加入一抗4℃过夜孵育,抗体浓度分别为:兔抗鼠TGFβ1(1 μg/mL,英国Abcam公司,ab92486)、兔抗鼠p-Smad3(0.5 μg/mL,英国Abcam公司,ab52903)、兔抗鼠GAPDH(0.5 μg/mL,英国Abcam公司,ab9485)。次日,TBST洗涤3次后,加入辣根过氧化物酶标记的羊抗兔二抗(0.4 μg/mL,英国Abcam公司,ab6721),室温避光孵育1 h,ECL显色后曝光拍照。使用Image Pro Plus 6.0软件测定各条带的灰度值,将对照组中目的蛋白与GAPDH的灰度值之比作为1。
1.6 免疫荧光染色检测钙离子接头蛋白-1(Iba-1)蛋白的表达 采用4%的多聚甲醛对脊髓背角组织进行4℃过夜固定,再使用30%的蔗糖4℃过夜脱水。将样本放入标本托中,加入OCT包埋剂(美国Sakura公司),液氮速冻后,放入-80℃冰箱中保存。使用冰冻切片机对组织样本进行连续切片,制作10 μm厚的冰冻切片,裱于防脱载玻片上。切片用PBS漂洗1次,然后用含有0.3% Triton X-100的5%山羊血清封闭液室温孵育1 h,吸去血清,滴加兔抗鼠Iba-1抗体(6.32 μg/mL,英国Abcam公司,ab178847)4℃过夜孵育。PBS漂洗3次,滴加Alexa Fluor®488标记的山羊抗兔二抗(2 μg/mL,英国Abcam公司,ab150077)室温避光孵育1 h,PBS漂洗3次,滴加含DAPI的抗荧光淬灭封片剂(北京中杉金桥生物技术有限公司)进行封片,荧光显微镜下观察和拍照。使用Image Pro Plus 6.0软件测定各组Iba-1的荧光强度值,将对照组的荧光强度值作为1进行比较。
1.7 实时荧光定量PCR检测炎症因子的水平 使用TRIzol提取试剂(美国Invitrogen公司,15596018)从脊髓背角组织中提取总RNA,超微量分光光度计(美国Thermo公司,NanoDrop 2000)检测RNA浓度及OD260/280(1.8~2.1)。使用SuperScriptTMFirst-Strand Synthesis System(美国Invitrogen公司,11904018)进行逆转录,反应条件:25℃,10 min;42℃,5 min;70℃,15 min;4℃。使用Fast SYBR Green Master Mix(美国Applied Biosystems公司,4385614)进行定量PCR,反应条件:95℃预变性30 s;95℃变性5 s,60℃退火30 s,循环40次;95℃,15 s;60℃,60 s;95℃,15 s。使用2-ΔΔCT法分析结果,引物合成于上海生工生物工程股份有限公司,具体序列,见表1。

表1 引物序列
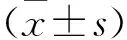
2 结果
2.1 各组大鼠机械痛阈和热痛阈的比较 各组大鼠在术前1d时机械痛阈与热痛阈比较,差异均无统计学意义(P>0.05);与SC组相比较,CCI组在术后3d、7d、14d时机械痛阈与热痛阈均降低,差异均具有统计学意义(P<0.05);与CCI组相比较,PAR组在术后3d、7d、14d时机械痛阈与热痛阈均升高,差异均具有统计学意义(P<0.05);与PAR组比较,1D11组在术后3d、7d、14d时机械痛阈与热痛阈降低,差异均具有统计学意义(P<0.05)。见表2、图1。

图1 各组大鼠机械痛阈和热痛阈的比较
表2 各组大鼠机械痛阈和热痛阈的比较
2.2 各组大鼠TGFβ1/Smad3信号通路表达水平的比较 SC组和CCI组脊髓背角组织中TGFβ1、p-Smad3表达水平比较,差异均无统计学意义(P>0.05);与CCI组相比较,PAR组脊髓背角组织中TGFβ1、p-Smad3表达水平升高,差异均具有统计学意义(P<0.05);与PAR组比较,1D11组脊髓背角组织中TGFβ1、p-Smad3表达水平降低,差异均具有统计学意义(P<0.05),见图2。
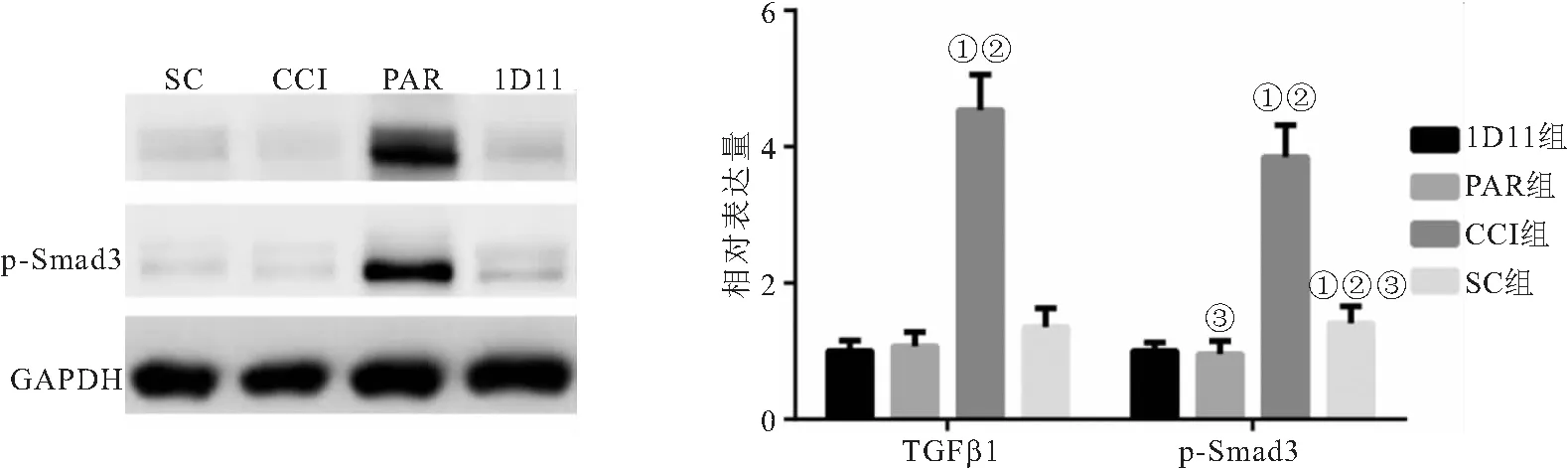
图2 蛋白质免疫印迹检测TGFβ1/Smad3信号通路的表达
2.3 各组大鼠小胶质细胞活化程度的比较 与SC组相比较,CCI组脊髓背角组织中Iba-1荧光强度明显增强;与CCI组相比较,PAR组脊髓背角组织中Iba-1荧光强度明显减弱;与PAR组比较,1D11组脊髓背角组织中Iba-1荧光强度明显增强,见图3。
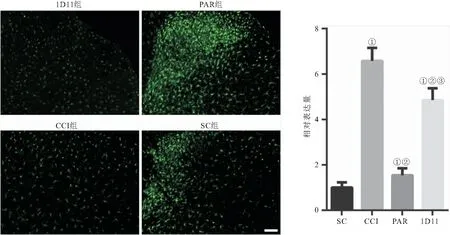
图3 免疫荧光染色检测Iba-1的表达(标尺:100 μm)
2.4 各组大鼠炎症因子水平的比较 与SC组相比较,CCI组脊髓背角组织中IL-1β、IL-6、TNF-α水平升高,差异均具有统计学意义(P<0.05);与CCI组相比较,PAR组脊髓背角组织中IL-1β、IL-6、TNF-α水平降低,差异均具有统计学意义(P<0.05);与PAR组比较,1D11组脊髓背角组织中IL-1β、IL-6、TNF-α水平升高,差异均具有统计学意义(P<0.05),见图4。
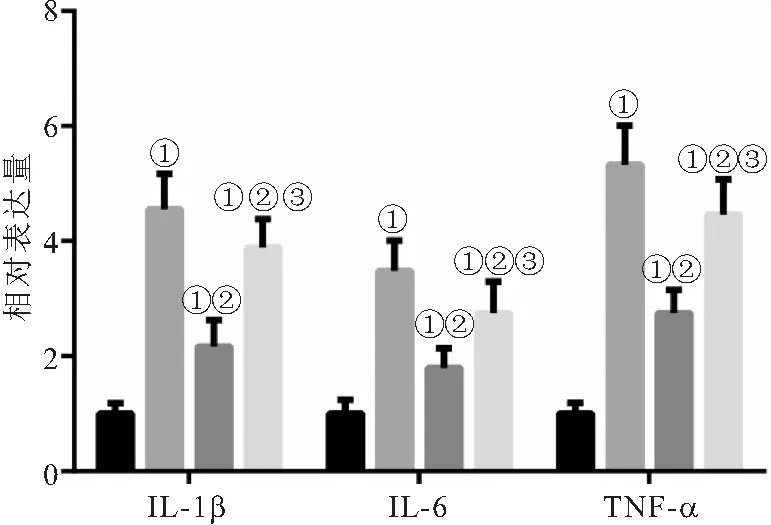
图4 各组大鼠炎症因子水平的比较
3 讨论
目前有几种治疗神经病理性疼痛的药物,包括非甾体类抗炎药、阿片类药物、抗惊厥药、抗抑郁药等,但是将近三分之二的患者对这些治疗均无反应,被认为具有治疗抵抗力[8]。治疗药物研发的不理想与病理机制的复杂性密切相关[9-10]。中枢敏化是解释疼痛诱发的主要机制,表现为突触数量的升高及突触传递的长时程增强[11]。近年来,学界认为小胶质细胞活化后向突触间隙周围迁移,通过分泌大量的神经炎症因子,导致轴突末梢去极化,是引起中枢敏化的重要机制[12-13]。因此,从小胶质细胞介导神经炎症的角度去深入挖掘神经病理性疼痛的关键机制,从而针对性的开发新型镇痛药,可能达到理想的治疗效果。
作为一种COX-2抑制剂,帕瑞昔布钠具有较好的炎症抑制效应[14-15]。研究表明,它也对神经病理性疼痛具有较好的缓解作用,可抑制小胶质细胞和星形胶质细胞活化,降低脊髓组织中炎症介质的表达[2-3]。本研究通过慢性坐骨神经结扎的方法构建了大鼠神经病理性疼痛模型,结果也证实了帕瑞昔布钠的镇痛及抗炎效应。但是,帕瑞昔布钠除了抑制COX-2表达外,是否还通过其他作用机制发挥治疗效应也有待研究。
众所周知,TGFβ1是一种多功能的细胞因子,参与调节细胞增殖、凋亡、分化、迁移等多种功能,而在免疫调节中却发挥负性效应,例如TGFβ1功能减弱导致淋巴细胞过度激活是系统性红斑狼疮的主要发病机制[16]。早期有研究发现,在正常的成年个体中,TGFβ2和β3在神经系统中的神经元和神经胶质细胞中普遍表达,而TGFβ1却仅限于脑膜[17]。然而随后的研究发现,患有神经退行性疾病或缺血性损伤的动物大脑中TGFβ1表达水平显著上调[18-19]。近年通过体内体外研究发现,TGFβ1对神经元和神经胶质细胞具有一系列的生物学功能,例如TGFβ1可以与胶质细胞源性神经营养因子(GDNF)等其他营养因子协同作用,调节神经元的存活[20];可以抑制小胶质细胞的增殖,降低自由基含量,发挥抗炎和免疫抑制效应[4,21]。由此,本研究提出TGFβ1是否通过抑制小胶质细胞介导的神经炎症,从而在神经病理性疼痛中发挥负调节效应,是否参与帕瑞昔布钠的抗炎与镇痛机制。
本研究结果显示,虽然造模后TGFβ1的表达水平并未发生显著性变化,但是帕瑞昔布钠给药却可以明显上调TGFβ1的表达,而给予TGFβ1抑制剂1D11则可抑制其表达上调。TGFβ1通过与II型跨膜丝氨酸苏氨酸激酶受体(TGFβRII)结合而发出信号,进而激活I型受体(TGFβRI),使下游Smad3发生磷酸化,进而转位至细胞核内调节基因表达,因此p-Smad3是TGFβ1信号的主要介导者[22-23]。本文结果显示,p-Smad3的表达趋势与上述TGFβ1相一致,证实了1D11可以有效抑制帕瑞昔布钠对TGFβ1/Smad3信号通路的激活。进一步的实验结果表明,1D11可以逆转帕瑞昔布钠的镇痛及抗炎效应,证实了TGFβ1/Smad3信号通路在帕瑞昔布钠保护机制中的重要作用。但是,1D11对帕瑞昔布钠的镇痛及抗炎效应仅表现为部分抑制,却不能完全阻断,提示可能还有其他病理机制在发挥作用,未来仍待进一步研究。
4 结论
本文阐释了TGFβ1/Smad3信号通路在帕瑞昔布钠治疗大鼠神经病理性疼痛中发挥着重要作用,为帕瑞昔布钠的临床治疗提供了新的理论基础。此外,TGFβ1/Smad3信号通路可能单独作为治疗靶点,用于开发新型药物,可能具有更大的应用价值。
