枸杞多糖对2,4-二氯苯氧乙酸染毒大鼠海马神经元凋亡的保护作用
2021-11-24王晓岚贾磊娜王恒泉罗玉珍张鹏举彭珍燕杨惠芳
王晓岚, 贾磊娜, 柴 茹, 王恒泉, 罗玉珍, 张鹏举, 彭珍燕, 杨惠芳, 周 健
(1.宁夏医科大学公共卫生与管理学院职业卫生与环境卫生系,银川 750004; 2.宁夏环境因素与慢性病控制重点实验室,银川 750004)
2,4-二氯苯氧乙酸(2,4-dichlorophenoxyacetic acid,2,4-D)既可以作为植物生长调节剂对果蔬具有保鲜作用[1],又广泛应用于农业和林业,用于控制牧场、谷类作物、陆生和水生植物的阔叶杂草以及家庭居住环境和公共道路上杂草的生长[2]。因其具有成本低、有效性高、选择性好等特点,因此适用范围广,职业和非职业暴露机会逐渐增大。2,4-D 具有神经毒性作用,但对其作用机制研究尚少。枸杞多糖(lycium barbarum polysaccharide,LBP)是从枸杞中提取的一种生物活性物质,具有增强免疫、抗氧化以及神经保护等多种生物学效应[3]。本研究通过2,4-D 体内染毒实验,探讨2,4-D 对染毒大鼠的神经毒性作用及LBP 的神经元保护作用,为2,4-D 的合理使用提供理论依据。
1 材料与方法
1.1 主要试剂与仪器
2,4-D 标准品(纯度为 99%,美国 Sigma 公司),LBP(纯度为80%,上海源叶生物科技有限公司)。TUNEL 荧光法检测试剂盒(中国沈阳万类生物科技有限公司),Bax 抗体(美国Gene-Tex 公司),Bcl-2 抗体(美国 GeneTex 公司),谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)测试盒(南京凯基生物科技发展有限公司),丙二醛(malonaldehyde,MDA)测定试剂盒(南京建成生物公司),超氧化物歧化酶(superoxide dismutase,SOD)试剂盒(南京建成生物公司),旷场实验箱和高架十字迷宫(北京硕林苑科技有限公司),倒置相差显微镜(日本Olympus 公司)。
1.2 动物分组与染毒
SPF 级初断乳SD 大鼠48 只,雌雄各半,体质量为50~90 g,由宁夏医科大学实验动物中心提供(实验动物质量合格证编码:10752309201900022,实验动物伦理审查编号:IACUC-NYLAC-2019-008)。适应性饲养1 周后,随机分为4 组(每组12 只,分笼饲养,每笼 3 只),分别为 Control 组(去离子水)、2,4-D 组(75 mg·kg-1)、LBP 组(50 mg·kg-1)、2,4-D(75 mg·kg-1)+LBP(50 mg·kg-1)组,实验期间大鼠自由摄食、饮水,饲养环境温度为18~22 ℃,湿度为40%~70%,自然昼夜节律光照。
1.3 检测指标与方法
1.3.1 一般行为观察 观察各组大鼠的行为,包括形态变化(精神状态,皮毛、黏膜及耳廓色泽,休息时的姿势等情况),异常行为表现(如动物的反抗触摸、叫声、惊跳、逃跑、洗脸、直立、挠抓等情绪性成分行为发生情况),隔天记录1 次。
1.3.2 动物体质量及脑脏器系数测定 隔天称量并记录大鼠体质量1 次,直至实验终止;每天早晚各添加饲料和水1 次。体质量增长量(g)=实验后体质量-实验前体质量。大脑脏器系数=脑质量(g)/体质量(100 g)。
1.3.3 旷场实验[4]检测2,4-D 染毒大鼠运动能力和探索能力的变化。末次染毒后24 h 内进行旷场实验。实验在暗光、无噪声的环境下进行,将大鼠置于旷场实验箱,采用双盲法观察5 min。每只动物测试完毕后清理粪便,将实验箱内部用75%的乙醇溶液擦拭干净后,晾干,进行下一次实验。
1.3.4 高架十字迷宫[5]末次染毒结束后将大鼠从中央格面向闭合臂放入迷宫,记录5 min 内的活动情况。观察指标包括:开放臂进入次数(必须有两只前爪进入臂内)、开放臂停留时间、闭合臂进入次数、闭合臂停留时间。计算开放臂停留时间比例、开放臂进入次数比例、高架十字迷宫中总进入次数。实验完成后将大鼠取出,将两臂清理干净,喷洒75%乙醇除去气味。
1.3.5 大鼠血清中 SOD、GSH-Px 和 MDA 的测定 用10%水合氯醛(300 mg·kg-1)腹腔注射麻醉,开胸暴露心脏,心尖取血6~10 mL,迅速低温离心分离血清(4 ℃,3000 r·min-1,10 min),储存于-20 ℃冰箱,根据试剂盒分别测定血清中SOD、GSH-Px 和 MDA 的含量。
1.3.6 HE 染色观察海马组织病理形态变化 大鼠取血后,每组随机选取6 只大鼠,经左心室快速灌注37 ℃生理盐水150~200 mL,继而先快后慢灌注4%多聚甲醛溶液(用PBS 配制,pH=7.4)200~300 mL,持续25~40 min,直至大鼠上肢、颈项和下肢僵硬后,断头取脑,置于4%多聚甲醛溶液中继续固定48 h 以上。大鼠脑组织固定后,经脱水、二甲苯透明、浸蜡和包埋,制成4 μm 厚的石蜡切片;75 ℃烘烤1 h 后HE 染色。光镜下观察切片,10×10 倍光镜下定位海马,10×40 倍光镜下观察海马CA3 区锥体细胞形态学变化。每张切片取连续两个视野,并保证锥体细胞层的弧度弦置于目镜的直径上,取两视野的平均值为该切片锥体细胞数,3 张切片的平均值为该样本的锥体细胞数。
1.3.7 TUNEL 染色观察大鼠海马神经元凋亡 取材、包埋切片、脱蜡过程同HE 染色步骤。先滴加0.1%Triton X–100(0.1%柠檬酸钠盐配制)50 μL,室温放置8 min。接着PBS 漂洗3 次,每次漂洗5 min。滴加 3 % H2O250 μL 进行封闭,室温放置10 min 后继续 PBS 漂洗 3 次,每次漂洗 5 min。Enzyme Solution 及 Label Solution 按 1∶9 配制(即用即配,冰上操作)。擦干标本周围,滴加TUNEL反应液50 μL。随后保湿、避光、室温孵育60 min后继续PBS 漂洗 3 次,每次漂洗 5 min。进行DAPI 复染核,室温 5 min。PBS 漂洗 3 次,每次漂洗5 min。抗荧光衰减封片剂封片。镜检后拍照。
1.3.8 免疫组化法检测Bcl-2 和Bax 凋亡蛋白的表达 免疫组织化学法检测各组大鼠海马CA3区凋亡蛋白 Bax 和 Bcl-2 表达水平:取上述脑组织石蜡切片,梯度乙醇脱蜡,高压抗原修复,Bax/Bcl-2 一抗孵育、结合二抗、DAB 显色,梯度乙醇脱水、封片。400 倍光镜下观察阳性细胞并计算平均吸光度值。结果判定:细胞膜或者是胞浆中呈棕黄色染色者为阳性细胞。
1.4 统计学方法
数据采用SPSS 22.0 软件进行统计分析。计量资料以均数±标准差()表示,多组间比较采用方差齐性检验和单因素方差分析(One-Way ANOVA)。组间两两比较,方差齐时采用SNK-q法,方差不齐时采用非参数检验。检验水准α=0.05。
2 结果
2.1 一般行为观察
实验前所有大鼠精神状态良好,皮毛光滑,饮水摄食正常。随着染毒时间延长,2,4-D 组大鼠表现出毛色枯黄、神态倦怠、皮毛粗糙和易激惹状态。
2.2 体质量及脑脏器系数测定
各组大鼠体质量增长平缓,各组间差异无统计学意义(P>0.05)。与 Control 组比较,2,4-D 组大鼠脑重和脑脏器系数降低(P<0.05);与2,4-D组比较,LBP 组和 2,4-D+LBP 组大鼠脑质量和脑脏器系数升高(P<0.05),见图1。
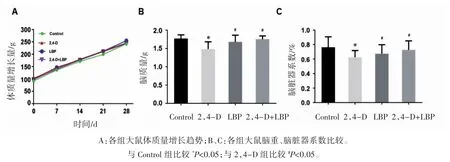
图1 各组大鼠体质量、脑重及脑脏器系数比较(n=12,)
2.3 各组实验大鼠旷场实验结果
与 Control 组比较,2,4-D 组大鼠中央格停留时间延长,穿行格数、直立次数和修饰时间均减少(P 均<0.05)。与 2,4-D 组比较,LBP 组和 2,4-D+LBP 组中央格停留时间缩短,穿行格数、直立次数和修饰时间均增加(P 均<0.05),见图2。

图2 各组大鼠旷场实验结果(n=12,)
2.4 各组实验大鼠高架十字迷宫结果
与 Control 组比较,2,4-D 组实验大鼠进入开放臂次数减少,开放臂停留时间缩短,开放臂停留时间百分比降低(P 均<0.05),开放臂进入次数百分比无明显变化(P>0.05);与 2,4-D 组比较,LBP 组和 2,4-D+LBP 组实验大鼠进入开放臂次数增多,开放臂停留时间延长,开放臂停留时间百分比升高(P 均<0.05),开放臂进入次数百分比无明显变化(P>0.05),见图3。

图3 各组大鼠高架十字迷宫结果(n=12,)
2.5 HE 染色观察各组大鼠海马组织病理形态变化
与 Control 组比较,2,4-D 组大鼠海马 CA3区锥体细胞数减少,LBP 组大鼠海马CA3 区锥体细胞数增多(P 均<0.05);与 2,4-D 组比较,2,4-D+LBP 组大鼠海马CA3 区锥体细胞数增多(P均<0.01),见表 1。
表1 各组大鼠海马CA3 区锥体细胞计数结果()

表1 各组大鼠海马CA3 区锥体细胞计数结果()
与对照组比较**P<0.01;与2,4-D 组比较##P<0.01。
组别 n 海马CA3 区锥体细胞数/个Control 6 113.57±7.72 2,4-D 6 102.01±4.99**LBP 6 142.11±6.24**##2,4-D+LBP 6 113.49±5.27##
Control 组在光镜下观察锥体细胞排列整齐,形态完整,细胞核均匀蓝染,染色质分布均匀,核仁明显,细胞质均匀、致密,未见异常改变;2,4-D 组大鼠海马CA3 区锥体细胞间隙增宽,排列不整齐,细胞与周围组织联系疏松,锥体细胞有肿胀,部分胞核固缩呈三角形或不规则形,胞浆空泡状。LBP 组光镜下的细胞形态同对照组,锥体细胞形态完整、细胞与周围组织联系紧密、细胞核均匀蓝染、染色质分布均匀、核仁明显、细胞质均匀致密;2,4-D+LBP 组锥体细胞形态明显优于2,4-D 组,偶有染色质边集、胞核固缩呈三角形,见图4。
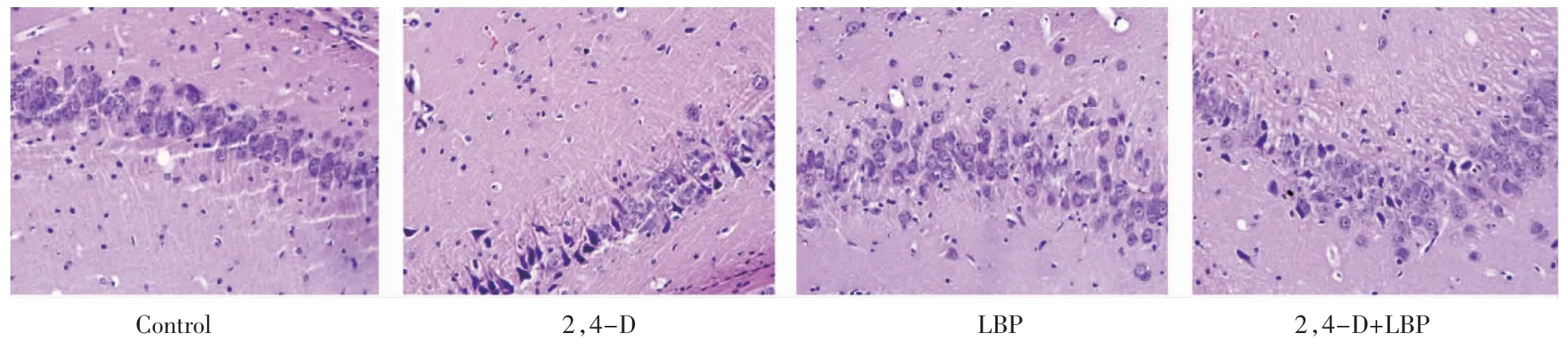
图4 各组大鼠海马组织病理形态变化(HE×400)
2.6 各组大鼠血清中SOD、GSH-Px 和MDA 的含量比较
与 Control 组比较,2,4-D 组和 2,4-D+LBP组大鼠血清中SOD 和GSH-Px 含量降低,MDA含量升高(P 均<0.01);与 2,4-D 组比较,LBP 组和2,4-D+LBP 组大鼠血清中 SOD 和 GSH-Px 含量升高,MDA 含量降低(P 均<0.01),见图 5。
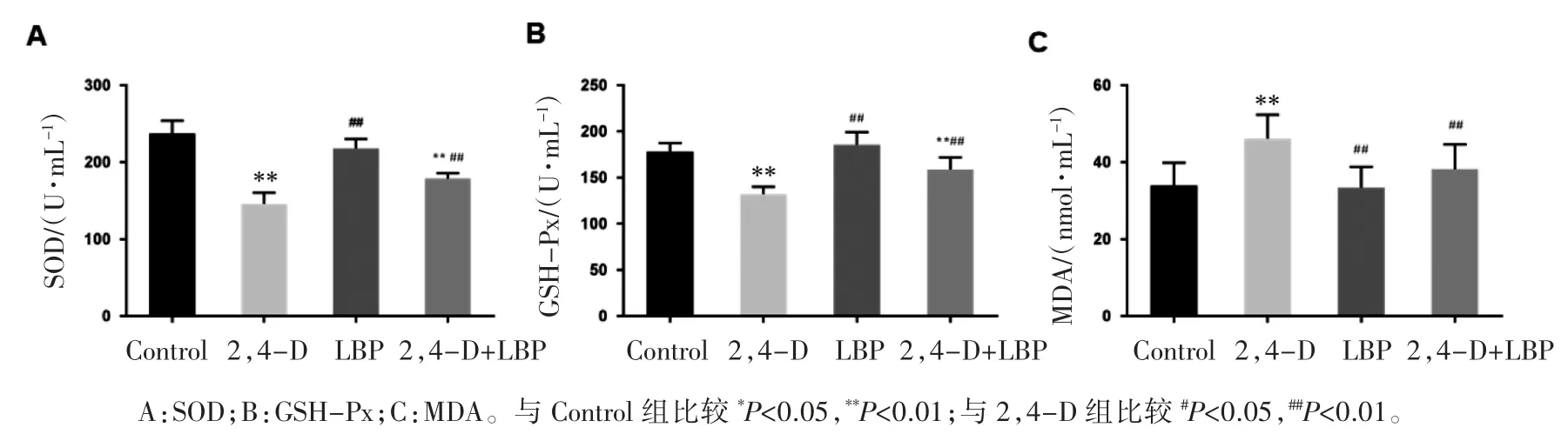
图5 各组大鼠血清中 SOD、GSH-Px 活力和 MDA 含量比较(n=6,)
2.7 TUNEL 染色观察各组大鼠海马神经元凋亡情况
TUNEL 染色发现,凋亡细胞呈现绿色或淡绿色荧光。与Control 组比较,2,4-D 组大鼠海马神经元阳性细胞数增多,细胞凋亡率升高(P 均<0.01);与 2,4-D 组比较,LBP 组和 2,4-D+LBP组大鼠海马神经元阳性细胞数减少,细胞凋亡率降低(P 均<0.05),见图 6。
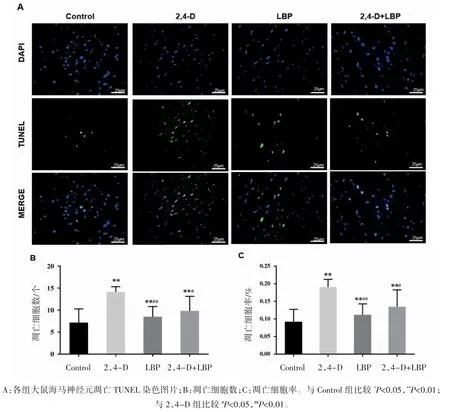
图6 TUNEL 染色法观察各组大鼠海马神经元凋亡(n=6,)
2.8 Bcl-2 和Bax 凋亡蛋白的表达
免疫组织化学方法检测各组大鼠海马CA3区Bax 和Bcl-2 表达。神经元染色以胞浆有棕黄色物质沉积为主,也有胞膜或核膜染色。与Control 组比较,2,4-D 组大鼠海马 Bcl-2 表达降低,Bax 表达升高,Bcl-2/Bax 比值降低(P 均<0.05)。与 2,4- D 组比较,2,4-D+LBP 组大鼠海马 CA3区 Bcl-2 表达升高,Bax 表达降低,Bcl-2/Bax 比值升高(P 均<0.05),见图 7。
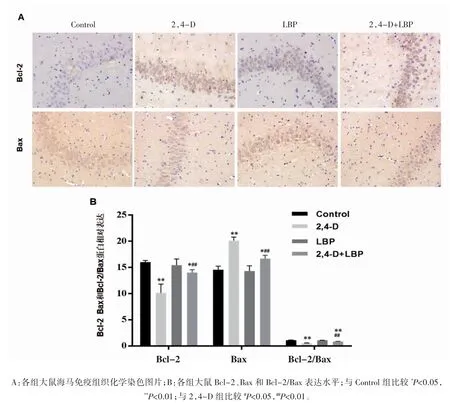
图7 各组大鼠海马组织Bcl-2 和Bax 凋亡蛋白表达水平比较(n=6,)
3 讨论
2,4-D 属于激素型除草剂,是一种高效内吸性除草剂[6],具有较强的神经毒性。Uyanikgil 等[7]发现 15 mg·L-1剂量 2,4-D 可使虹鱼出现活动减少、群居、呼吸不畅、突然旋转和跳起、失去平衡等。Dehnert 等[8]研究结果显示,2,4-D 可改变幼鱼视觉基础神经回路的发育和功能。脑和脊髓的病理组织切片显示神经元丢失增加、细胞内水肿、空泡,脊髓中神经角质增多及细胞固缩。有毒的外源化学物质可能通过胎盘和乳汁影响胎儿的发育,而发育中的脑由于其血脑屏障尚未发育成熟更容易受到侵害,因此本研究以初断乳大鼠建立 2,4-D 染毒模型,观察 2,4-D 对初断乳大鼠的神经毒性作用。结果发现,2,4-D 染毒组大鼠脑重和脑脏器系数降低,海马CA3 区锥体细胞数量明显减少,锥体细胞间隙增宽,部分胞核固缩呈三角形或不规则形,胞浆空泡状。行为学以动物的自发行为为基础,能够反映动物整体的生活行为改变。通过对新异环境的适应和反应,动物的行为与中枢神经系统发生密切关系。本研究通过旷场实验、高架十字迷宫和悬尾试验观察了2,4-D 染毒后大鼠神经行为的变化。实验结果显示,2,4-D 组大鼠中央格停留时间与对照组相比延长,提示2,4-D 染毒后大鼠对周围环境的好奇心明显减弱,探究行为减弱,大鼠紧张程度增加,表明2,4-D 可以对大鼠神经行为产生影响,这可能与2,4-D 的神经毒性密切相关。
目前,关于2,4-D 的神经毒性作用机制尚未明确,可能与细胞凋亡、氧化应激、抑制神经轴生长等有关,其中氧化应激学说在神经毒性机制的研究中占有重要地位。2,4-D 表现出很强的神经毒性,原因可能为氧化应激发生伴随了过多氧自由基的产生[9]。而机体清除氧自由基能力越强,SOD 与GSH-Px 活性越高。MDA 含量反映了细胞受自由基攻击的严重程度,MDA 含量越高细胞受自由基攻击越严重,越容易产生细胞毒性。研究[10]显示,孕期和哺乳期暴露2,4-D 引起仔鼠神经行为发育的改变,其机制可能通过干扰抗氧化平衡系统而导致发育期脑组织的损伤所致。长时间暴露于2,4-D 则可能会使生物体受到压力,从而抑制其生长发育并增加其脑部畸形的发生率[11]。本研究与上述研究结果一致,显示2,4-D 染毒大鼠血清中SOD、GSH-Px 活性降低,MDA含量升高,提示2,4-D 引起大鼠体内抗氧化酶活性下降,氧化应激水平升高。
Mahmoudinia 等[12]研究发现,2,4-D 可以诱导人牙髓干细胞发生氧化应激和凋亡。本课题组前期实验研究发现,2,4-D 可以引起PC12 细胞发生氧化应激,引起PC12 细胞内MDA 含量升高SOD 和 GSH-Px 活力降低[13]。后期实验发现 2,4-D 引起了PC12 细胞线粒体膜电位下降,发生细胞凋亡。线粒体凋亡是细胞凋亡的主要途径,对于维持细胞增殖与凋亡的平衡具有重要影响,凋亡过度或过低都会诱发相应的疾病。Bcl-2 家族蛋白是调节线粒体凋亡因子释放的主要蛋白,根据其功能可分为促凋亡蛋白和抑凋亡蛋白。正常情况下Bcl-2 等抗凋亡蛋白一般作为细胞器膜的整合膜蛋白被隔离起来,而Bax 等促凋亡蛋白则以非活性状态分布于胞质和细胞骨架上[14]。本研究结果发现,2,4-D 染毒组大鼠海马神经元阳性细胞数明显增多,细胞凋亡率升高,大鼠海马组织Bcl-2 表达降低,Bax 表达升高,Bcl-2/Bax 比值降低,表明2,4-D 可以引起海马神经元凋亡。
LBP 可以保护肝功能[15]、提高免疫力[16]、抑制肿瘤细胞[17],并能抗衰老和抗氧化[18]。Lam 等[19]研究结果发现,LBP 具有促进神经元发生,调节氧化应激和炎症激活的凋亡信号级联反应,具有神经保护作用。LBP 可有效改善严重应激所致的创伤性认知功能障碍[20]。本研究结果显示,LBP 干预后,大鼠海马组织锥体细胞数量增多,形态规则,血清 MDA 含量降低,SOD、GSH-Px 活力升高、细胞凋亡率下降,抗凋亡蛋白Bcl-2 表达升高,促凋亡蛋白Bax 表达升高,Bcl-2/Bax 比值降低,说明LBP 对2,4-D 染毒大鼠的神经元具有保护作用。
综上所述,2,4-D 可以引起实验大鼠血清抗氧化酶活性降低,造成海马神经元损伤和细胞凋亡,影响大鼠的神经行为,表现出抑郁和焦虑状态。LBP 具有抗氧化和抑制海马神经元细胞凋亡的作用,可为2,4-D 引起的神经损伤提供治疗和预防。
