外周血中性粒细胞/淋巴细胞比值与骨质疏松性股骨颈骨折患者的关系以及预后评估研究
2021-11-23刘永裕陈伟坚林天烨沈楚龙蔡开沈张庆文
刘永裕,陈伟坚,林天烨,莫 亮,吴 峰,沈楚龙,蔡开沈,张庆文
(1. 佛山市中医院,广东 佛山 528000;2. 广州中医药大学附属广州市正骨医院,广东 广州 510405;3. 广州中医药大学第一临床医学院,广东 广州 510080;4.广州中医药大学第三附属医院关节骨科,广东 广州 510240)
骨质疏松症是一种以骨量减少为特征的代谢性骨病,是年龄相关性骨折的危险因素之一。骨质疏松性骨折(脆性骨折)患者每年高达数百万例,其中的股骨颈骨折患者占脆性骨折患者的3.58%[1]。股骨颈骨折是一种常见的由直接或间接暴力引起的急性损伤,以下肢缩短、外展、外旋畸形为特征,多见于中老年人[2]。近年来,人们已经发现,慢性炎症在骨重建过程中扮演着一个重要的角色,同时也是引起骨质疏松症的危险因素之一[3]。外周血中性粒细胞-淋巴细胞比值(NLR)可以较为稳定地反映机体的炎症状态[4]。中性粒细胞/淋巴细胞比率(NLR)是一个简单、经济和易计算的生物标志物,已广泛应用于各种恶性肿瘤和炎症性疾病的诊疗中[5,6],炎症会通过影响骨骼系统,干扰骨代谢的平衡,从而在骨质疏松症的发生和发展过程中发挥重要的作用。无论是什么原因引起的骨质疏松症,都不可避免地会引起全身性或局灶性炎症反应,从而促进骨质疏松症的发生和发展。目前已有研究报道,NLR 与骨密度降低和骨质疏松有关[7,8]。然而,NLR 与骨质疏松性股骨颈骨折的关系尚未见报道。因此,本研究拟通过多组间方差分析(两组间比较的SNK-q检验)、两因素间偏相关分析、多因素线性回归分析,两组间比较t检验以及两样本率的卡方检验来探讨和验证NLR 升高与脆性股骨颈骨折发生以及预后康复的关系。本研究将为骨质疏松性股骨颈骨折的诊断、治疗以及预后康复评估提供新的风向标。
1 资料与方法
1.1 研究对象
1.1.1 纳入、排除标准 入选标准:(1)年龄40~75岁,女性患者;(2)因轻微外伤导致的脆性股骨颈骨折;(3)影像学诊断为股骨颈骨折;(4)住院期间接受外周血中性粒细胞、淋巴细胞以及骨密度检测;(5)住院期间根据病情需要并自愿接受空心螺钉固定术或全髋关节置换术治疗。
排除标准:(1)年龄<40 岁或>75 岁,男性患者;(2)住院期间未接受常规外周血中性粒细胞、淋巴细胞以及骨密度检测;(3)严重暴力引起的骨折或病理性骨折;(4)心肺功能差,不能耐受手术治疗的患者。
1.1.2 患者资料 回顾性分析2008~2017 年在广州中医药大学第一附属医院行空心螺钉固定术或全髋关节置换术治疗股骨颈骨折的102 例女性患者的病例资料及随访结果。根据《原发性骨质疏松症诊断与治疗指南(2017)》中的骨质疏松症诊断标准[9],所有患者根据骨密度值分为3 组:骨量正常组(T≥-1.0),骨量减少组(-2.5<T<-1.0)和骨质疏松组(T≤-2.5)。并对患者临床资料进行收集分析,同时对接受空心钉内固定治疗的患者进行2 年以 上 随 访,并 根 据NLR 值 分 为 两 组[9]:低NLR 组(NLR≤2.33)、高NLR 组(NLR>2.33),以 探 讨NLR 对骨质疏松性股骨颈骨折的关系以及预后康复关系。
1.1.3 伦理 此项研究经由广州中医药大学第一附属医院伦理委员会审核批准。
1.2 方法
1.2.1 临床一般资料收集 详细记录患者的性别、年龄、BMI 等基本信息,并比较各组患者的相关临床参数。
1.2.2 临床标本的收集 所有入选者在晚饭后禁食10 h,次日早晨抽取空腹静脉血,并根据外周血常规中性粒细胞计数与淋巴细胞计数之比计算NLR。采用DXA(prodigy lunar,GE)扫描仪,测量健侧股骨的骨密度值,单位以g/cm2表示,并取其平均值作为骨密度实测值。
1.3 统计学处理
2 结果
2.1 3 组股骨颈骨折患者临床数据比较
3 组患者的临床资料显示,3 组患者在年龄、NLR、BMD、三酰甘油等因素间的差异有统计学意义(P<0.05)。而与骨量正常组和骨量减少组比较时,骨质疏松组患者年龄更大、三酰甘油以及NLR水平升高,BMD 值降低,差异有统计学意义(P均>0.05)。此外,患者BMI、WBC、总胆固醇、HDL、LDL-C、CRP 在3 组 间 差 异 无 统 计 学 意 义(P>0.05),见表1。
表1 3 组股骨颈骨折病例资料数据比较(±s)Tab 1 Comparison of data of three groups of femoral neck fractures(±s)

表1 3 组股骨颈骨折病例资料数据比较(±s)Tab 1 Comparison of data of three groups of femoral neck fractures(±s)
注:a:与骨量正常组比较,P<0.05;b:与骨量减少组比较,P<0.05。
项目年龄(岁)BMI(kg/m2)NLR BMD(g/cm2)WBC(×109/L)三酰甘油(mmol/L)总胆固醇(mmol/L)高密度脂蛋白(mmol/L)低密度脂蛋白(mmol/L)C 反应蛋白(mg/L)骨量正常组(n=29)53.20±5.03 23.90±1.13 1.79±0.29 0.99±0.13 7.78±3.61 2.02±0.13 5.56±0.17 1.24±0.26 2.65±0.16 11.30±2.24骨量减少组(n=32)62.40±5.62a 24.00±1.24 2.37±0.27a 0.82±0.08a 7.04±3.54 2.28±0.13a 5.57±0.18 1.14±0.27 2.55±0.18 11.10±2.31骨质疏松组(n=41)68.50±3.82ab 23.98±1.19 3.26±0.22ab 0.59±0.07ab 6.85±3.03 2.56±0.12ab 5.61±0.23 1.13±0.28 2.59±0.19 10.70±2.26 F P<0.001 0.966<0.001<0.001 0.507<0.001 0.880 0.253 0.094 0.560 87.460 0.035 289.300 144.200 0.684 151.100 0.128 1.395 2.430 0.580
2.2 股骨颈骨折患者骨密度值与所纳入研究因素的相关性分析
采用偏相关分析,控制年龄、BMI 后,结果显示骨质疏松性股骨颈骨折患者BMD 与NLR 以及三酰甘油呈负相关(P<0.05),而与患者的WBC 计数值、总胆固醇水平、CRP、HDL-C、LDL-C 水平之间均无相关性(P>0.05),见表2。
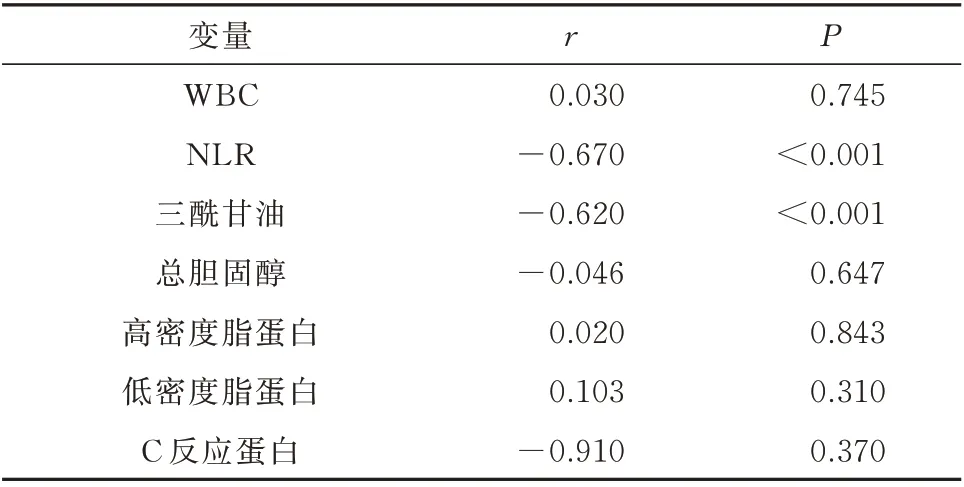
表2 BMD 与纳入研究因素的相关分析Tab 2 Correlation analysis between BMD and factors included in the study
2.3 影响骨质疏松性股骨颈骨折骨密度的相关因素分析
将骨密度值作为多因素线性回归模型中的因变量,另外把患者的年龄、BMI、WBC、NLR、CRP、总胆固醇、三酰甘油、HDL-C、LDL-C 纳入为模型的自变量,并进行多因素线性回归分析,结果显示NLR 和三酰甘油是骨质疏松性股骨颈患者BMD 的主要影响因素(P<0.05),见表3。

表3 影响BMD 的多因素回归分析Tab 3 Multivariate regression analysis of BMD
2.4 两组内固定术后患者的预后康复情况的比较
本研究102 例股骨颈骨折病例中,60 例接受了三枚空心螺钉内固定术,而另外42 例接受了全髋关节置换术治疗。对60 例内固定治疗的患者根据NLR 的值分为:低NLR 组(NLR≤2.33)和高NLR组(NLR>2.33)。高NLR 组术后并发症(包括骨折不愈合5 例以及股骨头坏死7 例)发生率为37.4%,明显高于低NLR 组发生率3.6%(P<0.05),且高NLR 组在术后3 个月及1 年Harris 评分均低于低NLR 组(P<0.05)。另外,术后复诊X 线显示两组患者骨折断端愈合时间有显著差异,高NLR 组骨折愈合时间明显长于低NLR 组(P<0.05),而患者年龄、损伤到手术间隔时间,BMI 以及两种不同骨折分型在两组间的差异均无统计学意义(P>0.05),见表4。

表4 两组骨质疏松性股骨颈骨折患者预后及康复情况的比较Tab 4 Comparison of prognosis and rehabilitation between two groups of patients with osteoporotic femoral neck fracture
3 讨论
本研究结果揭示了骨质疏松性股骨颈骨折患者的BMD 与NLR 间存在相关性。基于多组间方差分析(两组间比较的SNK-q检验)、单因素偏相关分析、多因素线性回归分析等统计分析,结果显示:骨质疏松性股骨颈骨折患者的骨密度值与NLR 之间呈负相关。同时,60 例接受空心螺钉内固定治疗的患者中,与低NLR 组患者相比,高NLR 组患者术后股骨头坏死的发生率、骨折的不愈合率增加及骨折愈合时间延长,术后随访3 个月及1 年Harris 评分均较低NLR 组降低,这些结果均揭示了外周血NLR 可以作为内固定治疗骨质疏松性股骨颈骨折患者预后疗效的预测指标,有利于指导患者术后康复。
NLR 是指外周血常规中性粒细胞计数与淋巴细胞计数之间的比值。当机体内存在急性炎症时外周血中性粒细胞异常增多,而机体一旦出现免疫防御能力降低,外周血常规中淋巴细胞计数异常下降。因此,NLR 可以直接反映机体的急性炎症和免疫防御状态[11]。近年来,在NLR 的预测价值方面取得了一些进展。大量研究表明,NLR 的异常升高与疾病的严重程度以及预后康复密切相关。研究发现[12],髋部骨折术后5 d 外周血NLR>0.05 与术后死亡率呈正相关。有学者指出[13],术后NLR≥4.7%增加了髋部骨折患者的死亡风险。研究表明,NLR 与溃疡性结肠炎、急性阑尾炎、心血管疾病、结直肠癌和肺癌等炎症性疾病密切相关[14-18]。同时也有 研 究 表 明[15,16,18],NLR 在 预 测 心 血 管 患 者 和 恶 性肿瘤患者的不良结局方面优于白细胞和中性粒细胞计数。
此外,炎症是骨质疏松症发生发展过程中最重要的机体应激性反应。无论什么类型的骨质疏松,共同的特征是均伴有全身性或局灶性炎症反应。体内的炎症反应会增强破骨细胞的活力,导致骨吸收增加,打破机体内原有的骨稳态,进而加速骨质疏松的发展过程[19]。Barbour 等[20]研究表明,炎症标志物异常升高增加了老年女性髋部骨折的发生风险。这些研究均提示了机体内的炎症反应在骨质疏松症中发病机制中扮演者重要角色。另外,大量临床研究已经证实外周血NLR 比值在骨折中发挥着非常重要的作用。在一项对438 名患者的研究中,腰椎和股骨颈的骨密度随着NLR 的增加而降低[21],髋部骨折后NLR 的增加已被报道为术后死亡和心血管并发症的危险因素[12]。Atlas 等[22]研究发现,髋部骨折术后第5 d,重症监护病房患者(P=0.007)和死亡患者(P=0.007)的NLR 较高。
骨质疏松患者骨量减少与其发生股骨颈骨折的风险密切相关。2001 年,美国国立卫生研究院(NIH)将骨质疏松症定义为一种以骨强度减弱和骨折风险增加为特征的骨代谢性疾病[23]。骨质疏松可导致骨小梁间隙增大,骨强度降低,另外,股骨颈上部存在许多滋养孔,降低了股骨颈的强度[24]。因此,容易发生股骨颈脆性骨折[25]。此外,老年人常伴有多种基础疾病,如糖尿病、高血压、心脑血管疾病等,可导致老年人昏迷、跌倒从而增加股骨颈骨折发生风险[26]。有研究证实老年骨质疏松患者外周血NLR 明显高于非骨质疏松患者,NLR 是预测骨质疏松发生的独立危险因素[8]。因此,笔者认为NLR 可以通过反映机体内炎症反应严重程度来预测骨质疏松患者股骨颈骨折的发生风险。
本研究有一定的局限性:本研究为回顾性研究且数据样本量较少,随访时间较短,结果可能存在误差。在未来的研究中,今后将招募更多的受试者以及随访更长的时间来验证NLR 在骨质疏松性股骨颈骨折患者中的作用。
综上所述,外周血NLR 是影响骨质疏松性股骨颈骨折患者BMD 降低的主要因素。通过检测NLR可早期评估骨质疏松性股骨颈骨折的发生风险,及时预防;另外,本研究还发现在行空心螺钉内固定治疗的患者中,与低NLR 组相比,高NLR 组患者术后的股骨头坏死的发生率、骨折的不愈合率升高及骨折愈合时间延长,术后Harris 评分降低,这些均揭示了外周血NLR 可以作为内固定治疗骨质疏松性股骨颈骨折患者术后预后康复疗效的预测指标,从而有利于指导患者术后康复。
