代谢综合征与颅内动脉粥样硬化性狭窄的关联性
2021-11-23郭春燕万秀明谭兰
郭春燕,万秀明,谭兰
(1 青岛大学附属青岛市市立医院神经内二科,山东青岛 266011 2 青岛大学附属医院耳鼻喉科)
颅内动脉粥样硬化性狭窄(ICAS)是亚洲人缺血性卒中的主要原因[1-2]。代谢综合征(Mets)是数种代谢性成分异常集结的病理状态,包括肥胖、高血压、血脂紊乱和糖代谢异常等,它与冠状动脉、颈动脉粥样硬化发生密切关联[3-5],也是心、脑血管疾病的危险因素[6-7]。国外研究显示,Mets、糖尿病、高血压、血脂紊乱与ICAS相关[8-12],但不同研究的结果不尽相同。本文研究汉族人群中Mets及其各组分(体质量超标和(或)肥胖、高糖血症、高血压、血脂紊乱)与ICAS的关系,以及性别和年龄对其关系的影响,为临床控制Mets降低ICAS发生的风险提供理论依据。
1 资料和方法
1.1 研究对象
研究对象为2014年1月—2018年6月在青岛市市立医院神经内科住院和在健康查体中心体检者1 009人。纳入标准:①年龄40岁及以上;②完成颅脑磁共振成像和脑血管磁共振成像及相关实验室检查。排除标准:①非汉族者;②有心房颤动、心源性栓塞或血管性疾病并已行冠状动脉旁路移植术治疗者;③有颅内外动脉夹层、动脉炎、烟雾病、肌纤维发育不良者;④有感染、肿瘤、慢性肝病、肾功能不全者;⑤既往有卒中史者。
1.2 Mets诊断标准
采用2004年中华医学会糖尿病学分会公布的中国人Mets诊断标准[13],具备以下4 个组分的3个或全部者可以诊断为Mets:①体质量超标和(或)肥胖(体质量指数(BMI)≥25 kg/m2);②高糖血症:空腹血糖≥6.1 mmol/L 和(或)餐后2 h 血糖≥7.8 mmol/L,和(或)已经确诊为糖尿病并治疗者;③高血压:收缩压/舒张压≥18.7/12 k Pa,和(或)已确诊高血压并治疗者;④血脂紊乱:空腹血清三酰甘油≥1.7 mmol/L 和(或)空腹血清高密度脂蛋白胆固醇<0.9 mmol/L(男)、<1.0 mmol/L(女)者。
1.3 数据采集
由经验丰富的神经内科医生采集研究对象的人口统计学资料(性别、年龄)、血管危险因素(高血压史、糖尿病史、心房颤动史、既往卒中史、吸烟饮酒史、肿瘤史等)。采集所有研究对象空腹静脉血用于检验血糖和血脂。身高体质量测量按照标准测量要求进行,计算BMI(BMI=体质量(kg)/身高(m)2)。采用欧姆龙电子血压计测量研究对象安静休息状态10 min后血压,测3次取平均值。
1.4 影像学评估
应用3.0 T 磁共振扫描仪行颅脑和脑血管磁共振成像检查。磁共振成像参数:重复时间/回波时间(20~25)/(2~3)ms,偏转角度15°,矩阵220 mm×220 mm,层厚1.2 mm,层间距0.6 mm。应用时间飞跃法血管成像技术评估颅内动脉状态。应用颈动脉彩色多普勒超声检查排除颅外动脉粥样硬化性狭窄[14]。所有图像均由两位经验丰富、对受检者的临床信息不知情的放射科医生阅读,出现分歧时再咨询第三位阅片者。根据华法林-阿司匹林治疗症状性颅内动脉狭窄随机对照研究(WASID)的方法测定ICAS程度[15]。ICAS被定义为一条或数条脑动脉直径狭窄≥50%,包括大脑中动脉M1和M2段、大脑前动脉A1 和A2段、大脑后动脉P1和P2段、椎动脉、基底动脉、颈内动脉颅内段等。
1.5 统计学分析
采用SPSS 23.0软件进行统计学处理。符合正态分布计量资料数据以±s表示,数据间比较采用Kruskal-Wallis方法;偏态分布计量资料采用M(P25,P75)表示,数据间比较采用Kruskal-Wallis方法。计数资料以频数和百分率表示,数据间比较采用卡方检验。Mets和Mets各组分与ICAS的相关性分析采用多因素Logistic回归分析,并计算优势比(OR)以及95%可信区间(CI);Logistic回归分析校正的因素包括年龄、性别、吸烟史、饮酒史、低密度脂蛋白胆固醇、本次是否新发脑血栓等。本研究中,年龄、低密度脂蛋白胆固醇为连续数值变量,余变量均为二分类变量;回归分析中二分类变量以男性、无吸烟史、无饮酒史、无新发脑血栓组、非Mets组为参照。不同Mets组分数量(Mets诊断标准共包括4个组分,故Mets组分数量为0~4)者ICAS发生率比较采用Cochran-Armitage趋势检验。双侧检验P<0.05为差异有统计学意义。
2 结 果
2.1 ICAS组与非狭窄组人口统计学和临床资料的比较
本文1 009例研究对象中,男623例(61.7%),女386例(38.3%),年龄40~97岁,中位数年龄为66岁;Mets组有416例(41.2%),非Mets组有593例(58.8%);ICAS组190例(18.8%),非狭窄组819例(81.2%)。Mets 组ICAS 96 例(23.08%),非Mets组ICAS 94例(15.85%),Mets组与非Mets组的ICAS 发生率比较差异有统计学意义(χ2=8.35,P<0.01)。ICAS组与非狭窄组年龄、性别、舒张压、BMI、吸烟史例数、脑血栓例数、三酰甘油、高密度脂蛋白胆固醇、低密度脂蛋白胆固醇、Mets体质量超标和(或)肥胖组分及血脂紊乱组分病人的构成比比较差异无显著性(P>0.05);ICAS 组饮酒史、高血压史、糖尿病史例数及收缩压、空腹血糖、Mets高糖血症和高血压组分病人构成比均显著高于非狭窄组(χ2=5.77~11.01,H=4.75、10.68,P<0.05)。见表1。
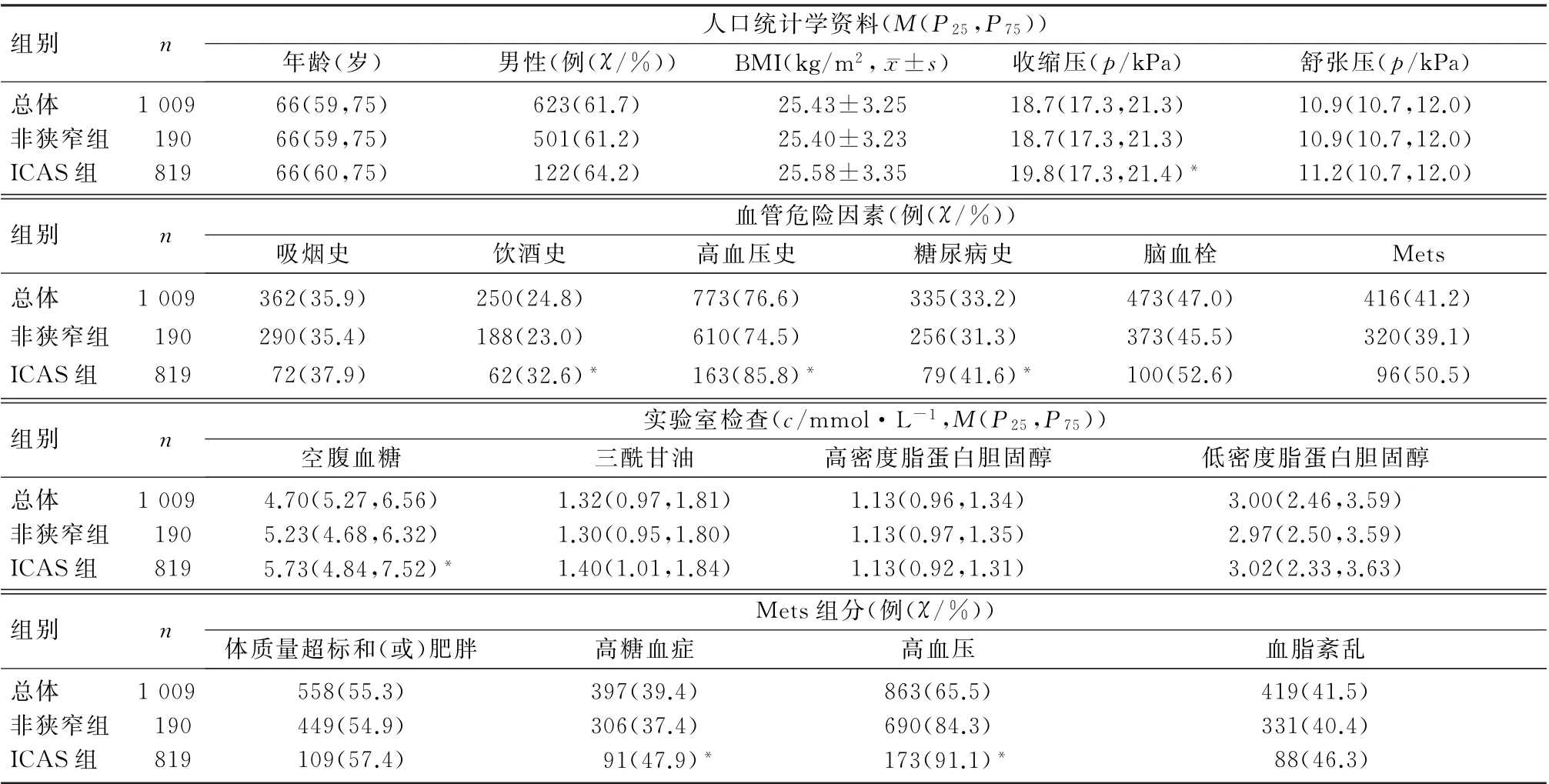
表1 ICAS组和非狭窄组人口统计学和临床资料比较
2.2 总人群中Mets与ICAS的关系
多因素Logistic回归分析显示,总人群中Mets(OR=1.59,95%CI=1.15~2.20,P=0.005)和饮酒史(OR=1.88,95%CI=1.22~2.91,P=0.004)与ICAS发生显著相关。Cochran-Armitage趋势检验显示,Mets组分数量越多,ICAS发生率越高,差异有统计学意义(χ2=8.84,P<0.01)。见图1。Mets各组分与ICAS 关系的多因素Logistic回归分析显示,高糖血症与ICAS显著相关(OR=1.43,95%CI=1.03~1.98,P=0.032)。见表2、3。

表2 Mets与ICAS相关的多因素分析
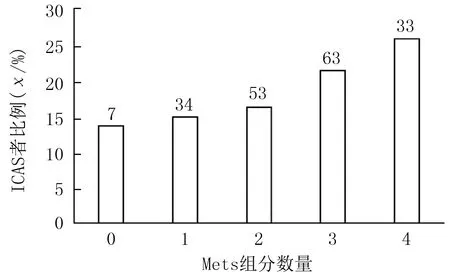
图1 总人群中不同Mets组分数量ICAS发生率比较
2.3 不同性别和年龄分组Mets与ICAS的关系
亚组分析显示,女性(OR=2.17,95%CI=1.27~3.70,P=0.005)和老年(OR=1.77,95%CI=1.22~2.57,P=0.002)人群Mets与ICAS显著相关,男性和非老年人群中未发现此关联。Cochran-Armitage趋势检验显示,女性(χ2=11.12,P<0.001)和老年(χ2=12.28,P<0.001)人群Mets组分数量越多,ICAS发生率越高;在男性(χ2=1.18,P>0.05)和非老年(χ2=0.04,P>0.05)人群中未显示此趋势。Mets各组分与ICAS 的多因素Logistic回归分析显示,女性高糖血症(OR=1.86,95%CI=1.06~3.27,P=0.031)和老年人高血压(OR=2.41,95%CI=1.17~4.97,P=0.017)与ICAS显著相关。
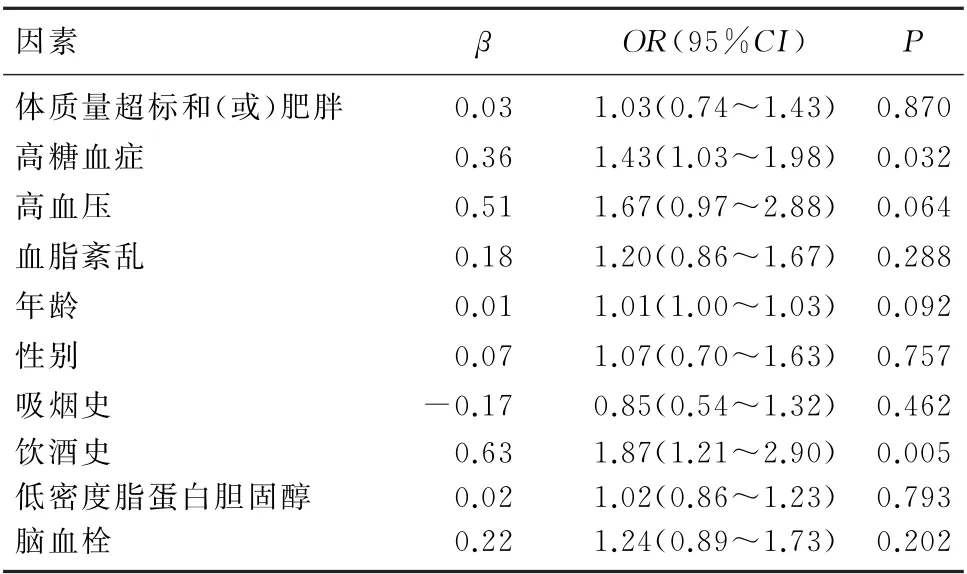
表3 Mets各组分与ICAS相关的多因素分析
3 讨 论
ICAS是亚洲人缺血性卒中的主要原因[3],而Mets与ICAS 相关,控制Mets可能降低ICAS 发生的风险。有研究结果表明,Mets和颅内动脉粥样硬化的相关性存在种族差异[16],因此,研究汉族人群Mets与ICAS的关系是十分必要的。研究已显示,不同性别人群Mets发病率[17]及其与ICAS 的相关性[18]可能存在差异;此外,年龄是ICAS 的独立危险因素[19]。进一步研究性别和年龄对Mets与ICAS关系的影响有重要意义。
本研究结果表明,Mets与ICAS密切相关。对缺血性卒中[8]和非缺血性卒中[9]人群的研究表明,Mets个体发生ICAS的风险更高。本研究中Mets组分数量越多,ICAS发生率越高,与WANG 等[20]的研究结果中具有5个Mets组分的病人发生无症状ICAS的风险比无Mets组分者高4 倍相一致。WONG 等[11]对至少有一项血管危险因素的高风险人群研究表明,高血压、糖尿病、高脂血症是大脑中动脉狭窄的相关因素。本研究仅显示高糖血症与ICAS密切相关,与LÓPEZ-CANCIO 等[10]在居民中随机抽样研究结果一致。高糖血症导致ICAS的机制可能如下。①长期高糖血症引发炎症反应和氧化应激导致血管内皮细胞受损[21],胰岛素减少使载脂蛋白B和极低密度脂蛋白胆固醇积累[22],促进动脉粥样硬化斑块进展。②生理条件下,胰岛素通过PI3K/Akt通路发挥血管保护作用,MAPK 通路对血管产生不利影响;胰岛素抵抗时,PI3K 通路受损,对血管的不利作用大于保护作用[23]。③胰岛素抵抗、舒张压、肥胖和Mets组分数量与动脉扩张性呈负相关,可能降低动脉扩张性[24]。但也有研究认为高糖血症与ICAS无关[12]。此外,张艳玲等[25]对中国人群研究显示饮酒与ICAS相关。本文研究结果与之相似,可能与乙醇引发血脂紊乱和炎症反应促进动脉粥样硬化有关[26-27]。但目前饮酒与动脉粥样硬化的关系国内外无定论,需进一步研究。
本文研究结果显示,Mets与ICAS的相关性受性别影响,仅女性Mets与ICAS相关,其机制尚不明确,可能与Mets女性雌激素的抗动脉粥样硬化作用受损有关[28-29]。在不同性别人群中,可能有不同的Mets组分参与了动脉粥样硬化过程,在男性和女性Mets人群中,高密度脂蛋白降低和血糖升高均与颈动脉内膜中层厚度增加相关[30]。而本研究仅在女性中显示高糖血症和ICAS相关,可能与Mets组分性状基因位点在染色体上的分布存在性别差异有关[31]。尚需要更多的临床研究探讨不同性别人群Mets及其组分与ICAS的关系。
研究表明,年龄增长是动脉粥样硬化发展的独立危险因素[19]。其机制可能是:衰老促进炎症反应并影响细胞外基质的合成使斑块进展[32];颅内动脉的抗氧化酶可抗动脉粥样硬化,但其酶活性在老年时显著下降[33]。上述机制与高糖血症导致ICAS的机制有重叠,这可能是本研究在老年人群中显示Mets与ICAS相关的原因。既往研究认为,高血压是颅内动脉粥样硬化的独立危险因素[19],但本研究仅在老年人中显示此关联。
综上所述,在汉族人群中Mets与ICAS密切相关,通过饮食、生活习惯以及药物等方式来控制Mets,尤其是控制女性高糖血症和和老年人高血压,可能有助于预防或延缓ICAS发生。本研究的不足之处在于:首先,这是一个横断面研究,只能探讨Mets及其组分与ICAS之间的关联性,结论尚需纵向研究来进一步证实;其次,本研究对象均是汉族人,这可能会限制研究结果推广到其他种族。因此,本研究得出的结论尚需通过多中心研究、队列研究进行验证。
