穿心莲内酯在肝脏疾病中的作用及纳米剂型的研究进展
2021-11-22侯海婷赵方红
杨 娴,侯海婷,赵方红
(石家庄四药有限公司研发中心,河北 石家庄 050000)
肝脏疾病和并发症包括胆汁淤积、纤维化、病毒性肝炎、药物性肝损伤及肝癌,已经成为世界范围内日益严重的公共卫生问题,影响超过10%的世界人口。在中国,大约有3亿人患有肝病;在美国,慢性肝病每年影响约3 000万人,15 000名儿童因肝病住院;欧盟受肝病影响的人数为2 900万,世界卫生组织估计欧洲每年约有47 000人死于肝癌[1]。
中药在治疗肝病方面具有独特的优势,目前发现了许多潜在的小分子化合物,如姜黄素、槲皮素和大黄素等[2-4]。穿心莲内酯(andrographolide,AG)是从中药穿心莲中提取得到的二萜化合物(见图1)。AG能够通过抑制肝脏微粒体酶(CYP1A2,CYP2E1)的活性,保持Ⅱ期酶解毒系统的稳定性,降低氧化应激和炎症反应,对多种毒性物质引起的肝脏疾病具有保护作用[5]。但是,AG水溶性差、生物利用度低,极大限制了其制剂开发与临床应用。“纳米中药”在治疗肝病方面具有广阔的发展潜力[1]。本文对AG在不同类型肝脏疾病中的作用及纳米剂型的研究进展进行综述,以期为AG的临床研究及应用提供理论依据,并为研究和开发基于纳米技术的AG新制剂提供参考。
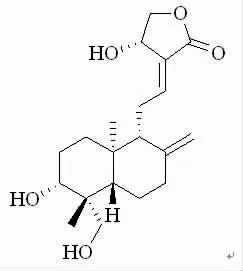
图1 穿心莲内酯的化学结构
1 穿心莲内酯在肝脏疾病中的作用
1.1 化学性肝损伤 化学性肝损伤(chemical liver injury)是由某些化学毒性物质的侵入引起不同程度的肝细胞病变、坏死,最终导致肝损伤[2]。
四氯化碳(carbon tetrachloride,CCl4)是引起急性肝损伤实验研究中最常见的化学物质。AG能够减轻CCl4诱导的肝毒性,显著降低实验动物血清中谷丙转氨酶(alanine transaminase,ALT)、谷草转氨酶(aspartate aminotransferase,AST)水平和肝脏丙二醛(malondialdehyde,MDA)的含量,显著增加肝脏超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)和谷胱甘肽(glutathione,GSH)的活性,促进血红素氧合酶-1(heme oxygenase-1,HO-1)的基因转录与蛋白表达[6-7]。此外,AG能改善CCl4诱导的组织病理学改变,降低肿瘤坏死因子-α(TNF-α)的含量,改善组织炎性浸润,减轻肝脏损伤[8]。
D-半乳糖胺(D-galactosamine,D-GalN)是一种肝细胞磷酸尿嘧啶核苷干扰剂,可造成肝弥漫性坏死和炎症。AG能降低ALT、AST、碱性磷酸酶(alkaline phosphatase,ALP)、血清总胆红素(serum total bilirubin,TBIL)、血清直接胆红素(direct bilirubin,DBIL)水平,对D-GalN诱导的肝功能障碍具有显著的调节作用。同时,AG能降低TNF-α、白介素-6(IL-6)、白介素-10(IL-10)、白介素-1β(IL-1β)的水平,抑制D-GalN诱导的肝脏炎症,减轻肝损伤[9]。
硫代乙酰胺(thioacetamide,TAA)具有直接肝毒性,能使肝脏中产生大量的自由基和活性氧(ROS),诱导氧化应激。AG能抑制核因子κB(nuclear factor kappa-B,NF-κB)活化,导致TNF-α、IL-1β、IL-6和环氧合酶-2(COX-2)基因表达减少,抑制HIF-1α信号通路,降低VEGFR1表达,抑制转化生长因子β1(TGF-β1),减少肝脏α-肌动蛋白(α smooth muscle actin,α-SMA)和细胞外基质的积累,减轻TAA诱导的肝脏损伤[10]。另外,研究发现AG能通过抗氧化损伤、抑制肝脏炎症、抑制细胞凋亡对过氧化氢、六氯环己烷、砷、铜等化学物质引起的肝损伤具有显著保护作用[11-14]。由此可见,AG对多种因素诱导的化学性肝损伤均具有一定的保护作用。
1.2 药物性肝损伤 药物性肝损伤(drug-induced liver injury)是急性肝功能衰竭甚至死亡的主要原因,也是药物从市场上撤回的最常见原因[15]。
对乙酰氨基酚(acetaminophen,APAP)是一种应用广泛的非甾体类抗炎药,过量使用APAP能够引起最常见的药物性肝损伤。研究发现,AG能降低APAP模型小鼠血清ALT、AST和ALP的水平,并减轻肝组织病变[16]。AG能降低APAP诱导的活性氧(ROS)水平,诱导核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)激活,上调抗氧化酶GCL(由GCLC和GCLM组成)、HO-1和醌氧化还原酶1(quinone oxidoreductase 1,NQO1)的表达,抑制APAP诱导的氧化应激[17]。AG能降低Toll样受体(toll-like receptor,TLR)3/4的表达,降低NF-κB的转录活性,抑制丝裂原活化蛋白激酶(MAPKs)信号转导通路的激活,抑制早期生长反应因子(Egrl)的转核及其下游组织因子(TF)和纤溶酶原激活物抑制剂1(Serpine 1)的表达,降低肝脏炎症,从而减轻APAP诱导的肝脏损伤[18]。
1.3 病毒性肝炎 病毒性肝炎(viral hepatitis)是由多种肝炎病毒引起的以肝脏病变为主的传染性疾病。长期、持续和不受控制的炎症反应是这些疾病的特征,可导致更严重的肝脏疾病进展,其中乙型肝炎和丙型肝炎是肝硬化和肝癌最常见的原因[19]。
乙型肝炎是一种由乙型肝炎病毒(hepatitis B virus,HBV)引起的传染性疾病[20]。AG能够抑制乙肝表面抗原和乙肝包膜抗原(HBeAg)的分泌,并抑制乙型肝炎病毒DNA复制,调节乙型肝炎患者细胞免疫,并增强患者HBV特异性T细胞的功能[21-22]。
丙型肝炎是一种由丙型肝炎病毒(hepatitis C virus,HCV)引起的传染性疾病[23]。AG能够诱导MAPK/p38磷酸化,激活Nrf2/HO-1信号通路,促进抗病毒干扰素反应,抑制丙型肝炎病毒NS3/4A蛋白酶及其耐药突变体R155K和D168A,抑制HCV的复制[24-25]。当AG与IFN-α、telaprevir(一种靶向丙型肝炎病毒NS3/4A蛋白酶)或PSI-7977(NS5B聚合酶抑制剂)联合用药时,AG表现出显著的协同作用[22]。
1.4 肝纤维化 肝纤维化(liver fibrosis)是一种以ECM积聚为特征的病理反应,并伴有组织修复时的肝脏炎症与氧化应激反应[26]。
AG能显著抑制肝纤维化小鼠肝脏中TGF-β1的表达,通过TGF-β1/Smad2通路,降低平滑肌α-SMA的表达,减少ECM的积累。同时,AG能显著抑制肝纤维化小鼠肝脏中TLR4的表达,抑制其下游NF-κB p50的磷酸化,通过TLR4/NF-κB p50信号通路,抑制CD68及炎症因子IL-1、IL-6和单核细胞趋化蛋白-1(monocyte chemotactic protein 1,MCP-1)mRNA水平,降低肝脏炎症[27]。AG能够抑制肝脂质过氧化,提高衰老标志物蛋白-30(SMP30)的水平,抵抗肝氧化应激。此外,AG能通过抑制N末端激酶(N-terminal kinase,JNK)和细胞外信号调节激酶(extracellular signal regulated kinase,ERK)磷酸化级联,介导肝细胞内Bax和细胞色素c水平的降低,减少肝细胞凋亡,保护肝脏[28]。
1.5 脂肪肝 酒精性脂肪肝(alcoholic fatty liver)/非酒精性脂肪肝(non-alcoholic fatty liver disease)是一种慢性进行性病理综合征,随着疾病的进展可进一步导致肝脂肪变性[29-30]。
AG能够调节肝脏及棕色脂肪组织中的胆固醇调节元件结合蛋白(sterol regulatory element-binding proteins,SREBPs)靶基因和代谢相关基因的表达,降低肝脏脂质水平,并通过抑制CD36介导的氧化低密度脂蛋白(oxidized low-density lipoprotein,ox-LDL)摄取,诱导ATP结合盒转运体A1(ATPbinding cassette transporter A1,ABCA1)和ATP结合盒亚家族G1(ATP-binding cassette sub-family G1,ABCG1)依赖的胆固醇外排,降低脂质积累[31-33]。AG能通过激活磷脂酰肌醇3激酶/蛋白激酶B(phosphatidylinositol 3 kinase/protein kinase B,PI3K/Akt)通路、Nrf2/HO-1通路,增强沉默信息调节因子2相关酶1(silent mating type information regulation 2 homolog-1,SIRT1)的表达及活性,降低氧化应激[34-36]。此外,AG能显著降低NLPR3的表达,并降低肝脏CASP1 mRNA和IL-1β mRNA的水平,降低肝脏脂肪组织炎症,达到保护肝脏的作用[30]。
1.6 胆汁淤积性肝损伤/肝内胆汁淤积 胆汁淤积(intrahepatic cholestasis)是由胆汁的合成、分泌、运输和排泄代谢功能障碍引起的病理状态,表现为TBIL、DBIL和总胆汁酸(total bile acid,TBA)升高,胆汁酸在肝脏和循环中大量积聚,诱发肝脏炎症、氧化应激,从而导致肝损伤[2]。
AG能够降低肝内胆汁淤积大鼠的TBIL、DBIL、TBA水平,降低血清肝损伤细胞因子ALP、ALT、AST、GGT的含量,从而减轻胆汁淤积性肝损伤。研究发现,AG能诱导肝细胞中孕烷X受体(PXR)mRNA表达,导致CYP3A2 mRNA表达升高,促进肝脏胆汁酸和胆红素的排泄和消除,抑制CYP7A1,抑制胆汁酸的合成,降低大鼠血清胆汁酸水平[37-38]。此外,AG可剂量依赖性地抑制NF-κB的表达,减少IL-6、TNF-α、COX-2的生成,降低肝脏炎症反应,同时诱导肝脏SIRTI和Nrf2的表达,增加抗氧化酶的水平,降低肝脏细胞内氧化应激反应,保护肝脏[28,37]。
1.7 免疫性肝损伤 免疫性肝损伤(immunologic liver injury)是一种以免疫反应为基础,以肝组织内有大量的炎症细胞浸润、肝细胞坏死为主要表现的自身免疫性疾病。
AG能够降低免疫性肝损伤小鼠血清ALT水平及肝组织LDH、MPO的含量,增加肝组织SOD1的表达,抑制COX mRNA、HIF-1α mRNA、HO-1 mRNA、Glut1 mRNA的表达;同时,AG能够剂量依赖性地抑制氧化应激诱导的肝细胞凋亡,减轻免疫性肝损伤[39]。
1.8 肝癌 肝细胞癌(hepatocellular carcinoma,HCC)是原发性肝癌的主要类型,其发病机制复杂,与多种信号通路都密切相关。
AG能够直接作用于肿瘤细胞,通过激活抗氧化系统,降低GSH水平,影响P53、Bcl-2家族,通过线粒体途径介导细胞凋亡,并通过增加细胞内过氧化氢的过量积累,诱导G2/M期的细胞周期阻滞,诱导细胞凋亡[40-41]。研究发现,AG诱导肝癌细胞G2/M期阻滞的机制可能与下调Cyclin D1和Cdc2/CyclinB等周期相关蛋白有关[42]。AG通过激活肝癌细胞亲环素D诱导的线粒体功能障碍和细胞内ROS水平升高诱导细胞的自噬死亡,而不影响Caspase-3的活性。同时,AG通过阻断VEGFD和VEGFA的表达,以及VEGFR2及其下游靶点的磷酸化,而产生抗血管生成的作用[40-41]。此外,AG能够抑制多药耐药基因MDR1的表达,逆转肿瘤多药耐药,降低GST-π基因表达,提高肿瘤对化疗药物的敏感性,促进肿瘤细胞凋亡,改变非编码单链RNA分子谱和下游信号的表达,这将有助于其抑制肝癌的研究[43]。
2 穿心莲内酯肝靶向纳米新剂型的研究
AG是一种经典的BCSⅡ类药物,在传统剂型下,溶解性差(3.29 μg/mL),肠段的代谢不稳定,生物利用度较低(0.98%)[44]。另外,药代动力学研究表明,穿心莲内酯主要分布于肾脏,肝靶向不明显,这很大程度上影响了其治疗肝病的效果。
纳米制剂能够在很大程度上增加药物的溶解性,提高药物稳定性,改善药物组织分布和生物利用度,提高药物的药效[45]。纳米制剂主要分为纳米药物和纳米载药系统两类。
2.1 纳米药物 纳米药物主要为纳米晶(nanocrystals,见图2A),纳米晶是20世纪末发展起来的针对难溶性药物开发的一种新剂型,该技术以少量表面活性剂或高分子材料作为稳定剂,通过降低药物粒径至纳米级来增加难溶性药物的溶出度,从而提高药物组织通透性和口服生物利用度[46]。
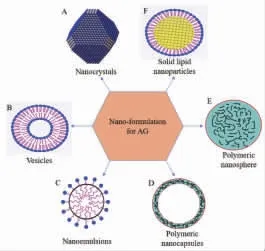
图2 处于临床前开发阶段的穿心莲内酯纳米制剂
BASU A等[47]将穿心莲内酯的DMSO溶液注射到1%吐温80水溶液中制备穿心莲内酯纳米晶混悬剂。该混悬剂的水溶性比穿心莲内酯高5倍,同时具有良好的肠道渗透性,能够在较小的剂量下,降低APAP诱导的小鼠肝损伤。GUO L等[48]采用湿法球磨技术,将3%的AG、5%的泊洛沙姆188、0.1%的牛油脱氧胆酸钠和0.05%的脱氧胆酸钠用0.4 mm的氧化锆小珠研磨制备穿心莲内酯纳米晶混悬剂。该纳米颗粒溶解度显著增加,可在0.25 h内完全释放。使用甘露醇(5%)作为低温保护剂的冻干配方在6个月的贮藏期内具有良好的物理和化学稳定性。药代动力学和组织分布研究表明,穿心莲内酯纳米晶混悬剂主要分布于肝脏,并可迅速从血液中清除。为了进一步提高穿心莲内酯的载药量和溶出速度,XU J N等[44]利用纳米晶的特点和直接压缩技术,以琥珀酸酯(TPGS)和聚维酮30(Povidone 30,PVPK30)作为亲水性载体和稳定剂,利用微晶纤维素(Microcrystalline cellulose,MCC)和乳糖作为纳米晶复合颗粒的基质形成剂,制备了固体自纳米分散递送系统(AG-SNDS)。纯水中,30 min的溶出度为85.87%,Cmax和AUC0-∞显著高于AG(P<0.05),其中AG-SNDS的AUC是AG的3.09倍。
2.2 纳米载药系统
2.2.1 囊泡 囊泡(vesicles,见图2B)是由两亲性分子形成的封闭双分子层载体,两亲分子若是天然卵磷脂,则形成的结构称为脂质体。与脂质体相比,囊泡不含有磷脂,易制备储存,具有较低的生产成本和较高的化学稳定性。囊泡可以装载亲水和疏水化合物,可促进药物跨膜转运,增加药物稳定性,同时可通过控制囊泡的粒径实现肝脏被动靶向[49]。
TU Y S等[50]以Span 60为表面活性剂,采用薄膜水合/超声法制备了穿心莲内酯囊泡。这些囊泡改善了穿心莲内酯在小鼠体内的组织分布和生物利用度。特别是,载穿心莲内酯的囊泡体内消除变慢,在肝脏中的分布比游离药物显著增加。有研究[51]采用同样的方法,制备了天然大豆磷脂酰胆碱为表面活性剂的穿心莲内酯囊泡,利用CCl4诱导的大鼠肝损伤模型证明了穿心莲内酯囊泡的肝保护潜力。结果显示,与AG相比,囊泡中穿心莲内酯的吸收、生物利用度和肝保护潜力显著增加,且穿心莲内酯囊泡的药效与水飞蓟素相当。其他研究[52-53]利用相同的处方也得到了类似的结果。
2.2.2 纳米乳 纳米乳液(nanoemulsions,见图2C)是一种胶体分散体系,乳液是透明或半透明的液体稳定体系,并在乳化技术下形成,水相、油相、表面活性剂等为其主要的组成部分。它的这些特性使得药物在体内更容易穿透生物膜而被吸收。纳米乳能够使得药物消除半衰期延长,生物利用度提高[54]。
MISHRA N等[9]采用层层静电沉积技术,将壳聚糖静电沉积在海藻酸盐表面,制备了一种稳定的多层穿心莲内酯纳米乳(NE)。超声20 min后,NE的稳定性最佳,此时粒径为90.8~167.8 nm,zeta电位为22.90~31.01 mV。穿心莲内酯纳米乳的多层结构增强了其溶解度和稳定性,在各种模拟生物液中,NE表现出选择性释放模式,即在胃液中稳定,在肠道内释放。在D-GalN-LPS诱导的肝损伤小鼠体内,AG主动靶向肝脏,在25 mg/kg的剂量下能使肝功能和血清细胞因子显著恢复。
2.2.3 聚合物纳米粒 聚合物纳米粒(polymeric nanoparticles)是最广泛的递送系统,包括纳米囊(nanocapsules,见图2D)和纳米球(nanospheres,见图2E)。纳米球主要以高分子基质为骨架,药物分散在其内部,而在纳米囊中,药物被高分子材料形成的外壳包围在核中心。聚合物纳米粒在结构完整性、储存期间的稳定性、制备方法的多样性,以及提高药物的生物利用度,实现高效药物靶向性和控制释放等方面表现出较大的优势[45]。
DAS S等[13]以聚乳酸-羟基乙酸共聚物(PLGA)作为骨架材料,采用改进的乳化溶剂蒸发法,制备了PLGA-穿心莲内酯纳米粒(PLGA-AG)。PLGA-AG平均粒径为65.8 nm,包封率为64%。在砷诱导的小鼠肝脏损伤模型中,PLGA-AG的有效率比AG高5倍。为了进一步提高PLGA-AG的生物相容性,渗透性及口服给药活性,ROY P等[55]在PLGA上接枝壳聚糖,与AG相比,壳聚糖修饰的PLGA-AG具有更好的溶解性。利用荧光素标记观察壳聚糖修饰的PLGA-AG的分布,发现其容易内吞并快速定位于肝组织,在CCl4诱导肝损伤模型中,有助于肝脏功能和氧化应激标志物的恢复。
2.2.4 固体脂质纳米粒 固体脂质纳米粒(solid lipid nanoparticles,见图2F)是一种可替代脂质体和聚合纳米粒的新型胶体给药系统,它以生理相容性好、体内可生物降解的天然或合成的类脂为载体,将药物包载于脂质核中,平均直径为10~1 000 nm。固体脂质纳米粒在肠外应用的主要特点是具有良好的物理稳定性,对所含不稳定药物的降解具有保护作用,对药物释放具有控制作用[56]。
PARVEEN R等[57]以十六醇为脂质载体、吐温80为表面活性剂、聚乙烯醇为稳定剂、乙醇为有机溶剂,采用改进的溶剂注射法制备穿心莲内酯固体脂质纳米粒(AG-SLNs)。与AG相比,AG-SLNs的Tmax值增加,显示了缓释特性,AUC和Cmax值增加,保证了肝脏的有效药量及生物利用度。同时,AG-SLNs的抗肿瘤活性增加,AG-SLNs干预后BALB/c小鼠的生存率与存活时间显著提高。为了进一步提高AG的生物利用度,YANG T等[58]采用高压均质法,以ATO888和GSM为载体,制备了AG-SLNs,然后用5%甘露醇作为保护剂进行冻干。AG-SLNs通过增加AG在肠内的溶解度和稳定性,以及改变其在Caco-2细胞中的转运方式来提高生物利用度。与AG相比,AG-SLNs生物利用度提高241%。在高脂血症动物模型中,AG-SLNs能显著降低小鼠血清TC、TG和LDL水平(P<0.01),药效明显优于AG,进一步说明AG-SLN制剂提高了AD的生物利用度。
3 总结与展望
随着生活水平的提高,酒精性/非酒精性脂肪肝、药物性肝炎、代谢异常引起的肝病、HCC的发病率增加。因此,迫切需要开发更有效的治疗肝病的药物。以典型中药为基础的保肝药物具有广阔的市场潜力。
非临床研究发现,穿心莲内酯通过多种作用模式对多种肝病显示出一定的治疗作用,是一种具有临床应用潜质的药物。目前,穿心莲内酯在肝病中的研究主要集中在其治疗化学性肝脏损伤的作用上,对于抗病毒性肝炎的研究相对较少,而病毒性肝炎发病率高,治疗方案有限并伴随许多不良反应,长期给药会导致耐药,且目前大多数抗病毒药物价格较高,因此,进一步研究穿心莲内酯在病毒性肝炎中的作用具有重要的意义。此外,目前穿心莲内酯保肝作用及机制的研究仅限于有限的细胞系和动物模型,随着新动物模型的发现,斑马鱼已被用于肝脏相关疾病的研究,这将进一步丰富穿心莲内酯保肝作用的研究。
穿心莲内酯表现出良好的保肝作用,但是仍存在溶解度差、生物利用度低、生物分布和定位有限、生物半衰期很短等问题。穿心莲内酯肝脏保护作用主要集中在药效的研究上,结果没有明确指出药物在肝细胞中的定位,多数研究没有给出药代动力学数据。穿心莲内酯的纳米制剂在提高穿心莲内酯的生物利用度、靶组织分布和疗效等方面取得了显著的效果。同时,纳米递送系统给出了关于穿心莲内酯生物利用度和在肝组织中定位的明确信息,如FITC荧光探针显示出壳聚糖修饰的PLGA纳米粒子高的肝脏定位,HPLC-MS结果证实了囊泡高度定位于肝脏等。因此,纳米制剂是具有发展前景的新型给药系统,开发生物相容性好、可降解、细胞穿透力强、非免疫原性、易于修饰,并能在血液循环中保留较长时间的新纳米载体材料或更有效的纳米给药系统对于穿心莲内酯新纳米制剂的开发具有重要意义。此外,药代动力学研究、制剂优化和此类制剂受控的前瞻性双盲多中心对照研究是允许这些新型制剂临床研究的主要限制因素。
总之,随着研究人员对穿心莲内酯在肝病中作用机制的深入研究,以及更加智能化和更多类型的纳米载体和纳米药物的开发,穿心莲内酯在肝脏疾病中的应用将得到更广泛的认可,使其在临床上具有广阔的应用前景。
