基于TLR4通路探讨自拟清热凉血方对牙周炎大鼠的抑炎作用及对牙周组织生长的影响*
2021-11-22赵雁焕杨春山
许 楠,赵雁焕,杨春山
(唐山市协和医院,河北 唐山 063000)
牙周炎是牙齿周围组织慢性破坏性进行性疾病,可引起牙龈发炎、牙周袋及牙槽骨吸收陷窝形成,导致牙齿动摇甚至脱落。我国牙周病患病率高达92%,是成年人牙齿损伤及缺失的主要原因[1]。致病微生物是牙周病的主要因素,研究表明牙菌斑中革兰氏阴性厌氧菌与牙周炎发生密切相关[2]。大多数牙周病组织损伤由宿主本身对感染应答引起,如牙周致病菌及其毒性产物可通过白介素、前列腺素、一氧化氮和基质金属蛋白酶等导致骨吸收与组织炎症。中医学认为牙周炎与肾虚、气血不足及胃火上炎有关,故补气养肾、清热败火是治疗该病的关键[3]。自拟清热凉血方由生地黄、赤芍、栀子、连翘、淡竹叶、玄参、牡丹皮、水牛角、川黄柏、白茅根、茜草和紫草组成,有清胃泻火、消肿止痛、滋阴补肾、益精固齿、调补气血、养龈健齿的作用[4]。Toll样受体4(Toll-like receptors 4,TLR4)属于天然免疫受体家族,其表达受到肿瘤坏死因子-α(TNF-α)和白细胞介素-1β(IL-1β)等炎症因子调节,TLR4在中枢神经系统炎症免疫反应中起着重要调控作用[5]。研究表明,许多中药是通过TLRs信号通路来发挥免疫调节作用,如金茵清热口服液可以活化髓样分化因子88(myeloid differentiation factor 88,MYD88)依赖型TLR信号通路,而且TLR2抑制剂可以阻断金茵清热口服液介导的干扰素调节因子3(Interferon regulatory Factor 3,IRF3)和核因子κB(nuclear factor kappa-B,NF-κB)的核转位[6]。TLR4通路抗牙周炎及对牙周组织生长的影响作用机制研究较少,本研究通过建立牙周炎大鼠模型,探讨自拟清热凉血方对牙周炎大鼠的影响及可能作用机制,旨在为临床治疗牙周炎提供依据。
1 材料与方法
1.1 实验动物8周龄健康SPF级Sprague-Dawley(SD)雄性大鼠85只,体质量(250±35)g,由上海斯莱克实验动物有限责任公司提供,动物生产许可证号:SCXK(沪)2018-0003。所有大鼠实验前于室温23~25℃,湿度50%~65%,人工12 h昼/夜循环照明,分笼饲养,自由摄食及饮水。本研究经唐山市协和医院动物实验伦理委员会审查并批准。
1.2 药物与试剂 自拟清热凉血方,方药组成:生地黄20 g,赤芍12 g,栀子10 g,连翘12 g,淡竹叶8 g,玄参15 g,牡丹皮12 g,水牛角30 g(先煎),川黄柏15 g,白茅根15 g,茜草30 g,紫草30 g,上述药材由唐山市协和医院中药房提供,经唐山市协和医院中药房主任鉴定为正品,上述药材加水1 L,文火煎煮,浓缩至300 mL。
TLR4通路抑制剂IAXO-102(美国MedChemExpress公司,批号:HY-125171,纯度>98.0%);兔抗大鼠MYD88单克隆抗体(英国Abcam公司,批号:ab133739);NF-κB p65多克隆抗体(美国Abbkine公司,批号:ABP51951);p-NF-κB p65多克隆抗体(美国Abbkine公司,批号:ABP0043);TLR4多克隆抗体(英国Abcam公司,批号:ab13556);辣根过氧化物酶标记的山羊抗兔IgG(上海碧云天生物技术有限公司,批号:A0208);荧光定量PCR试剂盒(上海翊圣生物科技有限公司,批号:11201ES08);反转录试剂盒(上海翊圣生物科技有限公司,批号:11141ES10);TNF-α酶联免疫试剂盒(上海通蔚生物科技有限公司,批号:tw045949);IL-1β酶联免疫试剂盒(上海通蔚生物科技有限公司,批号:tw039569)。
1.3 主要仪器HBS-1101全自动酶标仪(南京德铁实验设备有限公司);CX-41型生物显微镜(日本Olympus公司);CFX荧光定量PCR仪(美国BIO-RAD公司)。
1.4 造模及分组85只大鼠随机取70只,按照徐梅等[7]的方法建立牙周炎大鼠模型,3%戊巴比妥钠30 mg/kg腹腔注射轻度麻醉,仰卧固定,用丝线结扎上颌右侧第一磨牙2~3圈,在牙龈上缝一针固定丝线。从实验当天起,喂10%蔗糖水及软饲料(大鼠正常饲料上喷含大鼠粪便的水,使其变软)。造模4周后,肉眼检查大鼠牙龈组织有充血、出血、肿胀、溢脓、溃疡、糜烂等现象出现,并且牙龈指数≥2,即为建模成功。国际通用牙龈指数评价标准[8]:牙龈健康,为0分;牙龈轻度炎症即牙龈的颜色有轻度改变并轻度水肿,探诊不出血,为1分;牙龈中等炎症即牙龈色红,水肿光亮,探诊出血,为2分;牙龈严重炎症即牙龈明显红肿或有溃疡,并有自动出血倾向,为3分。将建模成功的64只大鼠随机分为模型对照组、抑制剂组、自拟清热凉血方低剂量组(简称低剂量组)、自拟清热凉血方高剂量组(简称高剂量组),每组16只,其余15只大鼠为正常对照组。
1.5 实验给药 建模成功后开始干预,灌胃剂量按照《中药药理学》[9]中人和动物体表面积折算的等效剂量比率表计算。低、高剂量组大鼠分别灌胃自拟清热凉血方,0.75、1.50 mg/kg;抑制剂组、正常对照组和模型对照组每只大鼠均灌胃等量生理盐水,2次/d。同时抑制剂组腹腔注射TLR4通路抑制剂IAXO-102(IAXO-102溶于无水乙醇,用生理盐水稀释为无水乙醇体积分数为5%),3 mg/kg。其余各组腹腔注射等量含5%无水乙醇的生理盐水,1次/d。各组大鼠连续用药3个月。
1.6 观察指标
1.6.1 一般情况观察 观察各组大鼠造模前、干预结束后24 h一般情况,包括毛发、饮食、活动、体质量等。
1.6.2 牙龈指数 根据“1.4”中国际通用牙龈指数评价标准,评估各组大鼠干预后牙龈指数变化。
1.6.3 动物取材及处理 完成一般情况及牙龈指数检测后,大鼠以3%戊巴比妥钠(30 mg/kg)腹腔注射麻醉,摘眼球法采集静脉血2 mL,随后分离上颌右侧磨牙区,冰上剥离牙周组织,分为3份,2份置于液氮保存,1份置于10%福尔马林固定。
1.6.4 ELISA法检测血清中TNF-α和IL-1β水平 取静脉血,3 500 r/min,离心5 min,离心半径为8 cm,取上层血清,-20℃保存备用,测定TNF-α和IL-1β的含量。按照酶联免疫试剂盒说明书加样,用全自动酶标仪测定450 nm处的吸光(A值),通过绘制标准曲线得出TNF-α和IL-1β的含量。
1.6.5 HE染色观察牙周组织病理学变化 取10%福尔马林固定牙周组织,10%盐酸脱钙,流水冲洗24 h,梯度乙醇脱水,石蜡包埋、切片,厚4~5 μm,HE染色,用光学显微镜观察牙龈、牙周膜及牙槽骨等牙周组织病变。
1.6.6 RT-qPCR检测TLR4 mRNA、MYD88 mRNA及NF-κB p65 mRNA相对表达水平 取1份液氮保存牙周组织,冰上研磨,用TRIzol法提取总RNA,TaKaRa逆转录试剂盒将总RNA反转录为cDNA。进行RT-qPCR,检测TLR4 mRNA、MYD88 mRNA、NF-κB p65 mRNA相对表达量。PCR反应条件为A:预变性95℃3 min;B:变性95℃15 s;退火56℃20 s,延伸72℃20 s,共45个循环;C:72℃5 min,4℃终止反应。以GAPDH为内参基因,取均值,采用2-△△Ct法对数据进行相对定量分析。引物由上海生工生物技术有限公司合成,引物序列见表1。

表1 引物序列
1.6.7 Western blotting检 测TLR4、MYD88、NF-κB p65、p-NF-κB p65蛋白相对表达水平 取1份液氮保存牙周组织,加入蛋白提取裂解液,冰上裂解,离心取上清用BCA蛋白定量试剂盒进行定量,95℃水浴使蛋白变性,进行SDS-PAGE凝胶电泳,电转至PVDF膜,5%脱脂牛奶室温封闭2 h,洗膜后分别加入1∶1 000稀释的MYD88、N-FκB p65、p-NF-κB p65单克隆抗体,TLR4多克隆抗体,4℃孵育过夜,洗膜后加入1∶4 000辣根过氧化物酶标记的山羊抗兔IgG,室温孵育1 h,洗膜后加入ECL发光液显影,采用Image J软件分析图像,以β-actin为内参,各蛋白条带灰度值/β-actin蛋白条带灰度值表示TLR4、MYD88、NF-κB p65、p-NF-κB p65蛋白相对表达量。
1.7 统计学方法 采用SPSS 25.0统计学软件进行分析,计量资料以“均数±标准差”(s)表示,多组比较采用单因素方差分析,两两比较采用LSD-t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠一般情况 造模前,所有大鼠毛发光亮、饮食正常、活动灵敏。干预后,正常对照组大鼠毛发光亮,饮食及活动正常;模型对照组大鼠皮毛粗糙无光泽,少动,食欲不振,体质量减轻;与模型对照组比较,低剂量组、高剂量组和抑制剂组大鼠皮毛逐渐恢复光泽,食欲变好,活动增加,体质量明显增加。
2.2 各组大鼠牙龈指数比较 正常对照组大鼠牙龈指数为0;模型对照组大鼠牙龈指数明显高于正常对照组(P<0.01);低剂量组、高剂量组和抑制剂组大鼠牙龈指数均低于模型对照组(P<0.01);高剂量组和抑制剂组大鼠牙龈指数明显低于低剂量组(P<0.01);抑制剂组大鼠牙龈指数明显低于高剂量组(P<0.01)。(见表2)
表2 各组大鼠牙龈指数比较s,分)

表2 各组大鼠牙龈指数比较s,分)
注:与正常对照组比较,aP<0.01;与模型对照组比较,bP<0.01;与低剂量组比较,cP<0.01;与高剂量组比较,dP<0.01
组别 动物数(只) 给药剂量(mg/kg) 牙龈指数正常对照组 15 - 0模型对照组 16 - 2.21±0.32a低剂量组 16 0.75 1.11±0.12b高剂量组 16 1.50 0.70±0.08b c抑制剂组 16 3.00 0.34±0.04b c d F 46.422 P 0.000
2.3 各组大鼠血清TNF-α和IL-1β水平比较 与正常对照组比较,模型对照组、低剂量组、高剂量组和抑制剂组大鼠血清TNF-α和IL-1β水平升高(P<0.01);与模型对照组比较,低剂量组、高剂量组和抑制剂组大鼠血清TNF-α和IL-1β水平降低(P<0.01);与低剂量组比较,高剂量组和抑制剂组大鼠血清TNF-α和IL-1β水平降低(P<0.05);与高剂量组比较,抑制剂组大鼠血清TNF-α和IL-1β水平降低(P<0.05)。(见表3)
表3 各组大鼠血清TNF-α和IL-1β水平比较,ng/L)

表3 各组大鼠血清TNF-α和IL-1β水平比较,ng/L)
注:与正常对照组比较,aP<0.01;与模型对照组比较,bP<0.01;与低剂量组比较,cP<0.05;与高剂量组比较,dP<0.05
组别 动物数(只)给药剂量(mg/kg)TNF-α IL-1β正常对照组 15 - 125.32±10.32 108.62±11.85模型对照组 16 - 259.62±15.78a 268.68±21.32a低剂量组 16 0.75 164.21±13.25ab 172.16±18.24ab高剂量组 16 1.50 150.02±12.15abc 146.32±15.22abc抑制剂组 16 3.00 135.54±11.05abcd 128.14±12.36abcd F 325.041 152.154 P 0.000 0.000
2.4 HE染色观察牙周组织病理学变化 正常对照组大鼠牙周组织正常;模型对照组大鼠牙龈组织糜烂、溃疡,炎症细胞形成,牙周袋出现并加深,牙槽骨骨吸收陷窝形成;低剂量组、高剂量组和抑制剂组大鼠牙龈组织破坏情况得到改善,炎症细胞减少,牙周袋逐渐变浅,牙周间隙逐渐恢复正常,牙槽骨出现新生,且抑制剂组修复效果更好。(见图1)

图1 各组大鼠牙周组织病理学变化比较(HE,×400)
2.5 各组大鼠牙周组织TLR4 mRNA、MYD88 mRNA及NF-κB p65 mRNA相对表达量比较 与正常对照组比较,模型对照组、低剂量组、高剂量组和抑制剂组大鼠牙周组织TLR4 mRNA、MYD88 mRNA相对表达量明显升高(P<0.01);与模型对照组比较,低剂量组、高剂量组和抑制剂组大鼠牙周组织TLR4 mRNA、MYD88 mRNA相对表达量明显降低(P<0.01);与低剂量组比较,高剂量组和抑制剂组大鼠牙周组织TLR4 mRNA、MYD88 mRNA相对表达量明显降低(P<0.01);与高剂量组比较,抑制剂组大鼠牙周组织TLR4 mRNA、MYD88 mRNA相对表达量明显降低(P<0.01)。5组大鼠牙周组织NF-κB p65 mRNA相对表达量比较,差异无统计学意义(P>0.05)。(见表4)
表4 各组大鼠牙周组织TLR4 mRNA、MYD88 mRNA、NF-κB p65 mRNA相对表达量比较s)
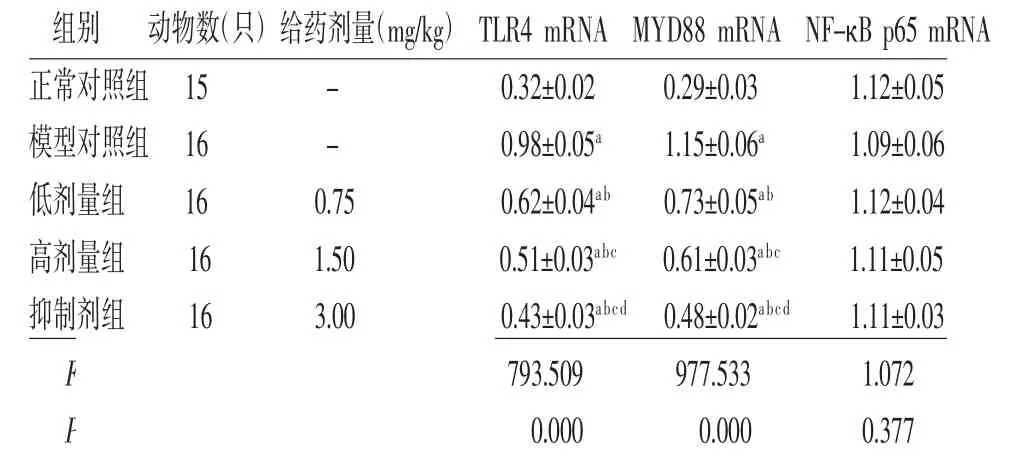
表4 各组大鼠牙周组织TLR4 mRNA、MYD88 mRNA、NF-κB p65 mRNA相对表达量比较s)
注:与正常对照组比较,aP<0.01;与模型对照组比较,bP<0.01;与低剂量组比较,cP<0.01;与高剂量组比较,dP<0.01
组别 动物数(只)给药剂量(mg/kg)TLR4 mRNA MYD88 mRNA NF-κB p65 mRNA正常对照组15 - 0.32±0.02 0.29±0.03 1.12±0.05模型对照组16 - 0.98±0.05a 1.15±0.06a 1.09±0.06低剂量组 16 0.75 0.62±0.04ab 0.73±0.05ab 1.12±0.04高剂量组 16 1.50 0.51±0.03abc 0.61±0.03abc 1.11±0.05抑制剂组 16 3.00 0.43±0.03abcd 0.48±0.02abcd 1.11±0.03 F 793.509 977.533 1.072 P 0.000 0.000 0.377
2.6 各组大鼠牙周组织TLR4、MYD88、NF-κB p65、p-NF-κB p65蛋白相对表达量比较 与正常对照组比较,模型对照组、低剂量组、高剂量组和抑制剂组大鼠牙周组织TLR4、MYD88、p-NF-κB p65蛋白相对表达量明显升高(P<0.01);与模型对照组比较,低剂量组、高剂量组和抑制剂组大鼠牙周组织TLR4、MYD88、p-NF-κB p65蛋白相对表达量明显降低(P<0.01);与低剂量组比较,高剂量组和抑制剂组大鼠牙周组织TLR4、MYD88、p-NF-κB p65蛋白相对表达量明显降低(P<0.01);与高剂量组比较,抑制剂组大鼠牙周组织TLR4、MYD88、p-NF-κB p65蛋白相对表达量明显降低(P<0.01)。5组大鼠牙周组织NF-κB p65蛋白相对表达量比较,差异无统计学意义(P>0.05)。(见图2、表5)
表5 各组大鼠牙周组织TLR4、MYD88、NF-κB p65及p-NF-κB p65蛋白相对表达量比较

表5 各组大鼠牙周组织TLR4、MYD88、NF-κB p65及p-NF-κB p65蛋白相对表达量比较
注:与正常对照组比较,aP<0.01;与模型对照组比较,bP<0.01;与低剂量组比较,cP<0.01;与高剂量组比较,dP<0.01
组别 动物数(只)给药剂量(mg/kg)TLR4 MYD88 NF-κB p65 p-NF-κB p65正常对照组 15 -模型对照组 16 -低剂量组 16 0.75高剂量组 16 1.50抑制剂组 16 3.00 F 229.227 343.869 0.148 482.911 P 0.000 0.000 0.963 0.000 0.29±0.02 0.83±0.09a 0.58±0.06a 0.50±0.04abc 0.38±0.03abcd 0.31±0.03 0.85±0.08a 0.56±0.04ab 0.47±0.03abc 0.37±0.02abcd 0.89±0.05 0.89±0.06 0.88±0.05 0.88±0.07 0.89±0.05 0.39±0.03 0.79±0.04a 0.57±0.03ab 0.51±0.03abc 0.37±0.02abcd

图2 各组大鼠牙周组织TLR4、MYD88、NF-κB p65、p-NF-κB p65蛋白表达western blotting图
3 讨 论
牙周炎是一种慢性破坏性炎症疾病。牙菌斑是导致牙周炎的起始因子,牙菌斑中各种致病微生物及毒素不仅直接破坏牙周组织,还通过宿主自身免疫反应与多种炎症细胞因子损伤牙周组织。目前牙周炎治疗方式主要是基础治疗与手术治疗,并辅以抗生素,但抗生素存在副作用,且长期使用会导致致病微生物产生抗药性。中医学称牙周炎为牙宣,牙宣之病变虽在牙周组织,但与全身脏腑气血阴阳之盛衰有密切因果关系,尤与胃火、肾虚、气血不足有关,清热凉血中药有败火、消肿、补气、养肾功能,对牙周炎有明显疗效。因此,本研究用自拟清热凉血方对牙周炎模型大鼠进行治疗,探究其对牙周炎的抑炎作用及对牙周组织生长的影响,旨在为临床治疗提供思路。
《黄帝内经》云:“肾主骨,齿为骨之余”,牙齿与骨一样由肾滋养,因此出现肾阴虚则虚火上炎,牙龈萎缩、红肿、牙根颈宣露、牙齿松动,治宜滋肾阴、清火邪为主[10]。清热凉血方中的生地黄有清热、生津、滋阴、养血的功效;赤芍和茜草有凉血止血、活血祛瘀的功效;栀子具有清热泻火、凉血解毒、消肿止痛的功效;连翘主要治心肺积热;淡竹叶有清热、泻火、利尿的功效;玄参清热凉血,滋阴降火;牡丹皮具有清热凉血、活血化瘀、退虚热等功效;水牛角有清热、凉血、定惊、解毒的作用;川黄柏和白茅根有清热解毒、凉血止血、泻火燥湿等功效;紫草活血凉血,补中益气。诸药合用,共奏清热解毒、凉血、滋肾补气之功效。有研究表明生地黄、赤芍、枸杞子、金银花、连翘和丹参组成的养肾平消方用于治疗慢性牙周炎,治疗组临床有效率高于对照组,牙周指数明显降低,揭示其对牙周炎具有抑制作用[11]。张建霞等[12]通过检测牙周炎模型大鼠血清IL-4、IL-6和TNF-α水平及牙周组织病理学变化,证实补肾坚骨汤(主要成分为熟地黄、川黄柏)通过降低IL-6和TNF-α水平,升高IL-4水平,达到抑制牙周组织炎症、减缓牙周组织破坏的作用。另有研究采用酶联免疫吸附实验观察中药补肾合剂治疗牙周炎的效果,发现其可降低牙周炎大鼠外周血中TNF-α的含量,改善牙周局部情况,补肾合剂主要成分为生地黄、川黄柏、白茅根等[13]。本研究中,低剂量组、高剂量组和抑制剂组大鼠皮毛逐渐恢复光泽,食欲变好,活动与体质量增加,牙龈指数降低,血清TNF-α和IL-1β水平降低,牙周组织病理学变化得到改善,提示清热凉血中药能减轻牙周组织炎症反应,发挥抗炎作用。
牙龈卟啉单胞菌(Porphyromonas gingivalis,Pg)是目前公认的与牙周炎关系最密切的口腔细菌,属于革兰氏阴性菌[14]。TLR4主要识别Pg细胞膜上的脂多 糖(lipopolysaccharide,LPS),LPS与TLR4结合,通过MyD88依赖性信号转导通路介导炎症因子的分泌[15]。MyD88的启动使下游的I-κB迅速被磷酸化激活,与NF-κB解离,NF-κB进入细胞核,与激活蛋白1共同作用促使细胞因子TNF-α、IL-1等分泌,形成组织周围炎症反应[16]。慢性牙周炎组IL-1β含量明显高于健康组,而且TLR4蛋白表达明显增加,揭示牙周炎发生可能与TLR4跨膜蛋白有关[17]。有TLR4在介导牙周组织炎症的信号传递,参与牙周组织破坏过程中发挥了重要作用[18-20]。本研究中低剂量组、高剂量组及抑制剂组大鼠牙周组织TLR4 mRNA、MYD88 mRNA相对表达量明显降低,TLR4、MYD88和p-NF-κB p65蛋白相对表达量明显降低,提示自拟清热凉血方能通过抑制TLR4通路发挥抑炎作用。
综上所述,自拟清热凉血方对大鼠牙周炎有抑炎作用且影响牙周组织生长,可能是通过抑制TLR4信号通路发挥作用的,为临床牙周炎的治疗提供了理论依据。
