蒺藜苜蓿GPAT 基因家族的全基因组鉴定、序列变异和表达分析
2021-11-22杨成兰段瑞君武雄雄祁存英马银花熊辉岩
杨成兰,段瑞君,武雄雄,祁存英,马银花,熊辉岩
(1. 青海大学生态环境工程学院,青海 西宁 810016;2. 青海大学农牧学院,青海 西宁 810016)
甘油脂类是细胞膜、种子贮藏油和表皮角质层蜡质的主要成分,在与植物生长发育相关的基本细胞代谢和抗逆性中发挥重要作用[1]。甘油-3-磷酸酰基转移酶(glycerol-3-phosphate acyltransferase, GPAT)是甘油脂类代谢中催化酰基从酰基辅酶A (acyl coenzyme A, acyl-CoA)或酰基载体蛋白 (acyl-carrierprotein, acyl-ACP)转移到甘油-3-磷酸(glycerin-3-phosphate, G3P)的sn-1 或sn-2 位 生 成 溶 血 磷 脂酸(lysophosphatidic acid, LPA)的重要酶类[2]。陆生植物GPAT 亦可利用ω-氧化脂酰基-CoA 或超长链脂酰基-CoA 作为酰基供体催化G3P 的sn-2 脂酰基化反应而形成sn-2 溶血磷脂酸(LPA) 或sn-2 单脂酰甘油(monoacylglycerol, MAG),为角质层角质和软木脂聚酯合成提供单体构件[3]。由于角质层和软木脂与植物抗逆性直接相关,因此GPAT 在植物抗逆方面十分重要。
GPATs 在许多植物中均有表达,在质体、内质网和线粒体3 种不同的亚细胞中均能观察到GPATs的活性。质体GPAT 是可溶的,以酰基ACP 为底物,而位于内质网和线粒体上的GPAT 是膜结合的,以acyl-CoA 和acyl-ACP 为天然的酰基供体,主要参与角质、软木脂和贮藏脂质的合成[4-5]。在拟南芥(Arabidopsis thaliana)中,GPAT基因家族的成员因其在受精、种子发育、胁迫耐受和角质或亚角质生成中的作用而被广泛研究[6-8]。除此之外,GPATs也在各种作物中进行了研究,包括向日葵(Helianthus annuus)[9]、水稻(Oryza sativa)[10]、番茄(Lycopersicon esculentum)[11]、玉米(Zea mays)[12]以及甘蓝型油菜(Brassica napus)[2]。
盐碱胁迫作为植物非生物胁迫的重要限制因子,导致土地盐渍化,严重限制了植物的正常生长[13],从而影响了农牧业的可持续发展。目前,土地盐碱化已经成为一个世界性的环境问题,我国盐碱地主要分布在东北、华北、西北及沿海地区,盐碱地总面积约1 亿hm2[13]。青海省海西柴达木地区由于气候极端干燥,降雨少,蒸发量大,盐离子浓度不断升高,形成大面积盐碱土,从而植被稀少,生态环境脆弱[14]。紫花苜蓿(Medicago sativa)因其蛋白含量丰富被称为“牧草之王”,可作为优质牧草使用,广泛分布在我国华北、西北和东北等地区,目前已在青海省开展推广种植。但盐碱化成为了制约紫花苜蓿推广的关键因素之一。已有研究阐述了紫花苜蓿的抗盐碱机制[15],但绝大多数均是从生化角度分析,对其抗盐碱机理的更深层的研究还不多。
蒺藜苜蓿(M. truncatula)作为豆科模式植物代表,具有基因组小、生长周期短、遗传转化体系成熟等特点,可以较好地开展基因功能研究,目前蒺藜苜蓿测序也已完成,可以为紫花苜蓿等近缘种研究提供指导。因此,本研究选用蒺藜苜蓿进行GPAT基因家族的全基因组比较分析,包括系统发育、基因结构和基因表达分析,从而为进一步开展GPAT基因在紫花苜蓿盐胁迫中的功能研究提供基础资料。
1 材料与方法
1.1 GPAT 基因家族成员的序列检索与鉴定
从 Ensembl (http://plants.ensembl.org/index.html)数据库中下载蒺藜苜蓿基因组测序数据。以拟南芥的GPAT 蛋白序列为基础,采用BLASTp 和HMM (E= 0.000 01)两种方法搜索了蒺藜苜蓿的GPAT候选基因。随后采用Pfam (http://pfam.sanger.ac.uk/)、NCBI CDD (https://www.ncbi.nlm.nih.gov/cdd/)和SMART(http://smart.emblheidelberg.de/)应用数据库确认GPAT家族的每个候选成员是否具有Pfam 的PlsC酰基转移酶结构域(PF01553)。利用在线ExPASy(http://web.expasy.org/)工具预测GPAT 蛋白的理论分子量(molecular weight, MW)和等电点(isoelectric point, pI),并 使 用 在 线Plant-PLoc server (http://www.csbio.sjtu.edu.cn/bioinf/plant-multi/)服务器预测亚细胞定位。
1.2 系统发育结构
使用MEGA 7 软件中的ClustalW 程序进行执行默认参数的多序列比对,然后进行手动比较和细化。采用邻域连接(Neighbor-Joining, NJ)方法构建不同的系统发育树,参数采用成对删除选项、泊松修正模型和均匀率。Bootstrap 检验设定1000 次重复,以评价系统发育树的统计可靠性。此外,在系统发育树的构建中还应用了极大似然法,以验证与NJ 法的一致性。
1.3 染色体定位
根据基因组注释文件中提供的位置信息,将所有蒺藜苜蓿GPAT基因定位到相应的染色体上。Mapchartv 2.2 软件用于绘制苜蓿GPAT基因的染色体定位图,利用AI 工具对其进行美化。
1.4 基因结构和保守基序分析
使用GSDS (http://gsds.cbi.pku.edu.cn/)在线预测GPAT基因结构;使用MEME (http://memesuite.org/tools/meme)工具预测该基因的保守基序位置。最后用TBtools v1.0983 软件进行可视化。
1.5 mtGPAT 家族基因的表达分析
在基因芯片表达数据库(https://www.ebi.ac.uk/arrayexpress/)中分别下载蒺藜苜蓿的不同组织表达数据(E-MEXP-1097)和200 mmol·L−1盐胁迫下的基因表达数据(E-GEOD-13907)。在蒺藜苜蓿基因表达图谱服务器(http://mtgea.noble.org/v2/) 中找出mtGPAT各基因的探针编号,根据各基因的探针编号找出对应的表达量,取log2 值在TBtools v1.0983 软件上作图。
2 结果与分析
2.1 蒺藜苜蓿GPAT 基因的鉴定、注释和染色体定位
通过hmm search 查找GPAT 结构域隐马尔可夫模型、拟南芥GPAT 蛋白同源比对以及Pfam 检查保守结构域的方式,从蒺藜苜蓿基因组(https://genome.jgi.doe.gov/)中鉴定出24 个GPAT 家族蛋白,按其在染色体上的位置依次命名(mtGPAT1-mtGPAT24)(表1)。使用ExPASy 工具对这24 个蛋白的分子量、等电点等性质进行分析统计。结果表明:GPAT基因编码的蛋白质氨基酸长度在282 (AET03510)~568(AES60108) aa。除了KEH33585 和AES95759 蛋白的等电点较低(7.17 和7.14)之外,其余22 个蛋白的等电点均集中在8.16~10.35,因此,mtGPAT基因大都属于碱性氨基酸。mtGPAT 蛋白的亚细胞定位结果表明,它们大部分均定位在内质网、线粒体和叶绿体中,AES67682和KEH19006两个基因在细胞膜上也有分布,表明这两个基因很可能具有其他的生物学功能。

表1 蒺藜苜蓿mtGPAT 基因家族的鉴定及特性研究Table 1 Identification and characteristics of the mtGPAT gene family in Medicago truncatula
2.2 蒺藜苜蓿GPAT 基因家族的系统进化
为分析24 个蒺藜苜蓿mtGPAT基因的进化关系,以及这些基因与10 个功能已被深入阐明的拟南芥AtGPAT基因间的同源关系,利用MEGA 7 软件选用邻域连接(NJ)法构建系统发育树(图1)。结果表明:24 个蒺藜苜蓿mtGPAT基因可以分成3 个(Group 1、Group 2、Group 3)亚家族,分别含有10、4、10 个GPAT基因家族成员。这与其他植物上的分类相同,拟南芥中也将10 个GPAT基因分成3 个亚家族(AtGPAT1-AtGPAT8、AtGPAT9和AtS1) , 其中AtS1是质体型GPAT,AtS1缺失会伴随着植物生长延迟和种子发育中止,蒺藜苜蓿GPAT 蛋白成员有10 个属于这一亚家族。AtGPAT9 可能是一种功能酶,在植物膜和贮藏脂质生物合成中起着重要作用,这一亚族有4个mtGPAT基因。AtGPAT1-AtGPAT8均可能具有sn-2 酰基转移活性,可以为角质和软木脂聚酯合成提供单体构件,由于角质层和软木脂与植物抗逆性直接相关,因此有10 个mtGPAT会直接参与蒺藜苜蓿的抗逆过程。

图1 蒺藜苜蓿GPAT 基因家族系统进化分析Figure 1 Phylogenetic analysis of the GPAT gene family in Medicago truncatula
2.3 蒺藜苜蓿GPAT 基因家族染色体定位
mtGPAT基因的分布由其染色体位置决定,24 个mtGPAT基因被定位到蒺藜苜蓿的7 条染色体上,且这24 个基因均不存在成簇现象(图2)。除chr1、chr5 和chr7 号染色体上分布有4~5 个基因外,其余所有染色体上均分布有2 或3 个mtGPAT基因,表明它们总体上较为一致,分布较为松散。

图2 蒺藜苜蓿mtGPAT 基因的染色体分布Figure 2 Chromosomal distribution of mtGPAT genes in Medicago truncatula
2.4 蒺藜苜蓿GPAT 基因家族成员保守基序和基因结构分析
为进一步了解mtGPAT 蛋白的分类与结构之间的关系,本研究预测了mtGPAT 蛋白的保守基序和基因结构。结果(图3) 表明:24 个mtGPAT 成员大致分成了3 簇 (Ⅰ、Ⅱ、Ⅲ),同一亚家族似乎具有相似的基序,保守基序Motif 4、Motif 8 和Motif 17编码PlsC acyltransferase 结构域。Ⅰ簇共有的PlsC acyltransferase 结构域保守基序为Motif 4,基因结构相对简单,仅有1~3 个外显子;Ⅱ簇中有2 个基因的PlsC acyltransferase 结构域保守 基 序 是Motif 4,有3 个基因的保守基序是Motif 17;Ⅲ簇中mtGPAT24没有与其他23 个基因相同的基序,可能与其序列太短有关。mtGPAT21基因PlsC acyltransferase 结构域的保守基序为Motif 17,其余6 个基因的保守基序均是Motif 4;Ⅱ、Ⅲ簇基因结构相对复杂,外显子数量较多,表明其亲缘关系较近。

图3 蒺藜苜蓿mtGPAT 进化、基因结构和保守基序分析Figure 3 Phylogenetic, gene structure, and conserved motif analyses of mtGPAT genes in Medicago truncatula
在蒺藜苜蓿基因表达图谱服务器(http://mtgea.noble.org/v2/)中找mtGPAT家族成员的探针时发现除 了KEH33585、AES96960 和AES97896 这3 个 基因的探针编号找不到之外,其余21 个基因均可找到各自的探针编号。根据探针编号将21 个基因在不同组织部位和盐胁迫下的表达数据(相对表达量)取log2 值后作组织表达图(图4)。不同组织部位的表达结果显示,找出探针的21 个基因大致分成了3 簇,第1 簇各基因在各个组织中的表达量相比于其他两个簇均较高。第2 簇中mtGPAT8、mtGPAT18和mtGPAT10在花中表达量相对较高;第3 簇mtGPAT11在根、茎、叶、根瘤和叶芽中表达量较低,mtGPAT7、mtGPAT24和mtGPAT23在叶中表达量均较低。同时21 个基因在芽中均几乎不表达。
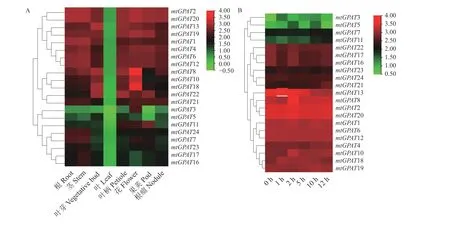
图4 21 个mtGPAT 基因在蒺藜苜蓿中的表达模式Figure 4 Expression patterns of the 21 mtGPAT genes in Medicago truncatula
2.5 蒺藜苜蓿GPAT 基因家族在不同组织和盐胁迫下的表达分析
根 据 蒺 藜 苜 蓿 幼 苗 在200 mmol·L−1NaCl 胁 迫下的表达图(图4),可以看出,21 个基因也分成了3 簇。第1 簇4 个成员表达量均较低,但对盐胁迫响应比较明显,mtGPAT3在胁迫1 h 后表达量明显上调,随着处理时间的延长表达量有所下降,但也明显比对照组高;mtGPAT5分别在胁迫处理2 和10 h时表达量显著升高(P< 0.05);mtGPAT11在胁迫12 h后表达量显著上调(P< 0.05)。其他两个簇基因表达量均较高,但只有极个别基因的表达量在胁迫前后有较微弱的变化,大多数基因的表达量在胁迫前后均无明显变化。
3 讨论与结论
甘油脂类在植物生物学中起着至关重要的作用,因为它们是细胞膜的主要成分、种子发育过程中的贮藏脂质以及植物器官表皮表面的保护性疏水屏障[12]。此外,甘油脂质还与植物的生长、发育以及对生物和非生物胁迫的抗性有关[16]。为进一步了解GPAT 在甘油脂质生物合成和不同生理过程中的作用,了解GPAT 的进化历史和多样性是非常必要的。系统发育分析表明,24 个mtGPAT基因可分为3 个亚家族(Group 1、Group 2、Group 3),这与拟南芥10 个GPAT基因(AtGPAT1-8、AtGPAT9和AtS1)的分类相似。目前对拟南芥中大多数GPAT基因的功能进行了详细的鉴定和表征,拟南芥质体型Ats1 是一种可溶性和质体定位的GPAT 酶,通过利用酰基ACP 底物催化拟南芥叶绿体中磷脂酰甘油生物合成的第一反应,并且表现出sn-1 酰基转移区域特异性[12]。拟南芥质体可溶性GPAT 的酰基底物偏好(即饱和和不饱和酰基ACPs)可能通过介 导 磷 脂 酰 甘 油(phosphatidyl-glycerol PG)sn-1 位 置的脂肪酸组成部分地控制植物的耐寒性,因此影响植物气生组织膜流动性[17],但其在苜蓿中的作用还有待研究,后续可以基于本研究中鉴定分类的10 个Ⅲ型质体型mtGPAT基因开展试验。拟南芥GPAT9在植物膜和贮藏脂肪生物合成中起着重要作用,GPAT9还具有sn-1 酰基转移酶活性,对酰基化合物具有高度特异性,从而证实了其在种子三酰甘油(TAG)生物合成中的作用,并提供了全面的证据支持其在叶片极性和非极性脂质以及花粉中脂滴产生中的作用[5],本研究中4 个II 型mtGPAT基因归类为GPAT9,与其可能存在相似的功能。拟南芥8 种GPAT(GPAT1-8) 不需要用于膜或贮藏脂肪的生物合成,但可能影响拟南芥[1]、甘蓝型油菜[2]和水稻[10]角质或软木脂的组成和数量。而软木脂和角质是由某些植物细胞沉积的细胞外脂质屏障。它们对于控制气体、水和离子通量至关重要,是保护植物免受病原体入侵的物理屏障[12]。GPAT1-8中GPAT4和GPAT8被证明是叶片角质形成所必需的[18],GPAT6是花角质合成所必需的[19],GPAT5已被证明参与了根和种子中软木脂的合成[6]。本研究I 型mtGPAT22与GPAT4和GPAT8聚在一起表明其与叶片角质形成有关,mtGPAT10、mtGPAT18跟GPAT6聚在一起,说明它们会参与花角质的形成过程。根据系统进化表明与GPAT5相近的mtGPAT3、mtGPAT16有可能在苜蓿根和种子软木脂合成中发挥重要作用。
盐胁迫是一种主要限制世界各地作物产量的非生物胁迫,植物GPAT基因参与盐胁迫过程[20],同时GPAT基因在植物中的过度表达可增强其耐盐性或耐寒性。先前在棉花(Gossypiumspp.)中的研究表明:在中度盐胁迫下,大多数GhGPAT基因在根中表达上调,而在叶片中只发现少量的GPAT基因表达上调,这一结果证实了根系是直接响应盐胁迫的第一组织[21]。在拟南芥AtGPAT6、AtGPAT7和AtGPAT93 个GPAT基 因 的 研 究 中,AtGPAT6和AtGPAT7可以主动调节植物对盐胁迫的反应[22]。本研究中,在200 mmol·L−1NaCl 胁迫蒺藜苜蓿幼苗的情况下,大多数mtGPAT基因的表达量均较高,并且不会随着胁迫时间的变化有明显的上调或下调,只有mtGPAT3、mtGPAT5、mtGPAT113 个基因在胁迫时间变长后表达量有较微弱的上调。与拟南芥AtGPAT6和AtGPAT7聚到一起的4 个蒺藜苜蓿基因mtGPAT10、mtGPAT18、mtGPAT3和mtGPAT16会随着盐胁迫时间的不同表达量有所不同,对盐胁迫响应明显。
综上所述,本研究提供了蒺藜苜蓿GPAT基因比较全面的基因组分析,包括系统发育、基因结构、蛋白质特性、基因表达和耐盐性分析。这些结果有助于人们更好地了解GPAT基因的进化史,并对蒺藜苜蓿GPAT基因的功能有更深入的了解。系统发育分析表明,蒺藜苜蓿GPAT基因可分为3 个不同的亚家族(Group 1、Group 2、Group 3),进一步证实了它们在基因结构、蛋白质性质、基序出现和基因表达模式等方面的保守性和变异性。蒺藜苜蓿作为豆科模式植物代表,同时也是紫花苜蓿等物种的近缘物种,本研究结果可为后续研究紫花苜蓿GPAT基因的功能提供基础资料,以便更深入阐述紫花苜蓿的抗盐碱机制。
