鱼腥草素钠调控T细胞平衡对OVA诱导急性哮喘小鼠模型的影响
2021-11-21胡智立雷期音贺守第陈叶
胡智立 雷期音 贺守第 陈叶


〔摘要〕 目的 探讨鱼腥草素钠(sodium houttuyfonate, SH)通過Th1/Th2平衡对卵白蛋白(ovum albumin, OVA)诱导急性哮喘小鼠模型的影响。方法 实验用雌性BALB/c小鼠32只随机分为正常组、模型组、低浓度SH组、高浓度SH组,每组8只,建立OVA诱导急性小鼠哮喘模型后,低浓度SH组、高浓度SH组分别每天腹腔注射10、25 mg/kg SH,正常组、模型组注射等体积的生理盐水,共14 d。ELISA检测小鼠血清免疫球蛋白G(IgG)、免疫球蛋白G1(IgG1)、免疫球蛋白G2a(IgG2a)和脾脏单个核细胞培养上清液白细胞介素-10(IL-10)、干扰素-γ (IFN-γ)浓度;流式细胞术检测小鼠脾脏单个核细胞中Th1、Th2比例;qPCR法检测小鼠脾脏单个核细胞GATA结合蛋白3(GATA3)、转录激活因子6(STAT6)、T盒子转录因子(T-bet)mRNA表达水平。结果 与正常组比较,模型组血清IgG1浓度,脾脏单个核细胞Th2比例、GATA3、STAT6、T-bet的mRNA表达及上清液IL-10浓度上升,IgG2a浓度水平下降,差异具有统计学意义(P<0.01);与模型组比较,SH能降低血清IgG1浓度,脾脏单个核细胞Th2比例、GATA3的mRNA表达及上清液IL-10浓度,提高血清IgG2a浓度、脾脏单个核细胞Th1比例、T-bet的mRNA表达及上清液IFN-γ浓度,呈浓度依赖性,差异具有统计学意义(P<0.05或P<0.01)。结论 鱼腥草素钠通过调节Th1/Th2平衡抑制OVA诱导急性小鼠哮喘的炎症,可能与调控GATA3、STAT6、T-bet等转录因子相关。
〔关键词〕 急性哮喘;鱼腥草素钠;T细胞;卵白蛋白;炎症;Th1;Th2
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.10.009
Effect of Sodium Houttuyfonate Regulating T Cell Balance in OVA-induced
Acute Asthma Mouse Model
HU Zhili1, LEI Qiyin2, HE Shoudi3, CHEN Ye1*
(1. Department of Pediatrics, Union Shenzhen Hospital, Huazhong University of Science and Technology Union Shenzhen Hospital, Shenzhen, Guangdong 518000, China; 2. Department of Stomatology, Shenzhen Hospital, Southern Medical University, Shenzhen, Guangdong 518000, China; 3. Department of Traditional Chinese Medicine Rheumatology, Huazhong University of Science and Technology Union Shenzhen Hospital, Shenzhen, Guangdong 518000, China)
〔Abstract〕 Objective To investigate the effect of sodium houttuyfonate (SH) on Th1/Th2 balance in ovum albumin (OVA)-induced acute asthma in mice. Methods The experiment mice were randomly assigned into normal group, model group, low-concentration SH group, and high-concentration SH group, with 8 mice in each group. After the OVA-induced acute mouse asthma model was established, the low-concentration SH group and high-concentration SH group were injected intraperitoneally with 10, 25 mg/kg SH every day, the normal group and model group were given an equal volume of normal saline, also for 14 days. ELISA was used to detect the IgG, IgG1, IgG2a concentrations in the mouse serum and IL-10, IFN-γ concentrations in cell culture supernatant liquid of spleen mononuclear. Flow cytometry was used to detect the Th1 and Th2 ratio of mouse spleen mononuclear cells. Real-time fluorescence quantitative PCR was used to detect the mRNA expression of GATA3, STAT6, T-bet in mouse spleen mononuclear cells. Results Compared with the normal group, the model group's IgG1 concentration in the serum, the Th2 ratio, mRNA expression of GATA3, STAT6, T-bet and concentration of supernatant IL-10 in spleen mononuclear cell increased, and the IgG2a concentration in the serum decreased, with statistical differences (P<0.01); compared with the model group, SH can reduce IgG1 concentration in the serum, the Th2 ratio, mRNA expression of GATA3 and concentration of supernatant IL-10 in spleen mononuclear cell, increase IgG2a concentration in the serum, the Th1 ratio, mRNA expression of T-bet and concentration of supernatant IFN-γin spleen mononuclear cell, there was a concentration-dependent and the differences were statistically significant (P<0.05 or P<0.01). Conclusion SH can inhibit OVA-induced acute asthma inflammation in mice by regulating the Th1/Th2 balance, which may be related to the regulation of transcription factors such as GATA3, STAT6, and T-bet.
〔Keywords〕 acute asthma; sodium houttuyfonate; T cells; ovalbumin; inflammation; Th1; Th2
哮喘是一种严重的呼吸系统慢性炎症性疾病,是最常见气道疾病之一,成为全球范围内严重威胁公众健康的慢性疾病[1]。近年来,随着环境的改变,小儿支气管哮喘发病率呈逐年上升趋势,而且目前小儿支气管哮喘疾病严重影响到小儿的生活质量,给患者、家属和医疗保健系统带来沉重的社会和经济负担[2]。目前,治疗哮喘的药物主要是激素。哮喘属于中医学“喘证”“哮证”的范畴,主要病机为宿痰内伏于肺,复感外邪、饮食、情志、劳倦等[3]。
鱼腥草是传统的中草药,性味幸、微寒,具有清热解毒的功效,常治疗实热、湿邪等实证肺痈[4]。鱼腥草素钠(sodium houttuyfonate, SH)是鱼腥草素与亚硫酸氢钠盐合成。鱼腥草素钠具有杀菌消炎、抗病毒、调节免疫作用[5]。关于SH对免疫细胞的影响的研究尚未报道,本課题组前期研究[6]发现,SH能抑制哮喘模型小鼠白细胞介素-4(IL-4)、单核细胞趋化因子-1(MCP-1)等因子的分泌。因此,本研究拟检测急性哮喘模型小鼠的免疫球蛋白G(IgG)、免疫球蛋白G1(IgG1)、免疫球蛋白G2(IgG2)水平,白细胞介素-10(IL-10)、干扰素-γ(IFN-γ)浓度以及GATA结合蛋白3(GATA3)、转录激活因子6(STAT6)、T盒子转录因子(T-bet)mRNA表达水平,旨在探索SH是否通过调节Th1/Th2平衡抑制急性哮喘模型的炎症。
1 材料与方法
1.1 动物
实验用雌性BALB/c小鼠32只购自广东省医学实验动物中心,SPF级,体质量(21±2) g。本研究所有动物均在深圳大学医学院SPF动物房进行。实验动物饲养及实验处理都经深圳大学实验动物福利与伦理委员会审批(伦理号:LW-2020-012)。
1.2 药物与主要试剂
SH(批号:1306-5,上海青平药业有限公司,纯度≥97%);HRP-goat anti mouse IgG、IgG1、IgG2a抗体(批号分别为6030-05、6010-48、6015-23,美国Southern公司);Anti-mouse CD4 APC、Anti-mouse IFN-γ FITC、Anti-mouse IL-4 PE(批号分别为12-0040-68、15-0290-63、23-0057-61,美国Ebioscience公司);小鼠白介素10(IL-10)、γ-干扰素(IFN-γ)ELISA试剂盒(批号分别为BMS7267、BMS5424,北京四正柏公司)。
1.3 主要仪器
ABI7500型实时荧光定量PCR仪器(美国ABI公司);51119770型全波长酶标仪Multiskar(美国Thermo公司);FACSCanto II型流式细胞仪(美国BD biosciences公司)。
1.4 动物分组、模型制备及干预方法
将BALB/c小鼠随机分为正常组、模型组、低浓度SH组、高浓度SH组,每组8只。除空白组外,其余小鼠按照课题组前期方案造模[3],第0、3、7天,小鼠背部多点注射100 μg/只的OVA与佐剂氢氧化铝的乳化剂,第14天起,予50 μg/只OVA滴鼻激发,建立哮喘模型;药物干预于造模的第7天起,低浓度SH组、高浓度SH组腹腔分别注射10、25 mg/kg SH(溶于生理盐水),1 d/次,共14 d。模型组及正常组腹腔注射等体积的生理盐水,第21天乙醚麻醉处死动物。
1.5 检测指标
1.5.1 ELISA法检测小鼠血清OVA-IgG、IgG1、IgG2浓度 小鼠眼球取血,离心,收集血清。准备96孔板,包被20 μg/mL OVA于96孔板中,4 ℃过夜,3% BSA/PBS室温封闭2 h;将小鼠血清1∶20稀释后,加入96孔板中,37 ℃孵育2 h,洗涤3次,加入HRP-goat anti mouse IgG、IgG1、IgG2a,37 ℃孵育2 h,PBST溶液洗涤3次后,加入TMB显色液,加入2 mol/L硫酸终止液。采用酶标仪检测吸光度值。
1.5.2 流式细胞术检测小鼠Th1、Th2的比例 流式细胞术检测CD4+ T淋巴细胞内IFN-γ和IL-4含量,分别反映Th1、Th2细胞的数量。无菌条件下,从小鼠背面分离出脾脏,加入1 640完全培养基,碾磨后,加入淋巴细胞分离液,放入离心机,常温,3 000 r/min,离心半径11 cm,离心30 min,吸取中层浑浊细胞层,洗涤1次,重悬细胞,细胞计数后,以1×108个/mL加入12孔板;加入细胞刺激剂,培养箱孵育16 h后,取100 μL细胞悬液加入流式管;加入Anti-mouse CD4 APC,4 ℃孵育30 min;1 400 r/min,离心半径11 cm,离心5 min,加入IC固定液,室温孵育20 min,洗涤后;加入固定/破膜工作液,避光4 ℃孵育20 min,加入Permeabilization Buffer,室温孵育15 min,加入anti-mouse-IL-4-PE、anti-mouse-IFN-γ-FITC,4 ℃避光孵育30 min,洗涤,1 400 r/min,离心半径11cm,离心5min,加入缓冲液重悬细胞,上机检测,应用流式软件flowjo 6.0分析。
1.5.3 ELISA检测小鼠脾脏单个核细胞IL-10、IFN-γ浓度 取上述分离好的单个核细胞,以1×106个/孔加入24孔板中,加入20 μg/孔OVA,细胞培养箱培养72 h,收集细胞上清液,1 000 r/min,离心半径11 cm,离心5 min,采用ELISA法检测各组细胞上清液IL-4、IFN-γ的水平,具体操作根据ELISA试剂盒说明书进行,绘制标准曲线,计算IL-4、IFN-γ浓度。
1.5.4 qPCR检测小鼠OVA刺激脾脏单个核细胞GATA3、STAT6、T-bet的mRNA表达 根据primer设计小鼠GATA3、STAT6、T-bet的引物(GATA3:正向引物5-AAGCTCAGTATCCGCTGACG-3,反向引物5-GTTTCCGTAGTAGGACGGGAC-3;STAT6:正向引物5-CTCTGTGGGGCCTAATTTCCA-3,反向引物5-GCATCTGAACCGACCAGGAAC-3;T-bet:正向引物5-GTGACCCAGATGATTGTGCTC-3,反向引物5-GTAGGCAGTCACGGCAATG-3;β-actin:正向引物5-TGTCCACCTTCCAGCAGATGT-3,反向引物5-AGCTCAGTAACAGTCCGCCTAG-3),取上述分离好的单个核细胞,采用RNA提取试剂盒提取各组RNA,采用cDNA转录试剂盒说明书进行cDNA转录,使用qPCR试剂盒检测各组GATA3、STAT6、T-bet的mRNA表達,采用算法进行统计。
1.6 统计学方法
采用SPSS 19.0软件分析数据,计量资料使用“x±s”表示,若资料满足正态分布及方差齐性,采用t检验,反之则采用非参数检验。以P<0.05为差异有统计学意义。
2 结果
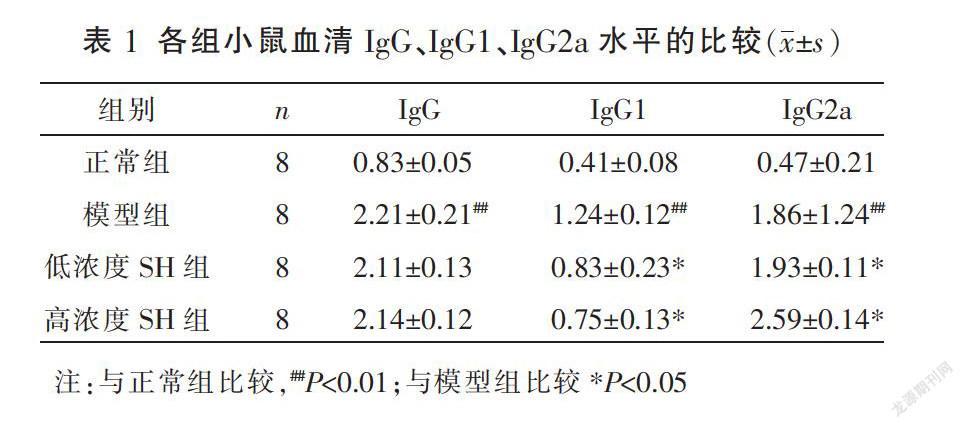
2.1 各组小鼠血清IgG、IgG1、IgG2a水平比较
与正常组相比,模型组血清IgG、IgG1、IgG2a水平升高(P<0.01);与模型组比较,低浓度SH组和高浓度SH组IgG1水平降低(P<0.05),IgG2a水平上升(P<0.05)。见表1。
2.2 各组小鼠脾脏单个核细胞Th1(IFN-γ)、Th2(IL-4)比例比较
与正常组相比,模型组脾脏单个核细胞Th2(IL-4)比例升高(P<0.01);与模型组比较,低浓度SH组和高浓度SH组Th1(IFN-γ)比例、Th1(IFN-γ)/Th2(IL-4)上升(P<0.01),Th2(IL-4)比例下降(P<0.01)。见图1和表2。
2.3 各组小鼠脾脏细胞上清液IL-10、IFN-γ浓度比较
与正常组相比,模型组脾脏单个核细胞上清液IL-10显著增加(P<0.01),IFN-γ无显著变化(P>0.05);与模型组比较,低浓度SH组和高浓度SH组IFN-γ水平上升(P<0.01),IL-10水平下降(P<0.01)。见图2。
2.4 各组小鼠脾脏单个核细胞GATA3、STAT6、T-bet的mRNA表达水平比较
与正常组相比,模型组脾脏单个核细胞GATA3、STAT6、T-bet的mRNA表达上升(P<0.01)。与模型组比较,低浓度SH组脾脏单个核细胞GATA3 mRNA表达下降(P<0.05),STAT6 mRNA表达水平无明显变化(P>0.05),T-bet的mRNA表达上升(P<0.01);高浓度SH组脾脏单个核细胞GATA3 mRNA、STAT6 mRNA表达下降(P<0.01),T-bet mRNA表达上升(P<0.01)。见图3。
3 讨论
鱼腥草为中国的传统中药,具有清热解毒、消痈排脓的作用。研究[7-8]发现,鱼腥草制剂和提取物及单体具有抗炎作用,能减少或抑制TNF-α、IL-4、IL-10等炎症因子,而鱼腥草水蒸气提取物能通过上调IFN-γ的表达减轻肺纤维化,可能与抑制促进STAT1通路有关[9],说明鱼腥草的成分具有调节炎症因子分泌的功能。而我们前期研究发现,SH能抑制哮喘IL-4、MCP-1的分泌[6],本研究进一步发现其能抑制IL-10的分泌,促进IFN-γ分泌上调,因此,推测鱼腥草调节炎症因子的主要成分可能是鱼腥草素。
人体免疫T细胞分为CD4+ T细胞、CD8+ T细胞,CD4+ T细胞中Th1、Th2细胞的失衡与哮喘的免疫反应具有相关性[10],Th1细胞分泌IFN-γ、TNF-α,是抵抗细菌、病毒的主要因子,同时参与自身免疫紊乱疾病,Th1细胞诱导B细胞产生IgG2a抗体[11-12];Th2细胞通过分泌IL-4、IL-10参与变态免疫反应疾病及抵抗寄生虫感染,诱导B细胞产生IgG1抗体[13]。哮喘的重要免疫异常机制是Th1/Th2失衡,当Th2功能亢进时,促进IgE、IL-4、IL-10合成,加重哮喘的病情。GATA3、STAT6、T-bet等基因在T细胞的分化中起关键作用[14-16]。本研究发现低、高浓度SH能抑制IgG1和IL-10的水平,上调IgG2a、IFN-γ的水平,说明SH抑制哮喘模型炎症模型可能与调节Th1/Th2的平衡有关,我们通过流式细胞术进一步验证发现SH能抑制Th2细胞比例,上调Th1细胞的比例,且Th1/Th2向Th1转化。关于调控Th1/Th2转化的转录因子研究中,文献报道GATA3、STAT6是参与Th2分化诱导的主要转录因子,可促进Th2细胞增殖和产生IL-4、IL-13等Th2细胞因子,使Th1/Th2比例失衡[17-18]。T-bet是T-box基因家族的新型转录因子,选择性地表达于Th1细胞,能诱导干扰素γ的产生,在Th1细胞的分化中起决定性的作用[19],我们研究发现SH能调节T细胞中Th1,Th2的比例,我们进一步检测与Th1、Th2相关的转录因子T-bet、GATA3、STAT6,发现SH能抑制转录因子GATA3、STAT6的表达,促进T-bet表达上调,我们猜测SH可能通过调控GATA3、STAT6、T-bet调控T细胞分化。
鱼腥草素来源于鱼腥草,常用于治疗中医“热哮”的肺热壅盛的证候。“热哮”主要表现为喉中哮鸣,面赤口苦,舌质红,苔黄腻,治疗以清热宣肺、化痰定喘为法,“热哮”在西医属于急性发作期哮喘。OVA诱导小鼠急性哮喘模型用作为中医发作性“哮证”模型[15],本实验使用OVA诱导急性哮喘小鼠模型,间接模拟热哮的证型,通过SH抑制OVA诱导急性哮喘小鼠模型的炎症的实验研究,进一步为鱼腥草治疗“热哮”提供理论依据。
綜上所述,SH通过调节调控T淋巴细胞Th1/Th2平衡抑制急性哮喘的炎症,可能与调控GATA3、STAT6、T-bet等转录因子相关。
参考文献
[1] BATEMAN E D, HURD S S, BARNES P J, et al. Global strategy for asthma management and prevention: GINA executive summary[J]. The European Respiratory Journal, 2008, 31(1): 143-178.
[2] SETH D, SAINI S, POOWUTTIKUL P. Pediatric Inner-City Asthma[J]. Immunology And Allergy Clinics of North America, 2021, 41: 599-611.
[3] 夏逸飞,孙子凯.哮喘-慢阻肺重叠的中医辨治思路[J].湖南中医药大学学报,2019,39(5):619-622.
[4] 黄南龙,黄焕明,张碧玉,等.中药鱼腥草的药理作用、临床应用及不良反应概述[J].福建中医药,2021,52(3):58-60.
[5] 王 宁,庞 剑.鱼腥草药理作用及对细菌耐药性的研究进程[J]. 中医临床研究,2017,9(17):146-148.
[6] 陈 叶,黄丽娟,胡智立,等.鱼腥草素钠对急性哮喘模型小鼠炎症的影响及机制研究[J].药物评价研究,2019,42(6):1105-1109.
[7] ZIMMERMANN N, ROTHENBERG M E. Receptor internalization is required for eotaxin-induced responses in human eosinophils[J]. Journal of Allergy and Clinical Immunology, 2003, 111(1): 97-105.
[8] DU S, LI H, CUI Y, et al. Houttuynia cordata inhibits lipopolysaccharide-induced rapid pulmonary fibrosis by up-regulating IFN-γ and inhibiting the TGF-β1/Smad pathway[J]. International Immunopharmacology, 2012, 13: 331-340.
[9] KIM J, PARK C S, LIM Y, et al. Paeonia japonica, Houttuynia cordata, and Aster scaber water extracts induce nitric oxide and cytokine production by lipopolysaccharide-activated macrophages[J]. Journal of Medicinal Food, 2009, 12(2): 365-373.
[10] SGRAZZUTTI L, SANSONE F, ATTANASI M, et al. Coaggregation of Asthma and Type 1 Diabetes in Children: A Narrative Review[J]. International Journal of Molecular Sciences, 2021, 22: undefined. doi:10.3390/ijms22115757.
[11] NAZERI S, ZAKERI S, MEHRIZI A A, et al. Measuring of IgG2c isotype instead of IgG2a in immunized C57BL/6 mice with Plasmodium vivax TRAP as a subunit vaccine candidate in order to correct interpretation of Th1 versus Th2 immune response[J]. Experimental Parasitology, 2020, 216: 107944.
[12] PONCETTE L, BLUHM J, BLANKENSTEIN T. The role of CD4 T cells in rejection of solid tumors[J]. Current Opinion in Immunology, 2021, 74: 18-24.
[13] BRUNI F M, COUTINHO E M M, ANDRADE-BARROS A I, et al. Anaphylaxis induced by Thalassophryne nattereri venom in mice is an IgE/IgG1-mediated, IL-4-dependent phenomenon[J]. Scientific Reports, 2020, 10: 584.
[14] CALLENDER L A, SCHROTH J, CARROLL E C, et al. GATA3 induces mitochondrial biogenesis in primary human CD4+ T cells during DNA damage[J]. Nature Communications, 2021, 12: 3379.
[15] AEHNLICH P, CARNAZ SIMES A M, SKADBORG S K, et al. Expansion with IL-15 increases cytotoxicity of Vγ9Vδ2 T cells and is associated with higher levels of cytotoxic molecules and T-bet[J]. Frontiers in Immunology, 2020, 11: 1868.
[16] SYMOWSKI C, VOEHRINGER D. Th2 cell-derived IL-4/IL-13 promote ILC2 accumulation in the lung by ILC2-intrinsic STAT6 signaling in mice[J]. European Journal of Immunology, 2019, 49(9): 1421-1432.
[17] OUYANG W J, RANGANATH S H, WEINDEL K, et al. Inhibition of Th1 development mediated by GATA-3 through an IL-4-independent mechanism[J]. Immunity, 1998, 9(5): 745-755.
[18] PANG L,YU P F, LIU X P, et al. Fine particulate matter induces airway inflammation by disturbing the balance between Th1/Th2 and regulation of GATA3 and Runx3 expression in BALB/c mice[J]. Molecular Medicine Reports, 2021, 23: undefined.doi:10.3892/mmr.2021.12017.
[19] ROBINSON D S. The role of the T cell in asthma[J]. Journal of Allergy and Clinical Immunology, 2010, 126(6): 1081-1091.
[20] 劉 敏,张才圣,柏正平.麻葶舒喘汤对哮喘小鼠气道黏液高分泌的影响及机制研究[J].湖南中医药大学学报,2020,40(12):1449-1455.
