艾灸对慢性萎缩性胃炎大鼠局部穴区组织代谢的影响
2021-11-21刘倩尹鸿智金佳燕钟欢石佳常小荣刘密
刘倩 尹鸿智 金佳燕 钟欢 石佳 常小荣 刘密

〔摘要〕 目的 采用核磁共振氫谱技术(1H nuclear magnetic resonance, 1H-NMR)观察艾灸对慢性萎缩性胃炎(chronic atrophic gastritis, CAG)大鼠局部穴区组织代谢的影响,从代谢的角度探究艾灸治疗CAG可能的作用靶点和相关代谢路径。方法 运用随机数字表法将42只SD大鼠分为3组(正常组、模型组和治疗组),每组14只。通过N甲基-N'-硝基-N亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine, MNNG)联合法制备CAG模型,造模成功后,正常组和模型组做抓取、捆绑处理,治疗组予以艾灸足三里、中脘干预。治疗14 d后,运用HE染色法观察胃组织病理学变化,运用1H-NMR技术检测足三里局部穴区组织代谢物,以Chenomx NMR Suite软件分析所得数据。结果 HE染色下,模型组大鼠胃组织光镜下可见固有腺体萎缩、结构紊乱且数量减少,符合CAG病理诊断标准;治疗组大鼠胃组织有一定程度的改善。代谢物分析,与正常组相比,模型组中谷氨酰胺、琥珀酸、赖氨酸、富马酸、次黄嘌呤、一磷酸腺苷显著降低;而磷酸胆碱/甘磷酸胆碱、天冬酰胺、天冬氨酸、N-乙酰天门冬氨酸、酪氨酸、苯丙氨酸、黄嘌呤、肌苷则升高。与模型组比较,治疗组腺苷、天冬酰胺、N-乙酰天门冬氨酸、谷氨酰胺、磷酸胆碱、甘磷酸胆碱、肌苷、黄嘌呤等代谢物水平发生逆转。结论 从代谢角度说明,艾灸干预可调节CAG大鼠局部穴区组织代谢紊乱的神经递质和能量代谢,可能通过丙氨酸、天冬氨酸、谷氨酸代谢,嘌呤代谢和D-谷氨酰胺、D-谷氨酸代谢实现。
〔关键词〕 慢性萎缩性胃炎;艾灸;核磁共振氢谱;代谢通路;神经递质;能量代谢
〔中图分类号〕R245.8 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2021.10.005
Effect of Moxibustion on Metabolism of Local Acupoint Tissue of Rats with
Chronic Atrophic Gastritis
LIU Qian, YIN Hongzhi, JIN Jiayan, ZHONG Huan*, SHI Jia, CHANG Xiaorong, LIU Mi*
(Hunan University of Chinese Medicine, Changsha, Hunan 410208, China)
〔Abstract〕 Objective 1H nuclear magnetic resonance (1H-NMR) technology was used to observe the effect of moxibustion on the metabolism of local acupoint tissue in rats with chronic atrophic gastritis (CAG), and to explore the possible targets and related metabolic pathways in the treatment of CAG by moxibustion from the perspective of metabolism. Methods According to the random number table method, 42 SD rats were divided into 3 groups (normal group, model group and treatment group), with 14 rats in each group. The CAG model was prepared by the combined method of N-methyl-N-nitro-N-nitroso guanidine (MNNG). After successful modeling, the normal group and model group were grasped and bound, and the treatment group was treated with moxibustion “Zusanli” (ST36) and “Zhongwan” (RN12) intervention. After 14 days of treatment, HE staining was used to observe the pathological changes of gastric tissue, 1H-NMR technology was used to detect the metabolites of local acupoint tissue in “Zusanli” (ST36), and the data obtained were analyzed by Chenomx NMR Suite software. Results Under HE staining, the gastric tissue of the model group showed proper gland atrophy and structural disorder, and the number of proper glands was reduced under light microscope, which met the CAG pathological diagnostic criteria. The gastric tissue of the treatment group had a certain degree of improvement. In metabolite analysis, compared with the normal group, glutamine, succinic acid, lysine, fumaric acid, hypoxanthine, and adenosine monophosphate in the model group were significantly reduced; while phosphorylcholine/choline alfoscerate, asparagine, aspartic acid, N-acetyl aspartic acid, tyrosine, phenylalanine, xanthine, and inosine were elevated. Compared with the model group, the levels of metabolites such as adenosine, asparagine, N-acetylaspartic acid, glutamine, phosphocholine, choline alfoscerate, inosine, and xanthine were reversed in the treatment group. Conclusion From the perspective of metabolism, moxibustion intervention can regulate the neurotransmitter and energy metabolism of local acupoint tissue metabolism disorders in CAG rats. It may be realized through the metabolism of alanine, aspartic acid, glutamate, purine metabolism and D-glutamine and D-glutamic acid metabolism.
〔Keywords〕 chronic atrophic gastritis; moxibustion; 1H nuclear magnetic resonance; metabolic pathway; neurotransmitter; energy metabolism
慢性萎缩性胃炎(chronic atrophic gastritis, CAG)是临床常见的消化系统疾病,其病理改变主要是胃黏膜病变,常表现为胃黏膜萎缩、胃上皮异型增生、肠上皮化生等[1-2],被认为是胃癌的癌前病变阶段,严重危害人类健康[3-4],现如今西医对CAG的治疗尚未成熟,还有发展的空间。针灸防治CAG历史悠久,疗效显著[5-7]。中医学认为脏腑经络的病理变化在体表局部穴位有相关反应点,现代研究[8]也发现,内脏炎性损伤可导致相应机体体表穴位局部的理化环境呈现高表达。因此,通过针灸刺激相关穴位可以达到防治CAG的目的。本课题组前期研究[9-14]已证实,艾灸对CAG机体的胃黏膜具有保护作用,同时艾灸正常大鼠的胃经穴可影响胃组织细胞脂质代谢。为了进一步了解艾灸治疗CAG的代谢响应机制,本实验采用核磁共振氢谱技术(1H nuclear magnetic resonance, 1H-NMR),观察艾灸对CAG大鼠足三里局部穴区组织代谢的影响,以探究艾灸治疗CAG潜在的作用机制。
1 材料与方法
1.1 动物与分组
SPF级成年SD雄鼠42只,体质量180~220 g,由湖南中医药大学动物中心实验室提供,许可证号:SYXK(湘)2013-0005。于动物中心实验室分笼饲养,饲养温度20~25 ℃,湿度50%~70%。大鼠适应性喂养7 d后,按随机数字表法分为3组,即正常组、模型组、治疗组,每组14只。
1.2 主要试剂及仪器
N-甲基-N'-硝基-N-亚硝基胍(N-methyl-N'-nitro-N-nitrosoguanidine, MNNG)(东京化成工业株式会社,75F7I-TF);核磁共振仪(德国Bruker,AVANCE Ⅲ HD 850MHZ);震荡仪(德国Scientific Industries,Vortex-Genie2);高速冷冻离心机(上海卢湘仪有限公司,TGL16M);超纯水系统(美国Millipore,Mill-Q);电子天平(Sartorius公司,BA110S);艾条(李时珍蕲艾集团湖北有限公司)。
1.3 模型制备及评定
采用MNNG联合法[15-16](MNNG+乙醇灌胃+饥饱失常法)制备CAG大鼠模型,取5 g MNNG配成浓度为1 g/L的原液储,用锡箔纸包裹后置于 4 ℃冰箱避光冷藏,造模第1天用原液配成170 μg/mL 的MNNG溶液,按1 mL/100 g灌胃1次,随后用原液配150 μg/mL的MNNG饮用液,装于锡箔纸包裹的饮水瓶中,供大鼠自由饮用,隔 24 h更换1次。另将无水乙醇混合清水配成浓度为40%的溶液,按照大鼠体质量1 mL/100 g 的量,每周灌胃2次,模拟长期饮酒的习惯。同时配合单双日饥饱失常法,即单日标准饲料足量喂食,双日禁食,反复交替。造模持续12周,12周后,每组随机取2只大鼠,取胃组织(1.0 cm×0.5 cm×1.0 cm)进行HE染色,在光镜下观察胃黏膜组织,出现固有腺体萎缩,说明CAG模型成功[17]。
1.4 干预方法
正常组持续标准饲料喂养;模型组12周后,标准饲料喂养。两组均只进行抓取、捆绑,15 min/d,连续14 d。
12周后,标准饲料喂养,并予艾灸干预。腧穴选择:选取双侧足三里穴和中脘穴,穴位定位参照《实验针灸学》[18]。艾灸方法:穴位局部以75%酒精消毒后,在穴位表面放置孔径为5 mm的隔热材料,将艾条(直径1.8 cm)固定在距穴位上方10~15 cm处施灸,15 min/d,连续14 d,施灸时确保穴位皮肤温度波动范围为45~55 ℃。
1.5 標本采集及指标检测
1.5.1 胃组织病理学观察 模型评价以及干预14 d后运用HE染色法检测大鼠胃组织形态。处理前大鼠禁食24 h,用10%水合氯醛溶液给大鼠腹腔注射麻醉后开腹、摘取全胃,沿胃小弯剪开胃部并将其内面外翻,以PBS冲洗干净,在胃黏膜明显病变处取标本(约1.0 cm×0.5 cm×1.0 cm),将其放入4%多聚甲醛溶液中,固定24~48 h后将标本梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(厚约4 μm)后经苏木素-伊红染色,置400倍光镜下观察。
1.5.2 局部穴区组织核磁样品制备与采集 大鼠腹腔注射麻醉后取“足三里”为中心的穴区组织(约5 mm×5 mm×5 mm),液氮进行组织淬灭后保存于-80 ℃冰箱中。取50~150 mg穴区组织,在0 ℃条件下按4 mL/g的比例加入预冷的甲醇、氯仿,2.85 mL/g比例加入双蒸水,匀浆1 min、离心(12 000 r/min,5 min,4 ℃),再取0.5 mL上清液(水相),转移到新的离心管中,经氮吹仪浓缩去甲醇后置于冷冻干燥机中,将冷冻干燥过的样品取出溶于PBS液中,并将上层清液550 μL转移到新的核磁管中,离心(1 000 r/min,5 min),4 ℃保存,待测。
采用Bruker核磁共振仪(Avance Ⅲ HD 850 MHz),运用1D noesygppr1d谱脉冲序列采集1H-NMR图谱。实验参数:实验温度25 ℃,自旋回波时间20 s(参数τ=80 ms,n=126次),Tacq=2.7 s,d1=4 s,采样点数TD=64 K,谱宽16 ppm(12 kHz),扫描次数NS=256次,空扫次数DS=16次。使用MestReNova 6.1对1H-NMR谱进行分段积分,每段积分区域宽度(binning)为0.001 ppm。将1H-NMR谱的binning值导入MATLAB,使用icoshift算法对谱峰进行峰对齐[19]。
1.6 数据处理及分析
计算机采集1H-NMR氢谱图,并对代谢物谱峰进行积分,通过主成分分析(PCA)、偏最小二乘判别分析(PLS-DA)对各组大鼠进行代谢模式识别,并结合正交偏最小二乘法(OPLS-DA),根据变量权重值(VIP>1)和独立样本t检验的P<0.05对差异性代谢物进行筛选,所有图谱引入SIMCA-14软件进行处理。同时利用用网站MetPA(http://www.metaboanalyst.ca)和KEGG在线数据库进行代谢通路分析。
2 结果
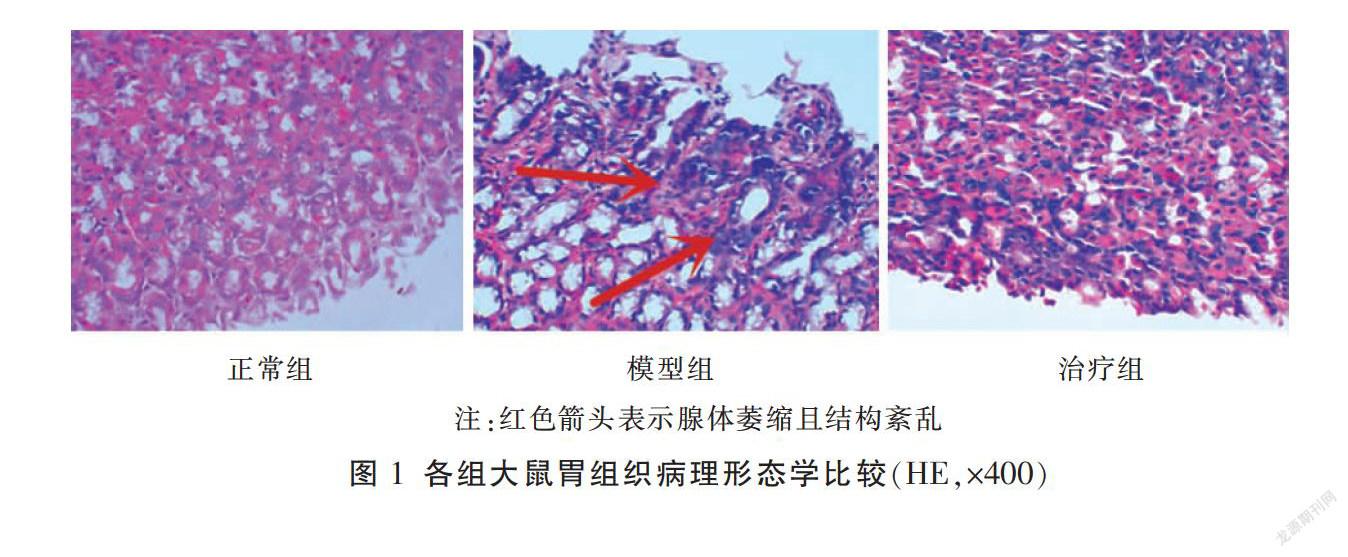
2.1 各组大鼠胃组织病理形态学比较
造模12周后,模型组光镜下可见大量淋巴细胞浸润,固有腺体萎缩、结构紊乱、数量减少,大量主细胞坏死空泡样变化,纤维组织增生充填,并伴有散在出血点,符合CAG大鼠病理诊断。干预2周后,正常组和模型组大鼠胃组织的形态学和造模12周时基本一致;治疗组表现为胃黏膜及黏膜下层有少量淋巴细胞浸润,仍伴有散在出血点,上皮细胞有脱落现象,部分主细胞有部分空泡样改变,但不明显,固有腺体保持相对完整,与模型组相比,有抑制腺体萎缩的趋势。见图1。
2.2 各组大鼠“足三里”穴区组织代谢物的比较
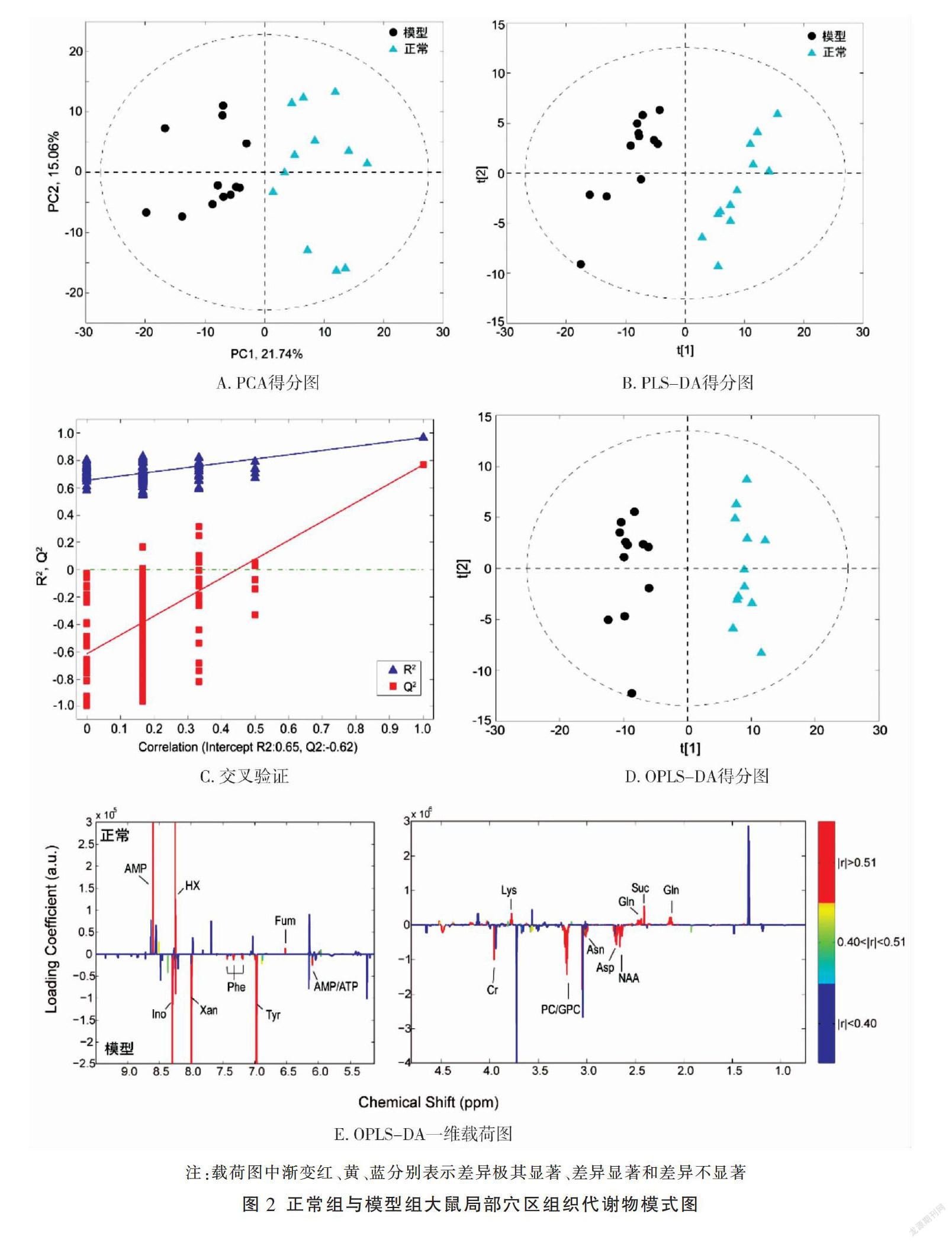
2.2.1 正常组与模型组“足三里”穴区组织代谢物比较 PCA分析(图2A)对比表明,正常组与模型组的局部穴区组织代谢模式存在显著差异,区分主要集中在第一主成分上;PLS-DA分析(图2B)显示,两组样品区分明显,且交叉验证(图2C)表明PLS-DA建模可靠(其中R2代表训练集可解释的方差,而Q2值代表的是该模型的预测能力及其统计有效性。模型的拟合和预测能力均较好,说明其具备充分的生物学可解释性);在差异性代谢物指认前需要进行OPLS-DA分析,将差异性变量集中于第一预测主成分上,对模型组和正常组样品进行两两的OPLS-DA分析,其得分图(图2D)显示两组之间可以很好地区分。与正常组相比,模型组中显著升高的有磷酸胆碱/甘磷酸胆碱(PC/GPC)、天冬酰胺(Asn)、天冬氨酸(Asp)、N-乙酰天门冬氨酸(NAA)、酪氨酸(Tyr)、苯丙氨酸(Phe)、黄嘌呤(Xan)、肌苷(Ino);而显著降低的有赖氨酸(Lys)、谷氨酰胺(Gln)、琥珀酸(Suc)、一磷酸腺苷(AMP)、次黄嘌呤(HX)、富马酸(Fum)。见图2E。
2.2.2 模型组与治疗组“足三里”穴区组织代谢物的比较 PCA分析(图3A)对比表明,两组局部穴区组织代谢模式能够明显区分,治疗组有1个样品分布在 95%置信区间外,有两个样品与模型组重叠(这可能是由于组织样本提取中加入的甲醇还未完全冻干。对这两张谱中的异常峰剔除后,仍可用于下一步PLS-DA分析);对两组样品进行PLS-DA分析,PLS-DA得分图(图3B)显示两组样品可明显区分,交叉验证(图3C)证明PLS-DA模型可靠,表明各组样品区分的正确性;OPLS-DA得分图(图3D)显示,两组局部穴区代谢模式能很好区分。CAG状态下,通过艾灸干预,可引起醋酸(Ace)、腺苷(Ade)、二磷酸腺苷(ADP)显著升高,丙氨酸(Ala)、谷氨酸(Glu)、谷氨酰胺(Gln)、N-乙酰天门冬氨酸(NAA)、天冬酰胺(Asn)、甲基甘氨酸(DMG)、苏氨酸(Thr)、琥珀酸(Suc)、磷酸胆碱(PC)、甘磷酸胆碱(GPC)、尿嘧啶DNA糖基化酶(UDG)、一磷酸腺苷(AMP)、二磷酸腺苷(ADP)、三磷酸腺苷(ATP)、次黄嘌呤(HX)、肌苷(Ino)显著降低。见图3E。
2.3 代谢通路分析
将1H-NMR找到的模型组与治疗组穴区组织19个差异代谢物输入MetPA(http://www.metaboanalyst.ca)中进行代谢通路分析,根据代谢通路重要值(impact value)>0.1以及代谢通路富集水平-log10(P)>2作为选择标准,筛选出3条代谢通路。3条代谢通路包括丙氨酸、天冬氨酸、谷氨酸代谢,嘌呤代谢和D-谷氨酰胺、D-谷氨酸代谢。见图4。
3 讨论
中医学中没有关于CAG的具体论述,可以将其归属“胃脘痛”“胃痞”“反酸”“嘈杂”等范畴。《素問·本病论》就已经指出“饮食劳倦则伤脾”,到《脾胃论》明确提出“痞自血出”,寒温不适、喜怒忧恐、饮食失节均会导致气火失调、内伤脾胃。《景岳全书·心腹痛》云:“食、寒、气不顺均会胃脘痛症,然食寒二者皆关于气,食停滞气,寒留凝气,故其治病应以理气为主,观其果属实邪。”关于CAG的治疗,《灵枢·邪气脏腑病形》云:“胃病者,腹胀……取之三里也”,足三里既是胃腑的下合穴,又为阳明经合穴,“荥输治外经,合治内府”“治府者,治其合”都提示足三里可以治疗CAG。经现代统计[20]发现,针灸治疗CAG的穴位中,足三里和中脘使用频次居前位,其中足三里使用频次最高。因此,本实验选择足三里和中脘治疗CAG大鼠。
代谢组学,即细胞、组织或整个生物体中小分子代谢物的综合图谱[21],是一种新的研究代谢网络和人体与环境关系的方法[22],符合中医学的“整体观念”。在系统生物学中,代谢组学是各种分子途径的最终结点[23],是一种“由果推因”的研究方法。与蛋白质等的变化相比,代谢物的变化能更灵敏地反应机体的微小变化,因而可以采用代谢组学方法探讨中医药的相关问题,为中医药复杂理论体系的研究提供新的思路和方法[24]。
与正常组相比,CAG病理状态下局部穴区组织处于代谢紊乱状态,主要体现在能量代谢、神经递质紊乱。显著降低的有赖氨酸、谷氨酰胺、琥珀酸、一磷酸腺苷、次黄嘌呤、富马酸,而显著升高的有磷酸胆碱/甘磷酸胆碱、天冬酰胺、天冬氨酸、N-乙酰天门冬氨酸、酪氨酸、苯丙氨酸、黄嘌呤、肌苷。谷氨酸是中枢神经系统中最丰富、快速的兴奋性神经递质,和谷氨酸神经递质的前体-谷氨酰胺在维持胃肠黏膜的完整性起到重要作用,谷氨酰胺显著下降,与丙氨酸、天冬氨酸、谷氨酸代谢有关,说明CAG大鼠神经递质发生紊乱[25-26];N-乙酰天门冬氨酸是神经系统的特定代谢产物,是天门冬氨酸和乙酰辅酶A在神经元线粒体中合成的,N-乙酰天门冬氨酸显著升高,说明模型大鼠神经系统受到了一定程度的影响[27-28]。琥珀酸在三羧酸循环中起重要作用,并参与三磷酸腺苷的合成[29],琥铂酸显著降低说明模型组大鼠的能量代谢受到影响。
与模型组相比,治疗组在艾灸干预后对腺苷、天冬酰胺、N-乙酰天门冬氨酸、谷氨酰胺、磷酸胆碱、甘磷酸胆碱、肌苷、黄嘌呤等水平发生逆转,主要影响了大鼠局部穴区组织的能量代谢、氨基酸代谢以及核酸代谢等方面,主要效应为调控紊乱的神经递质及能量代谢,通过丙氨酸、天冬氨酸、谷氨酸代谢,嘌呤代谢和D-谷氨酰胺、D-谷氨酸代谢实现。腺苷与磷酸的结合可以用来储存能量,在能量代谢上扮演着重要角色[30],腺苷显著升高提示艾灸通过促进核苷酸的分解以促进局部组织能量代谢;琥珀酰的硫酯键水解生成琥珀酸和辅酶A,而琥珀酰在脂肪和蛋白质的新陈代谢中起着重要作用[31-32],琥珀酸显著下降也可说明艾灸可调节能量代谢。天冬酰胺、N-乙酰天门冬氨酸、谷氨酰胺的回调说明艾灸干预可能通过调节神经递质的功能对CAG大鼠产生良性效应。此外,氨基酸中谷氨酸、苏氨酸、甘氨酸浓度的降低可能是艾灸作用后的生物学效应。如甘氨酸是许多蛋白质的前体,是一种抗氧化剂和内源性抗氧化剂谷胱甘肽的组成氨基酸,通过多种方式抑制体内氧自由基对细胞膜过度氧化造成的损伤[33]。
综上所述,艾灸干预可以通过对多种代谢路径的调节,回调与CAG相关的一些代谢物来有效治疗CAG。其中,CAG大鼠局部穴区相关能量代谢、氨基酸代谢以及核酸代谢变化明显。代谢组学的研究目标是代谢终产物,它可以将基因和蛋白表达的微小变化在代谢物水平上放大,因此,代谢组拥有丰富的信息,将其与艾灸作用机制研究相结合,运用代谢组学的多种技术手段观察艾灸干预后生物体代谢物种类、数量和代谢路径的变化,构建相关代谢网络,从而探寻艾灸作用于机体的关键靶点和相关代谢路径,为临床以及基础研究提供更多的科研依据。
参考文献
[1] RODRIGUEZ-CASTRO K I, FRANCESCHI M, NOTO A, et al. Clinical manifestations of chronic atrophic gastritis[J]. Acta Biomed, 2018,89(8-S):88-92.
[2] LI Y, XIA R, ZHANG B, et al. Chronic Atrophic Gastritis: A Review[J]. Journal of Environmental Pathology, Toxicology and Oncology, 2018,37(3):241-259.
[3] ADAMU M A, WECK M N, ROTHENBACHER D, et al. Incidence and risk factors for the development of chronic atrophic gastritis: five year follow-up of a population-based cohort study[J]. International Journal of Cancer, 2011,128(7):1652-1658.
[4] RUGGE M, GENTA R M, GRAHAM D Y, et al. Chronicles of a cancer foretold: 35 years of gastric cancer risk assessment[J]. Gut, 2016,65(5):721-725.
[5] CHEN J Y, PAN F, XU J J. Effects of acupuncture on the gastric motivity
in patients with functional dyspepsia[J]. Chinese Journal of Integrated Traditional and Western Medicine, 2005,25(10):880-882.
[6] AHN S Y, LEE S Y, HONG S Y, et al. Endoscopic diagnosis of open-type atrophic gastritis is related to the histological diagnosis of intestinal metaplasia and Cdx2 expression[J]. Digestive Diseases and Sciences, 2011,56(4):1119-1126.
[7] 朱風彬.针灸治疗慢性萎缩性胃炎的疗效及对炎症因子和生活质量的影响[J].中医临床研究,2019,11(29):42-44.
[8] 朱 兵.穴位敏化现象及其生物学意义[J].中国针灸,2019,39(2):115-121.
[9] 朱 伟,胡小珍,钟 欢,等.基于经脉-脏腑相关的慢性萎缩性胃炎模型大鼠足三里穴区代谢组学特点分析[J].中华中医药杂志,2019,34(2):768-772.
[10] 刘 霞,佘 畅,钟 欢,等.基于代谢组学技术研究艾灸“足三里”对慢性萎缩性胃炎大鼠胃组织代谢物的影响[J].针刺研究,2019,44(2):113-119.
[11] 周 巍,杨 青,舒文娜,等.艾灸与针刺对慢性萎缩性胃炎大鼠胃黏膜细胞凋亡及NF-κB、Bcl-2基因表达的影响[J].针刺研究,2021,46(4):284-288.
[12] 尹鸿智,赵 娟,刘 倩,等.针刺对慢性萎缩性胃炎大鼠“足三里”穴区HRH2、SP及炎性因子表达的影响[J].湖南中医药大学学报,2021,41(2):259-264.
[13] 范丽红,方 园,黄 河,等.针刺与艾灸治疗慢性萎缩性胃炎的多中心前瞻性临床研究[J].湖南中医药大学学报,2020,40(9):1060-1064.
[14] 曹佳男,钟 欢,刘 密,等.温针灸对慢性萎缩性胃炎大鼠局部穴区组织代谢的影响[J].湖南中医药大学学报,2020,40(9):1054-1059.
[15] ZHU X, LIU S, ZHOU J, et al. Effect of Astragalus polysaccharides on chronic atrophic gastritis induced by N-methyl-N'-nitro-N-nitrosoguanidine in rats[J]. Drug Research, 2013, 63(11):597-602.
[16] 朱萱萱,史淋峰,吴旭彤,等.实验性慢性萎缩性胃炎脾气虚证模型的建立及不同时期病理形态学的改变[J].中华中医药学刊,2012,30(2):231-233,449-450.
[17] 房静远,杜奕奇,刘文忠,等.中国慢性胃炎共识意见(2017年,上海)[J].胃肠病学,2017,22(11):670-687.
[18] 李忠仁.实验针灸学[M].北京:中国中医药出版社,2007:255-257.
[19] SAVERANI F, TOMASI G, ENGELSEN S B. icoshift: A versatile tool for the rapid alignment of 1D NMR spectra[J]. Journal of Magnetic Resonance, 2010,202(2):190-202.
[20] 李 琪,吴梦蝶,吴焕淦,等.针灸治疗慢性萎缩性胃炎临床随机对照试验研究综述[J].世界科学技术-中医药现代化,2019,21(8):1563-1572.
[21] BOWEN B P, NORTHEN T R. Dealing with the unknown:
metabolomics and metabolite atlases[J]. Journal of the American Society for Mass Spectrometry, 2010, 1(9): 1471-1476.
[22] MOSZAK M, SZULINSKA M, BOGDANSKI P. You Are What You Eat-The Relationship between Diet, Microbiota, and Metabolic Disorders-A Review[J]. Nutrients, 2020,12(4):1096.
[23] 楊 军,宋硕林,JIOSE CASTRO PEREZ,等.代谢组学及其应用[J].生物工程学报,2005,4(1):1-5.
[24] 方 芳,陈岩波,王艳丽,等.基于代谢组学的针灸作用机制研究及其应用思路[J].针灸临床杂志,2019,35(11):88-90.
[25] FRANCO R, SCHONENELD O J, PAPPA A, et al. The central role of glutathione in the pathophysiology of human diseases[J]. Archives of Physiology and Biochemistry, 2007,113(4-5):234-258.
[26] YAMAMOTO T, SHMOYAMA T, KURIYAMA M. Dietary and enteral interventions for Crohn's disease[J]. Current Opinion in Biotechnology, 2017, 44:69-73.
[27] SURENDRAN S, BHATNAGAR M. Upregulation of N-acetylaspartic acid induces oxidative stress to contribute in disease pathophysiology[J]. International Journal of Neuroscience, 2011, 121(6): 305-309.
[28] PEDERZOLLI C D, MESCKA C P, MAGNUSSON A S, et al. N-acetylaspartic acid impairs enzymatic antioxidant defenses and enhances hydrogen peroxide concentration in rat brain[J]. Metabolic Brain Disease, 2010, 25(2): 251-259.
[29] GUARNIERI M T, CHOU Y C, SALVACHUA D, et al. Metabolic Engineering of Actinobacillus succinogenes Provides Insights into Succinic Acid Biosynthesis[J]. Applied and Environmental Microbiology, 2017, 83(17): e00996-e01009.
[30] BARCELOS R P, STEFANELLO S T, MAURIZ J L, et al. Creatine and the Liver: Metabolism and Possible Interactions[J]. Mini-Reviews in Medicinal Chemistry,2016,16(1):12-18.
[31] AMBATI C S R, YUAN F, ABU-ELHEIGA L A, et al. Identification and Quantitation of Malonic Acid Biomarkers of In-Born Error Metabolism by Targeted Metabolomics[J]. Journal of the American Society for Mass Spectrometry,2017,28(5):929-938.
[32] BRADFIELD M F, NICOL W. The pentose phosphate pathway leads to enhanced succinic acid flux in biofilms of wild-type Actinobacillus succinogenes[J]. Applied microbial and cell physiology, 2016,100(22):9641-9652.
[33] ARORA S, KAUR T, KAUR A, et al. Glycine aggravates ischemia reperfusion-induced acute kidney injury through N-Methyl-D-Aspartate receptor activation in rats[J]. Molecular and Cellular Biochemistry, 2014,393(1-2):123-131.
