基于HPLC指纹图谱与一测多评法联用的血府逐瘀片质量控制研究
2021-11-21马梦鸽唐志书宋忠兴史鑫波贾艾玲刘妍如马虎强王昌利
马梦鸽,杨 莎,唐志书, *,宋忠兴,史鑫波,贾艾玲,刘妍如,马虎强,王昌利,
基于HPLC指纹图谱与一测多评法联用的血府逐瘀片质量控制研究
马梦鸽1,杨 莎2,唐志书1, 2*,宋忠兴2,史鑫波2,贾艾玲1,刘妍如2,马虎强3,王昌利2, 3
1.长春中医药大学药学院,吉林 长春 130117 2.陕西中医药大学/陕西中药资源产业化省部共建协同创新中心/陕西中药产业研究院,陕西 咸阳 712046 3.陕西海天制药有限公司,陕西 咸阳 712000
建立血府逐瘀片HPLC指纹图谱及其6种成分苦杏仁苷、芍药苷、柚皮苷、橙皮苷、阿魏酸、新橙皮苷的一测多评法(QAMS),验证该方法在血府逐瘀片质量分析中应用的科学性与可行性。采用中药指纹图谱软件(2012A版)软件对10批样品进行相似度分析。以苦杏仁苷为内参物,建立芍药苷、阿魏酸、柚皮苷、橙皮苷和新橙皮苷的相对校正因子(s/i),并利用s/i计算血府逐瘀片样品中该6种成分的含量,同时采用外标法计算各成分的含量,并比较2种方法差异。10批样品指纹图谱中共有24个峰,相似度均大于0.990。以苦杏仁苷为内参物建立的芍药苷、柚皮苷、橙皮苷、阿魏酸、新橙皮苷的s/i分别为1.169 6、0.172 0、0.363 3、0.141 3、0.259 2,QAMS与外标法得到的10批血府逐瘀片样品含量测定结果相对误差(RE)<3%,没有显著差异。建立的指纹图谱和QAMS含量测定法稳定可控,简单易行,可用于血府逐瘀片的质量控制。
血府逐瘀片;一测多评法;HPLC;指纹图谱;苦杏仁苷;芍药苷;阿魏酸;柚皮苷;橙皮苷;新橙皮苷
血府逐瘀片(Xuefu Zhuyu Tablets,XZT)是由血府逐瘀汤经现代工艺制作而成的复方制剂,始载于清代著名医家王清任所著的《医林改错》中,由柴胡、地黄、桃仁、当归、赤芍、麸炒枳壳、川芎、甘草、牛膝、红花、桔梗11味中药组成,具有活血祛瘀、行气止痛的功效。临床上用于气滞血瘀所致的胸痹、头痛日久、痛如针刺而有定处、内热烦闷、失眠多梦、心悸怔仲、急躁善怒等症[1-3]。方中桃仁活血祛瘀,主要含挥发油类、氨基酸、蛋白质类、黄酮及其苷类等。红花活血通经、散瘀止痛,主要含有羟基红花黄色素A、山柰素等成分。川芎活血行气止痛,为“血中气药”,主要含挥发油、生物碱、多糖等。赤芍擅长凉血、祛瘀、止痛,主要含鞣质、黄酮、挥发油、萜类及其苷类等。当归具有补血、活血之功,主要含黄酮、皂苷、多糖、有机酸、挥发油、氨基酸等多种活性成分。牛膝长于活血通经,祛瘀止痛;桔梗开宣肺气、载药上行。二者合用可舒畅全身气机血脉。生地凉血滋阴、养血活血;柴胡疏肝解郁、升达清阳;枳壳理气行滞;五药合用,开胸行气,调节全身气机,气行则血行,气机调畅则能促进血液正常运行。甘草调和诸药,祛除毒性。这些药配合起来,共同起到行气止痛,活血祛瘀而不伤阴液,活血而不伤血之功效[4-10]。
中成药复方制剂由多味中药材组方而成,每味药材又含有多种成分,因此复方制剂中有效成分复杂多样,具有多靶点的特点,但现行标准以及文献仅对所含单一成分进行定量分析,难以全面控制其质量,因此,多指标成分评价模式已逐步应用于相关质量控制中[11-13]。刘立辉[14]建立HPLC测定XZT赤芍中的芍药苷的含量。但文献对XZT的报道较少并且存在所测指标单一等问题,无法系统地评价中药复方制剂的整体质量。一测多评法(QAMS)具有操作成本低、简单、快捷的优点,适用于药效成分复杂多样的中药及中药制剂,符合中药多成分、多功效的作用特点[15-16]。因此,为了更好地控制XZT的质量,本实验建立XZT的指纹图谱,并采用QAMS法,以苦杏仁苷为内参物,同步测定其主要活性成分阿魏酸、柚皮苷、橙皮苷、芍药苷、新橙皮苷,以期为该制剂的质量控制和评价提供依据。
1 仪器与材料
1.1 仪器
Agilent 1260型高效液相色谱仪,美国安捷伦公司;Waters e2695型高效液相色谱仪,美国Waters公司;色谱柱为Diamonsil Plus C18柱(250 mm×4.6 mm,5 μm)、YMC-Pack ODS-A柱(250 mm×4.6 mm,5 μm)、Agilent 5 TC-C18(250 mm×4.6 mm,5 μm);CPA225D电子天平,北京赛多利斯科学仪器有限公司;KQ-300DE型数控超声波清洗器,昆山市超声仪器有限公司;Milli-Q型纯水机。
1.2 试药
对照品阿魏酸(批号110773-201614)、橙皮苷(批号110721-201818)、柚皮苷(批号110722-201815)、芍药苷(批号110736-201842)、苦杏仁苷(批号110820-201808)、新橙皮苷(批号111857-201703),质量分数均为98%,购自于中国食品药品检定研究院。
枳壳(麸炒)为芸香科柑橘属植物酸橙L.的干燥未成熟果实;当归为伞形科当归属植物当归(Oliv.) Diels.的干燥根;川芎为伞形科藁本属植物川芎Hort.的干燥根茎;赤芍为毛茛科芍药属植物芍药Pall.的干燥根;桃仁(炒)为蔷薇科桃属植物桃(L.) Batsch.的干燥成熟种子;柴胡为伞形科柴胡属植物柴胡DC.的干燥根;牛膝为苋科牛膝属植物牛膝Bl.的干燥根;红花为菊科红花属植物红花L.的干燥花;甘草为豆科甘草属植物甘草Fisch.的干燥根;桔梗为桔梗科桔梗属植物桔梗(Jacq.) A.DC.的干燥根;地黄为玄参科地黄属植物地黄Libosch.的干燥块根,以上均由陕西海天制药有限公司提供,经陕西中医药大学刘世军高级工程师鉴定均为正品。
XZT,每片质量0.42 g,批号190402、190403、190404、190501、190502、190503、190504、190602、190704、190803,分别编号S1~S10,由陕西海天制药有限公司提供。甲醇(批号V1LG3H)和乙腈(批号UCNA1H)均为色谱纯,上海霍尼韦尔贸易有限公司;水为超纯水;其他试剂均为分析纯。
2 方法与结果
2.1 色谱条件
色谱柱为Diamonsil Plus C18柱(250 mm×4.6 mm,5 μm);流动相为乙腈-0.1%磷酸水溶液,梯度洗脱:0~3 min:5%~10%乙腈;3~12 min:10%~15%乙腈;12~13 min:15%~18%乙腈;13~15 min:18%~22%乙腈;15~22 min:22%~25%乙腈;22~30 min:25%~5%乙腈;体积流量1 mL/min;柱温30 ℃;检测波长210 nm、215 nm(苦杏仁苷、芍药苷)、254 nm(阿魏酸)、270 nm(橙皮苷、新橙皮苷、柚皮苷);进样量10 μL。在该色谱条件下,理论塔板数按苦杏仁苷计算不低于1×105,各组分离度良好(分离度>1.5)。外标法检测波长215 nm,色谱图见图1。
2.2 溶液的制备
2.2.1 对照品溶液 精密称取苦杏仁苷、芍药苷、柚皮苷、新橙皮苷、橙皮苷和阿魏酸对照品适量,用甲醇稀释,即得含苦杏仁苷123.3 μg/mL、芍药苷83.3 μg/mL、柚皮苷113.3 μg/mL、新橙皮苷123.3 μg/mL、橙皮苷156.6 μg/mL、阿魏酸60.0 μg/mL的混合对照品溶液。
2.2.2 供试品溶液 本品除去薄膜衣后研成细粉,取粉末约1 g,精密称定,置具塞锥形瓶中,精密加入50%甲醇50 mL,称定质量,放置过夜后,超声(功率250 W、频率40 kHz)处理20 min,放冷,再称定质量,用50%甲醇补足减失的质量,摇匀,滤过,取续滤液,过0.22 μm微孔滤膜,即得。
2.2.3 阴性样品溶液 按照处方比例(柴胡29.4 g、当归88.2 g、地黄88.2 g、赤芍58.8 g、红花88.2 g、桃仁117.6 g、枳壳58.8 g、甘草29.4 g、川芎44.1 g、牛膝88.2 g、桔梗44.1 g),分别制备缺枳壳、缺赤芍、缺桃仁、缺当归川芎的阴性样品,按照“2.2.2”项下方法制备,即得各阴性样品溶液。
2.3 指纹图谱建立
2.3.1 精密度试验 精密称取同一批XZT样品(批号190803),按“2.2.2”项下方法制备供试品溶液,并按“2.1”项下色谱条件连续进样6次,记录色谱图,计算所有共有峰的相对保留时间和相对峰面积。结果表明,各共有峰相对峰面积RSD值均小于2.0%,表明本方法精密度良好。
2.3.2 重复性试验 取同一批样品(批号190803),按照“2.2.2”项下操作条件平行制备6份供试品溶液,并按“2.1”项下色谱条件连续进样,记录色谱图,计算所有共有峰的相对保留时间和样品含量。结果表明,各色谱峰的样品含量的RSD值均小于2.0%。
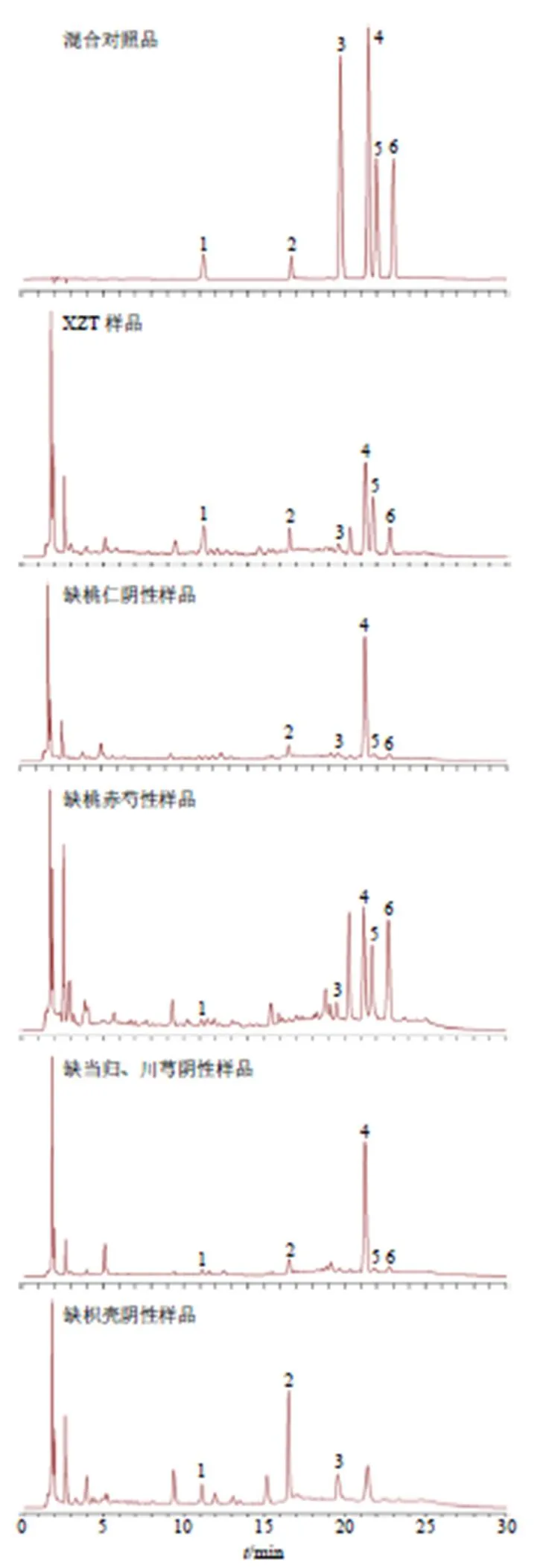
1-苦杏仁苷 2-芍药苷 3-阿魏酸 4-柚皮苷 5-橙皮苷 6-新橙皮苷
2.3.3 稳定性试验 取同一份供试品溶液(批号190803),室温下于0、2、4、8、12、24 h在“2.1”项下色谱条件进样测定,记录色谱图,结果表明苦杏仁苷、芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷的峰面积RSD值分别为1.11%、2.69%、2.75%、2.10%、2.31%、0.94%,表明供试品溶液在制备后24 h内稳定性良好。
2.3.4 指纹图谱的建立 取10批次的XZT样品,分别按照“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样测定。将10批样品所得各色谱图导入中药指纹图谱软件(2012A版)软件中进行数据分析处理,设S1样品图谱为参照图谱,采用多点校正方式(时间窗宽度为0.1 min),用平均数法生成指纹图谱和对照指纹图谱(图2)。通过对10批次样品指纹图谱分析,发现图中有24个峰为所有样品溶液色谱图中的共有色谱峰,因此,确定此24个色谱峰为XZT的共有峰。其中16号峰分离度以及对称性良好,故作为参照峰(S)。
2.3.5 相似度评价 对10批XZT样品的指纹图谱进行相似度的计算,结果S1~S10样品的相似度分别为0.999、0.997、0.992、0.995、0.998、0.999、0.998、0.996、0.993、0.998,结果表明10批XZT的相似度均大于0.990,说明10批次XZT样品的质量相对稳定。
2.3.6 共有峰指认归属 采用混合对照品(图3)对共有峰进行指认,与对照指纹图谱相对保留时间进行比对(图3),确定了其中6个共有峰,分别为1号峰(苦杏仁苷)、2号峰(芍药苷)、3号峰(阿魏酸)、4号峰(柚皮苷)、5号峰(橙皮苷)、6(新橙皮苷),结果说明XZT与其组方药材之间存在良好的相关性。
2.4 指标成分含量测定的方法学考察
2.4.1 线性关系考察 分别精密吸取“2.2.1”项下的(苦杏仁苷123.3 μg/mL、芍药苷83.3 μg/mL、柚皮苷113.3 μg/mL、新橙皮苷123.3 μg/mL、橙皮苷156.6 μg/mL、阿魏酸60.0 μg/mL)的混合对照品溶液I加甲醇稀释2、4、10、50、100倍制得混合对照品溶液II~VI,将不同质量浓度的混合对照品溶液I~VI按照“2.1”项下色谱条件进样测定,以对照品浓度作为横坐标(),峰面积积分值为纵坐标(),绘制标准曲线,得回归方程,结果见表1,各成分在各自范围内线性关系良好。
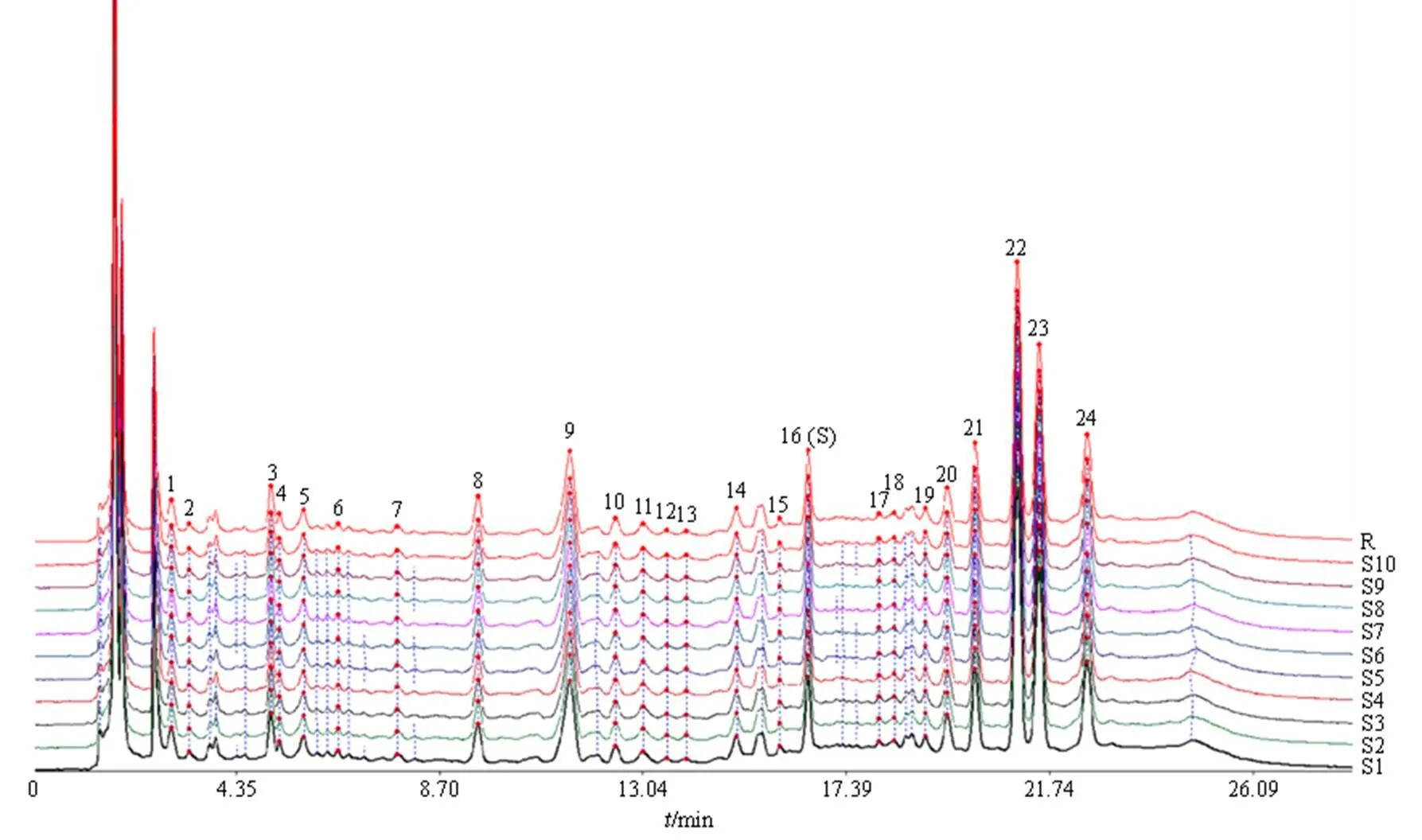
图2 10批XZT指纹图谱及对照指纹图谱(R)
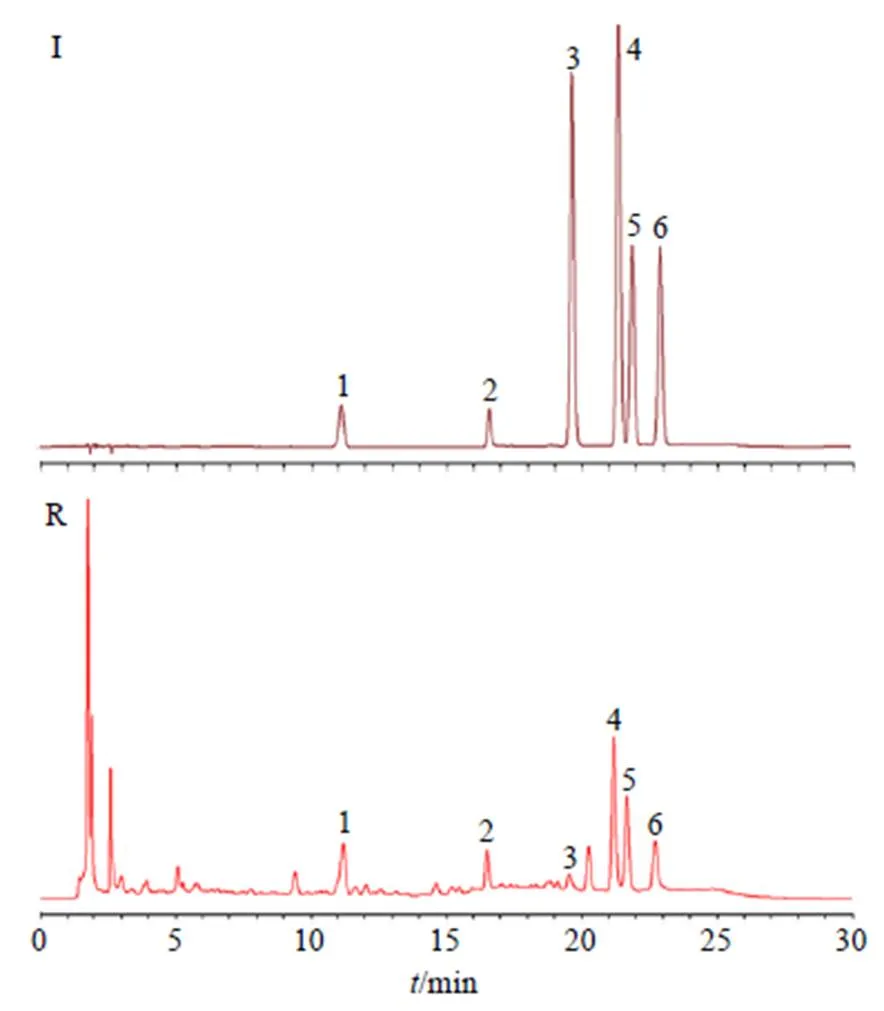
1-苦杏仁苷 2-芍药苷 3-阿魏酸 4-柚皮苷 5-橙皮苷 6-新橙皮苷
2.4.2 精密度试验 精密吸取“2.2.1”项下混合对照品溶液,按“2.1”项下色谱条件连续进样6次进行测定,测得苦杏仁苷、芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷峰面积的RSD分别为0.52%、0.39%、0.26%、0.24%、0.38%、0.29%,说明仪器的精密度良好。
2.4.3 稳定性试验 取同一份供试品溶液(批号190803),室温下于制备后0、2、4、8、12、24 h在“2.1”项下色谱条件进样测定,得苦杏仁苷、芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷峰面积的RSD分别为1.11%、2.69%、2.75%、2.10%、2.31%、0.94%,结果表明供试品溶液在制备后24 h内稳定性良好。
2.4.4 重复性试验 取同一批样品(批号190803),按照“2.2.2”项下条件平行制备6份供试品溶液,在“2.1”项下色谱条件进行测定,测得苦杏仁苷、芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷质量分数的RSD值分别为1.82%、2.30%、1.29%、1.60%、1.98%、2.22%,说明该方法的重复性良好。

表1 各成分的回归方程、线性范围和检测线、定量限
2.4.5 加样回收率试验 取含有量已知的同一批样品(批号190803)约1 g,称取6份,精密称定,分别加入与XZT各成分相等含量的对照品溶液,再按照“2.2.2”项下方法制备供试品溶液,按“2.1”项下色谱条件进样,记录峰面积,计算加样回收率。结果苦杏仁苷、芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷的平均加样回收率分别为99.12%、99.72%、101.14%、98.54%、101.01%、97.58%,RSD分别为2.13%、2.61%、2.16%、2.09%、1.68%、1.85%。表明该方法的准确度良好。
2.5 QAMS建立
2.5.1s/i的测定 按照“2.1”项下色谱条件,将“2.2.1”项下的混合对照品溶液分别进样1、3、5、7、9、11 μL,记录各成分峰面积,以苦杏仁苷为内参物,采用多点校正法,按照下面公式分别计算芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷的s/i,结果5个待测成分与内参物s/i的RSD值均小于2%,见表2。
s/is/fsC/ACs
s为苦杏仁苷对照品的峰面积,s为苦杏仁苷对照品的质量浓度,A为待测成分峰面积,C为待测成分的质量浓度
2.5.2 不同仪器和不同色谱柱考察 考察了Waters e2695和Agilent 1260 2种高效液相色谱仪及Diamonsil Plus C18(250 mm×4.6 mm,5 μm)、YMC-Pack ODS-A(250 mm×4.6 mm,5 μm)、Agilent 5 TC-C18(250 mm×4.6 mm,5 μm)3种色谱柱对s/i的影响,并计算RSD,结果均小于3%,表明不同仪器和色谱柱适用性良好。结果见表3。
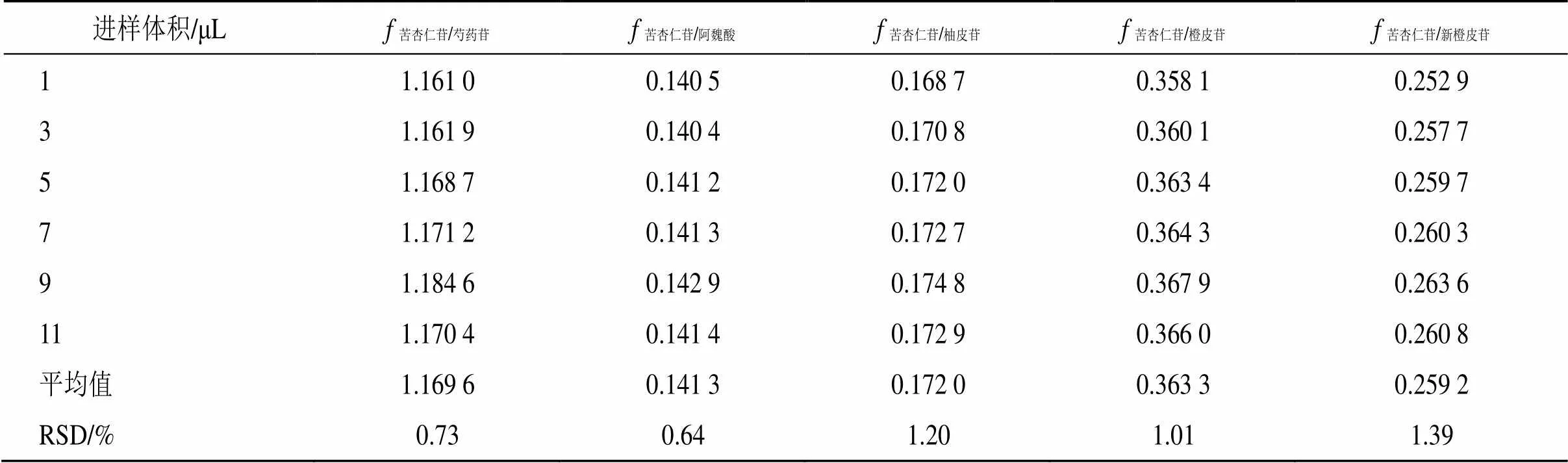
表2 各成分的fs/i
2.5.3 不同柱温对s/i的影响 本实验采用Agilent 1260色谱仪和Diamonsil Plus C18色谱柱考察了柱温25、30、35 ℃对s/i的影响,并计算RSD,结果均小于3%,表明不同柱温对各成分无显著影响。结果见表4。
2.5.4 不同体积流量对s/i的影响 本实验采用Agilent 1260色谱仪和Diamonsil Plus C18色谱柱考察了体积流量为0.8、0.9、1.0 mL/min时对s/i的影响,并计算RSD,结果均小于3%,表明不同体积流量的变化对各成分的s/i无明显影响。结果见表5。
2.5.5 不同检测波长对s/i的影响 本实验采用Agilent 1260色谱仪和Diamonsil Plus C18色谱柱考察了检测波长为213、215、217 nm时对s/i的影响,并计算RSD,结果均小于3%,表明不同检测波长的变化对各成分的s/i无明显影响。结果见表6。
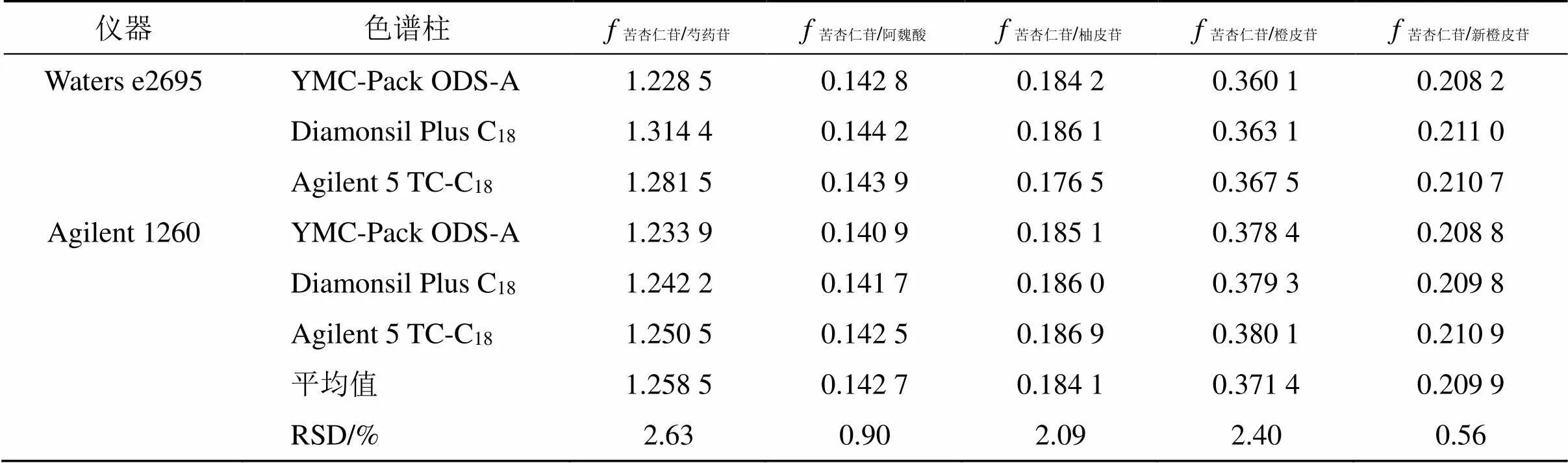
表3 不同仪器和色谱柱对fs/i的影响
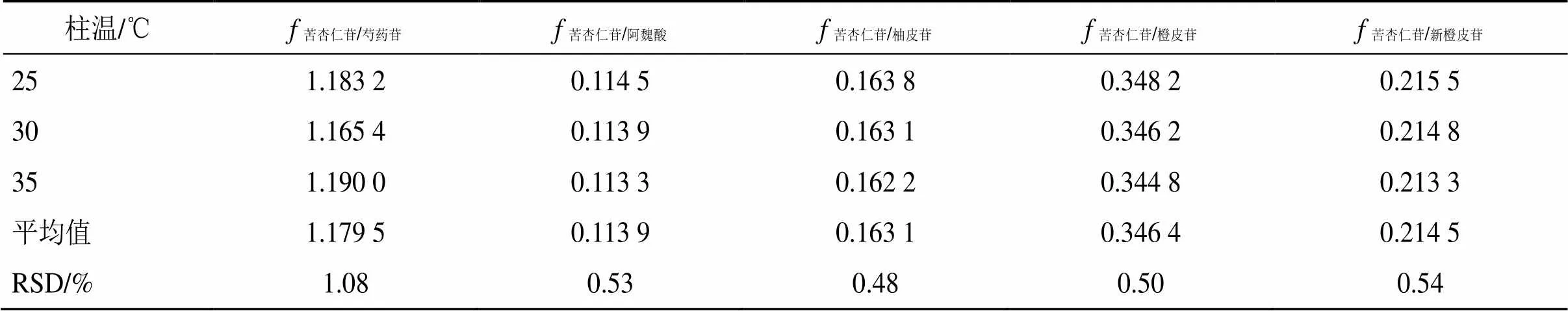
表4 不同柱温对fs/i的影响

表5 不同体积流量对fs/i的影响
综上几种因素,说明该方法对s/i耐用性良好。
2.6 待测组分色谱峰定位
取混合对照品溶液,选取3只不同品牌色谱柱,按照“2.1”项下色谱条件测定,以苦杏仁苷为内参物,计算其他5种成分相对保留时间(s/i),对待测组分进行定位,并计算RSD,结果各待测成分相对保留值得RSD均小于5%,表明采用相对保留值法对待测成分定位是合理的。结果见表7。
2.7 QAMS与外标法结果对比
取10批样品,按照“2.2.2”项下条件制备供试品溶液,在“2.1”项下色谱条件进行测定,记录峰面积,采用QAMS法建立内参物苦杏仁苷与芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷的s/i,对10批XZT样品中各成分进行含量测定,同时采用外标法对苦杏仁苷、芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷进行含量测定,并以相对误差(relative error,RE)来表示2种方法测得结果的差异,RE=(QAMS-外标法)/外标法(QAMS为QAMS测得的含量,外标法为外标法测得的含量)。结果见表8。结果发现,外标法与QAMS法计算所得到的组分含量基本一致,外标法实测含量值与QAMS法所测成分含量值无显著性差异。10批样品中苦杏仁苷、芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷外标法与QAMS法综合质量分数分别为2.351~2.433、2.684~2.802、0.173~0.183、1.845~1.980、1.912~2.026、1.084~1.310 mg/g,以苦杏仁苷、芍药苷成分含量较高。
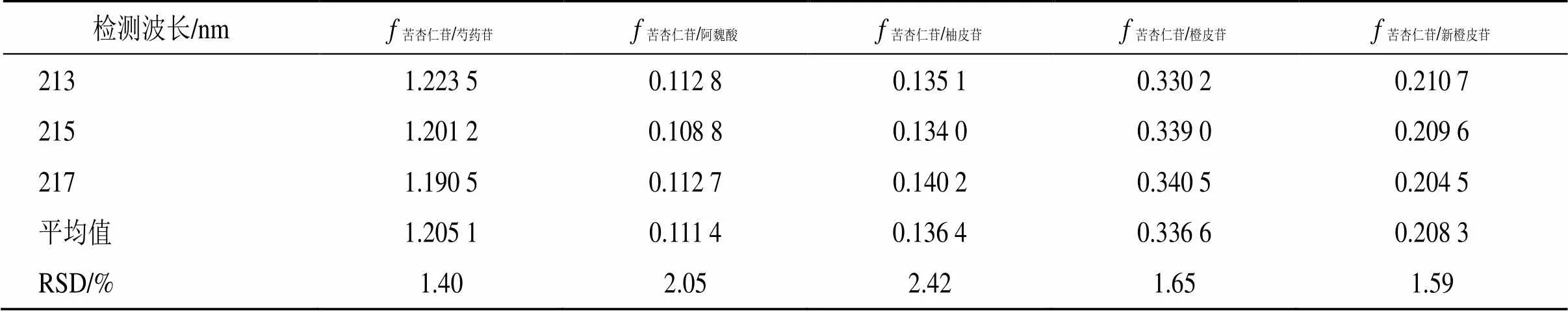
表6 不同检测波长对fs/i的影响
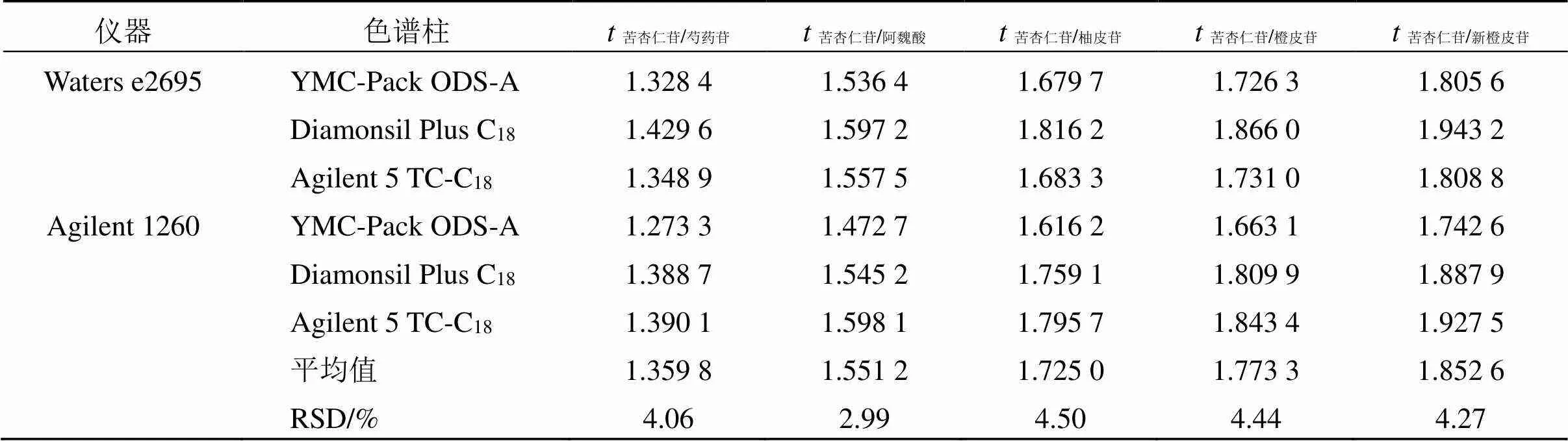
表7 不同色谱柱测得的ts/i值
QAMS法是通过测定某个代表性成分,来计算出其他待测有效成分的含量,使其计算值与实测值符合定量方法学的要求,但是中药成分复杂,对其研究也是一项复杂庞大的工程,QAMS法简化了分析过程,降低分析成本,但在实际应用中可能还存在着局限性,为了使QAMS法在同时测定中药多成分中得到广泛应用,还需对QAMS法相关技术进行深入研究。
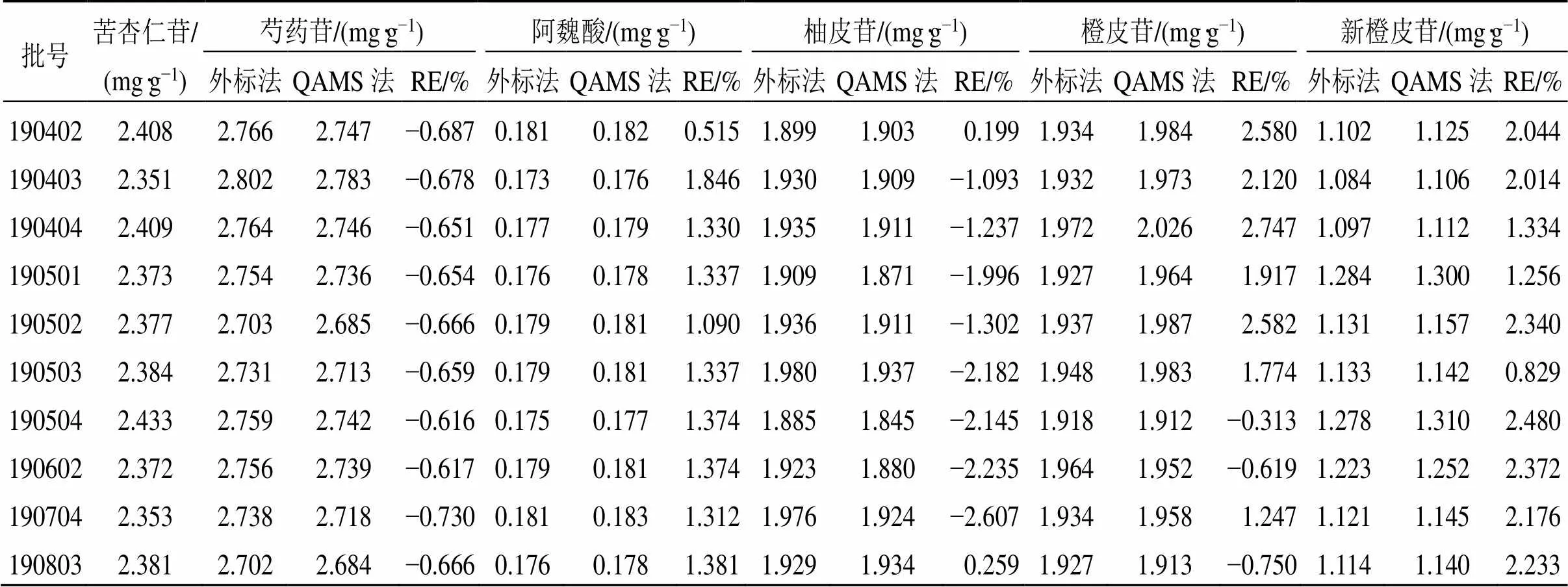
表8 QAMS法与外标法测得10批XZT中6种成分的质量浓度
3 讨论
3.1 XZT测定指标成分的选定
XZT含量测定指标及其测定方法的报道较少,而且已有的报道研究依然存在所测指标单一等问题,未见更多组分同时在XZT测定中的报道,《中国药典》2015、2020年版关于血府逐瘀制剂的质量标准中,以赤芍中的芍药苷、麸炒枳壳中的柚皮苷、桃仁中的苦杏仁苷作为含量测定的指标性成分。故本研究首次建立QAMS法结合指纹图谱技术同时测定XZT中6个组分苦杏仁苷、芍药苷、阿魏酸、柚皮苷、橙皮苷、新橙皮苷的含量,能较全面地评价其整体质量。
3.2 供试品溶液制备方法的考察
本实验考察了提取溶剂(水及30%、50%、80%、100%甲醇),结果发现选择用50%甲醇作为提取溶剂,已提取完全,且峰型较好,基线也平稳,因此综合考虑,选用50%甲醇作为提取溶剂。超声时间(10、20、30 min),结果显示20 min和30 min各共有峰峰面积无明显差异,且峰面积均高于超声10 min,说明超声20 min已经提取完全,因此超声时间定为20 min。以所测6个组分苦杏仁苷、芍药苷、橙皮苷、柚皮苷、阿魏酸、新橙皮苷的提取效率为指标,最终确定XZT供试品溶液的制备方法以50%醇作为提取溶剂、超声提取时间为20 min。
3.3 流动相筛选
本实验考察了甲醇-水溶液、乙腈-水溶液、甲醇-0.1%甲酸水溶液、乙腈-0.1%甲酸水溶液、甲醇-0.1%的磷酸水溶液、乙腈-0.1%磷酸水溶液等不同体系流动相,以XZT中所测成分柚皮苷、苦杏仁苷、芍药苷、橙皮苷、阿魏酸、新橙皮苷分离效果为指标,结果表明,乙腈-0.1%磷酸水溶液作为流动相色谱峰峰型较好,各峰之间的分离度良好,基线较平稳,最终选择乙腈-0.1%磷酸水溶液作为流动相。
3.4 内参物的选定
建立QAMS法,内参物的选定是关键,选定内参物的标准是易得、价廉、性质稳定、峰面积和保留时间稳定、供试品中的含量高[16]。苦杏仁苷在供试品溶液中具有以上优点,故本实验选定苦杏仁苷为内参物。
3.5 检测波长的选择
本实验测定的化学成分种类较多,有6种成分。因此,分别考察了210、215、254、270 nm波长下的样品谱图,通过比较分析在215 nm下的峰数目,峰形、分离度、对称因子、理论塔板数等参数,结果显示在215 nm波长下检测到的图谱出峰较多,基线平稳,峰型良好,且干扰少,故选择以215 nm作为含量分析波长。
4 结论
本研究首次建立了QAMS法结合指纹图谱技术同时测定XZT 6种成分的含量,10批样品指纹图谱中共有24个峰,相似度均大于0.990。同时采用QAMS法和外标法分别测定10批XZT 6种成分的含量,结果表明QAMS法测得的结果和外标法测得的结果无显著差异。指纹图谱与QAMS联用的方法,可客观评价药效成分复杂的复方制剂的整体质量,以期为该制剂质量控制和评价提供科学依据。
利益冲突 所有作者均声明不存在利益冲突
[1] 中国药典[S].一部.2020: 302.
[2] 李强, 翟春苗, 石占利, 等.血府逐瘀胶囊改善慢性阻塞性肺疾病高龄患者血栓前状态、炎症因子和呼吸功能及其相关性分析 [J].中草药, 2021, 52(14): 4268-4276.
[3] Yu Q, Su J, Zhu K,.The effect of Xuefu Zhuyu decoction on clopidogrel resistance and its association with the P2Y12 gene polymorphisms and promoter DNA methylation [J]., 2019, 32(6): 2565-2572.
[4] 杜元洪.血府逐瘀片预防血透患者动静脉内瘘血栓形成的临床观察 [D].恩施: 湖北民族大学, 2019.
[5] 刘佳佳.通络汤保留灌肠联合血府逐瘀片内服治疗血瘀型输卵管阻塞性不孕的临床观察 [D].太原: 山西中医药大学, 2017.
[6] 吕双宏, 王恒和.血府逐瘀汤临床应用研究进展 [J].湖南中医杂志, 2020, 36(10): 200-202.
[7] 张玲, 周慧.一测多评法在血府逐瘀丸质量评价中的应用 [J].中草药, 2018, 49(7): 1588-1593.
[8] 周燕, 薛磊冰, 金佩芬.枳壳及其制剂血府逐瘀胶囊中柚皮苷和新橙皮苷的含量测定 [J].中国现代应用药学, 2016, 33(6): 778-780.
[9] 傅春燕, 王惠余, 刘永辉, 等.基于UPLC-ESI-IT-TOF-MS方法对血府逐瘀汤中8个成分同时含量测定 [J].天然产物研究与开发, 2020, 32(6): 1006-1013.
[10] 周军, 孙艳, 张晶, 等.HPLC法测定血府逐瘀颗粒中芍药苷、阿魏酸、柚皮苷及甘草酸的含量 [J].药物分析杂志, 2009, 29(8): 1253-1255.
[11] 邬国栋, 郭叶, 李刚, 等.一测多评法同时测定蒙药古日古木-13丸中6种成分 [J].中草药, 2020, 51(6): 1542-1547.
[12] 王欣, 覃瑶, 王德江, 等.一测多评法在中药质量控制中的应用进展 [J].中成药, 2016, 38(2): 395-402.
[13] 高喜梅, 池玉梅, 张雯, 等.指纹图谱结合一测多评法评价酸橙枳实质量的研究 [J].中草药, 2020, 51(9): 2548-2556.
[14] 刘立辉.高效液相色谱法测定血府逐瘀片中赤芍所含芍药苷的含量 [J].长春中医药大学学报, 2010, 26(5): 772-773.
[15] 王智民, 高慧敏, 付雪涛, 等.“一测多评”法中药质量评价模式方法学研究 [J].中国中药杂志, 2006, 31(23): 1925-1928.
[16] 王智民, 钱忠直, 张启伟, 等.一测多评法建立的技术指南 [J].中国中药杂志, 2011, 36(6): 657-658.
Quality control of Xuefu Zhuyu Tablets based on HPLC fingerprint and quantitative analysis of multi-components by single-marker
MA Meng-ge1, YANG Sha2, TANG Zhi-shu1, 2, SONG Zhong-xing2, SHI Xin-bo2, JIA Ai-ling1, LIU Yan-ru2, MA Hu-qiang3, WANG Chang-li2, 3
1.College of Pharmacy, Changchun University of Traditional Chinese Medicine, Changchun 130117, China 2.Co-construction Collaborative Innovation Center for Chinese Medicine Resources Industrialization by Shaanxi & Ministry of Education, Shaanxi Institute of TCM Industry, Shaanxi University of Chinese Medicine, Xianyang 712046, China 3.Shaanxi Haitian PharmaceuticalCo., Ltd., Xianyang 712000, China
To establish HPLC fingerprint of Xuefu Zhuyu Tablets (血府逐瘀片, XZT) and a quantitative analysis of multi-components by single-marker (QAMS) method for the simultaneous determination of six components of amygdalin, paeoniflorin, naringin, hesperidin, ferulic acid and neohesperidin in XZT, so as to prove the scientificity and feasibility of the method in the quality analysis for XZT.The similarity evaluation software (2012A) was used to analyze the similarity of 10 batches of samples.The relative factor (s/i) of paeoniflorin, ferulic acid, naringin, hesperidin and neohesperidin were established by HPLC method with amygdalin as internal standard, which were used to calculate the content of five constituents in the samples of XZT.Meanwhile, external standard method (ESM) was used to calculate the content of six constituents.The difference between QAMS and ESM was analyzed to evaluate the accuracy of QAMS.There were 24 common peaks in the fingerprints of 10 batches of samples with the similarities of more than 0.990.Thes/iof paeoniflorin, naringin, hesperidin, ferulic acid and neohesperidin were 1.169 6, 0.172 0, 0.363 3, 0.141 3 and 0.259 2, respectively.There was no significant difference in the content determination results of 10 batches of XZT calculated by the methods of QAMS and ESM, with RE < 3.0%.The fingerprints and QAMS method are stable and controllable, which can be used for the quality control of XZT.
Xuefu Zhuyu Tablets; quantitative analysis of multi-components by single-marker (QAMS); fingerprint; amygdalin; paeoniflorin; ferulic acid; naringin; hesperidin; neohesperidin
R286.02
A
0253 - 2670(2021)22 - 6856 - 08
10.7501/j.issn.0253-2670.2021.22.010
2021-06-02
陕西省中药大品种品牌价值提升示范研究(202190025);国家农业部现代农业产业技术体系建设专项资金(CARS-21)
马梦鸽(1998—),女,硕士研究生,研究方向为中药制剂新技术与新药开发研究。Tel: 18843300105 E-mail: 1281956609@qq.com
通信作者:唐志书,男,博士,教授,主要从事中药资源开发与中药质量分析研究。Tel: (029)38185060 E-mail: tzs6565@163.com
[责任编辑 郑礼胜]
