孔板空化强化制备京尼平-壳聚糖载药纳米微球的工艺研究
2021-11-20徐云,张昆明,黄永春,陆丽金,段超,余慧群
徐云,张昆明,黄永春,陆丽金,段超,余慧群

摘 要: 以5-氟尿嘧啶(5-Fu)为模型药物,京尼平为交联剂,采用几何孔板空化强化乳化交联过程制备壳聚糖纳米微球,考察了孔板结构、入口压力、出口压力、交联温度、交联时间对空化数及其对微球平均粒径的影响,并与传统工艺进行了比较.结果表明:空化强度对微球的粒度大小存在显著影响;开孔率小,比周长大的几何孔板更有利于制备出超细粒度的纳米级微球.优化工艺参数为:单孔且孔径为3.0 mm的孔板,孔板入口压力0.28 MPa,孔板出口压力0 MPa,交联温度60 ℃,交联时间40 min,制得的微球粒度最小为292.6 nm,孔板空化强化制备的微球粒度明显小于传统工艺制备的微球粒度.红外光谱(FT-IR)结果表明,在孔板空化作用下,模型药物 5-Fu成功负载于壳聚糖微球中,且其结构未被破坏,说明孔板空化适用于强化乳化交联过程制备可负载药物的纳米级壳聚糖微球.
关键词:孔板空化;京尼平;壳聚糖微球;粒径;空化数;工艺参数;正交实验设计
中图分类号:TQ463.25 DOI:10.16375/j.cnki.cn45-1395/t.2021.04.002
0 引言
壳聚糖作为一种天然弱碱性多糖,具有良好的生物相容性、生物可降解性,且安全无毒,常被加工制备成具有一定功能用途的壳聚糖微球[1- 2].壳聚糖微球可作为一种新型药物载体,用来负载一些活性成分,如蛋白质[3]、维生素[4]、茶多酚[5]、抗癌药物[6-7]等,其制备过程已成为国内外的研究热点.目前,乳化交联过程是制备壳聚糖微球最常用的方法之一[8],此法制备过程中通常采用机械搅拌的方式,所制备的壳聚糖微球粒度较大(微米级)[9-10],且微球粒度均一性差,影响后续应用[11].然而,小粒径的纳米载药系统比大粒径微球具有更大优势,如:具有靶向性、控制药物释放和延长药效等特点[12-13].纳米微球是一种粒度尺寸小于1.0 μm 的 颗粒[14].
目前,已有采用高压膜乳化[15]、静电乳化[16]和超声乳化[17]等技术对传统乳化交联制备壳聚糖微球的过程进行改进或强化的报道,但这些技术尚存在工艺耗时长、生产效率低、能耗高等缺点[14-16].因此,开发新技术强化传统乳化交联过程对制备得到纳米级的壳聚糖微球具有重要意义.水力空化作为一种新型的过程强化技术,通常这样实现:当流体流经一个节流元件(如:几何孔板)时产生压降,当压力低于饱和蒸汽压时,液体内部会产生空化泡,空化泡在遇到周围压力增大时发生溃灭,在溃灭瞬间可产生高温(1 000 K~5 000 K)、高压(1 MPa~50 MPa)等极端环境效應,且会产生强烈的冲击波、微射流和剧烈湍动等机械效应,同时水溶液中可产生羟自由基等活化效应[18].这些效应可用于强化物理过程和化学过程[19-22].例如:Sonawane等[19]采用孔板空化制备碳酸钙纳米粒,所得纳米粒的粒径比传统机械搅拌减小了63.4%.张昆明等[20]使用文丘里管空化强化离子交联法制备壳聚糖抗菌纳米微球,所得壳聚糖微球的粒径比传统机械搅拌小21.1%以上.占叶勇等[21]使用水力空化强化大豆油脱臭馏出物酯化脱酸反应,在相同原料配比下,与机械搅拌相比,酯化率提高了12.1%.截至目前,尚未见采用孔板空化强化乳化交联过程制备壳聚糖纳米微球的研究报道.
本研究以5-氟尿嘧啶(5-Fu)为模型药物,京尼平为交联剂,采用基于几何孔板的水力空化强化乳化交联过程制备载药壳聚糖纳米微球,考察孔板结构、入口压力、出口压力、交联温度、交联时间对空化数以及微球粒径的影响规律,并和传统工艺进行比较,以期为几何孔板空化强化乳化交联过程制备壳聚糖纳米微球提供一定的理论依据.
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
壳聚糖(CS,分子量为500 kDa,脱乙酰度为90%),购自广东省深圳市中发源生物科技有限公司;京尼平(纯度[>]98%),购自广西山云生化科技股份有限公司;棕榈油,购自天津市聚龙粮油有限公司;Span 80为化学纯(CP),购自天津市科密欧化学试剂有限公司;冰醋酸、无水乙酸钠均为分析纯(AR),购自广东西陇科学股份有限公司.所有实验用水均为去离子水,电导率≤ 4.0 μS/cm.
1.1.2 主要仪器
孔板空化装置(自行研制),DF-101T集热式恒温加热磁力搅拌器(巩义市予华仪器有限责任公司),Nano-ZS90型激光纳米粒度分析仪(英国Malven公司),DZ-2AII 真空干燥箱(天津市泰斯特仪器有限公司),JXN-26 冷冻高速离心机(美国Beckman Coulter公司),UPH-IV-20T纯水/超纯水机(四川优普超纯科技有限公司).
1.2 实验方法
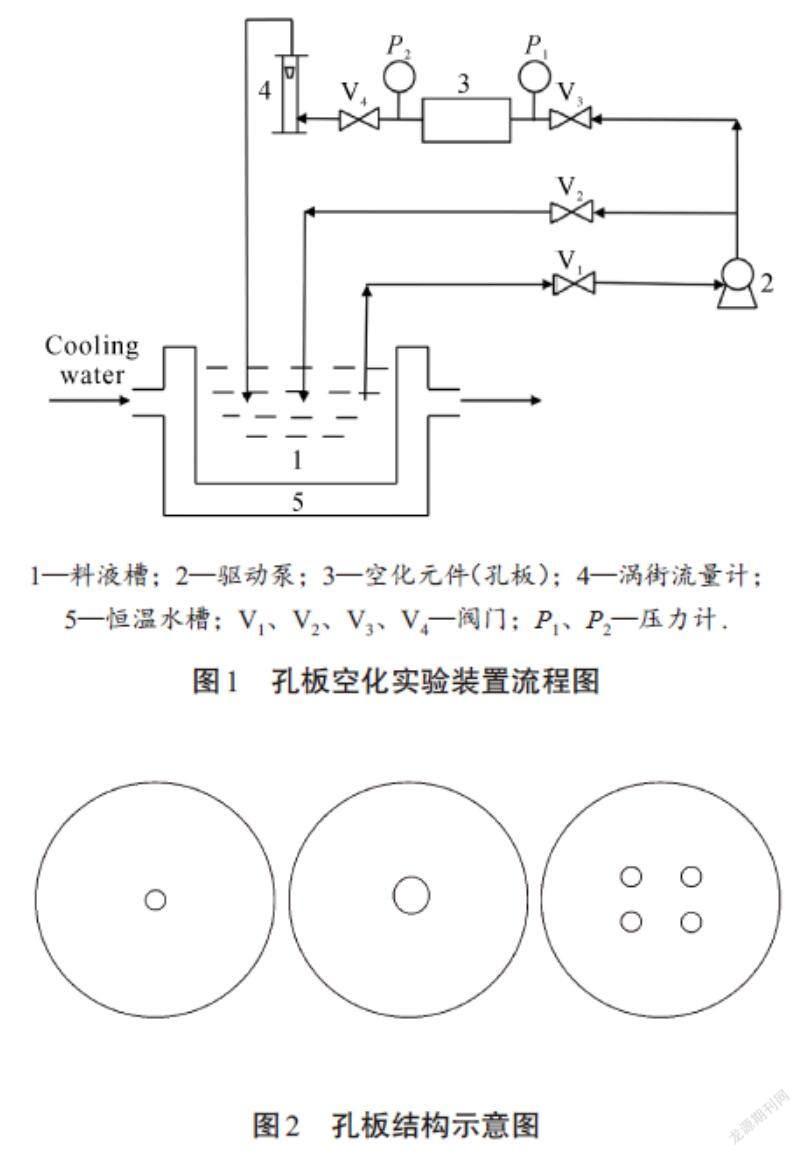
1.2.1 实验装置与流程
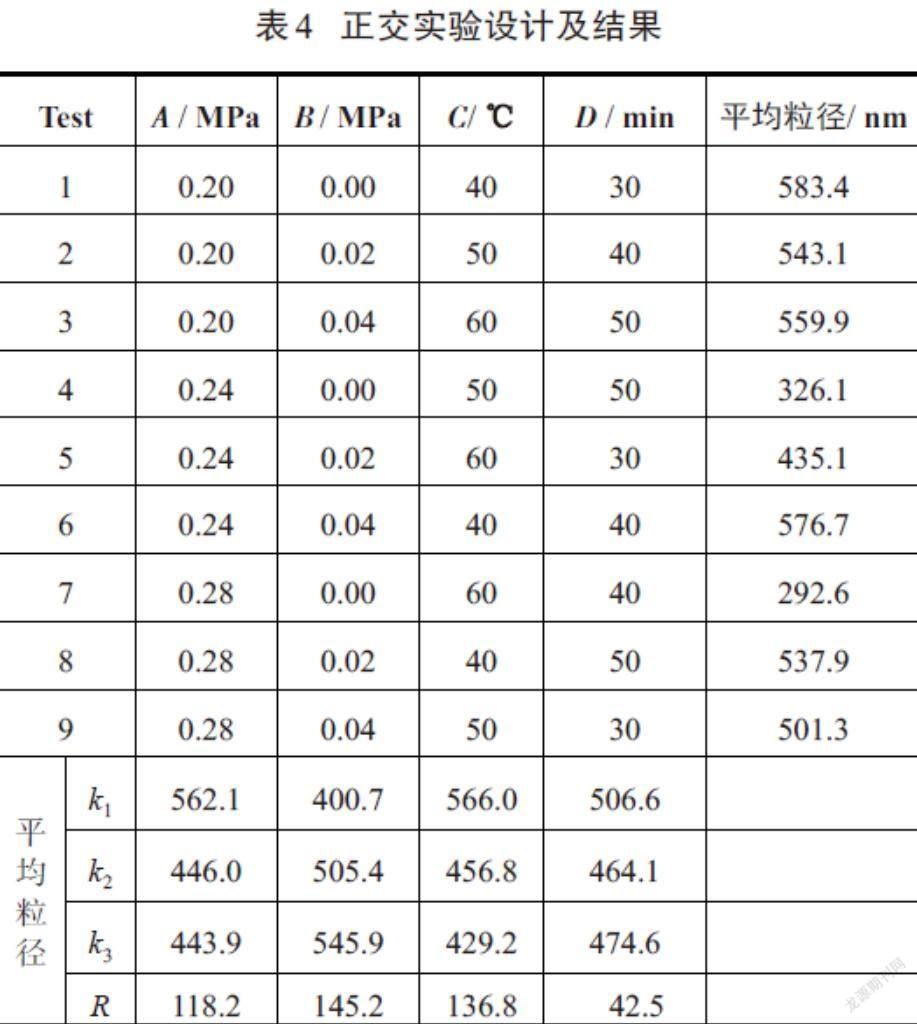
孔板空化实验装置如图1所示,孔板结构如图2所示,其结构参数如表1所示.壳聚糖纳米微球制备方法如下:1)称取适量壳聚糖溶于pH 3.6的乙酸-乙酸钠缓冲溶液中,配制成10 g/L的壳聚糖溶液;2)称取适量5-Fu溶于配制好的壳聚糖酸性溶液中;3)称取适量京尼平溶于70%乙醇中,配制成质量分数为8%的京尼平溶液;4)量取2 455 mL棕榈油(油相),加入90 mL Span-80,搅拌5 min,使其混合均匀;5)将367 mL壳聚糖酸性溶液以40 mL/min的速度加入含Span-80的油相中,边滴加边搅拌至均匀,形成负载壳聚糖的油包水型(W/O)粗乳液;6)重复上述操作,量取480 mL棕榈油,加入18 mL Span-80和72 mL京尼平溶液,搅拌均匀,形成负载京尼平的油包水(W/O)乳液;7)将上述负载壳聚糖的油包水型(W/O)粗乳液倒入孔板空化装置的料液槽中,开启驱动泵,通过调节阀门V2和V3来控制孔板入口压力(P1),调节阀门V4来控制孔板出口压力(P2),连续操作20 min,形成负载壳聚糖的油包水型(W/O)细乳液;8)以20 mL/min的速度将负载京尼平的油包水(W/O)乳液加入上述负载壳聚糖的油包水型(W/O)细乳液中,与壳聚糖进行交联固化,控制合适的交联温度与交联时间,待反应结束后,取出料液,迅速冷却至室温,进行离心;9)将离心后的沉淀用石油醚和无水乙醇进行洗涤,真空干燥,即可得到载5-Fu药物的壳聚糖纳米微球.
1—料液槽;2—驱动泵;3—空化元件(孔板);4—涡街流量计;
5—恒温水槽;V1、V2、V3、V4—阀门;P1、P2—压力计.
1.2.2 单因素实验设计
1)孔板结构对壳聚糖微球粒径以及空化数的 影响
实验保持孔板入口压力0.28 MPa,出口压力 0 MPa,交聯温度60 ℃,交联时间40 min不变,以1.2.1节所述3种孔板结构进行强化实验,探讨不同孔板结构对壳聚糖纳米微球平均粒径以及空化数的影响.
2)孔板入口压力对壳聚糖微球粒径以及空化数的影响
实验采用单孔且孔径为3 mm的孔板,保持空化出口压力0 MPa,交联温度60 ℃,交联时间 40 min不变,以孔板入口压力分别为0.12 MPa、0.16 MPa、0.20 MPa、0.24 MPa、0.28 MPa进行强化实验,探讨不同孔板入口压力对壳聚糖纳米微球平均粒径以及空化数的影响.
3)孔板出口压力对壳聚糖微球粒径以及空化数的影响
实验采用单孔且孔径为3 mm的孔板,保持孔板入口压力0.28 MPa,交联温度60 ℃,交联时间40 min不变,以孔板出口压力分别为0 MPa、0.02 MPa、0.04 MPa、0.06 MPa、0.08 MPa 进行强化实验,探讨不同空化出口压力对壳聚糖纳米微球平均粒径以及空化数的影响.
4)交联温度对壳聚糖微球粒径以及空化数的 影响
实验采用单孔且孔径为3 mm的孔板,保持孔板入口压力0.28 MPa,出口压力0 MPa,交联时间 40 min不变,以交联温度分别为30 ℃、40 ℃、50 ℃、60 ℃ 进行强化实验,探讨不同交联温度对壳聚糖纳米微球平均粒径以及空化数的影响.
5)交联时间对壳聚糖微球粒径以及空化数的 影响
实验采用单孔且孔径为3 mm的孔板,保持孔板入口压力0.28 MPa,出口压力0 MPa,交联温度60 ℃不变,以交联时间分别为30 min、40 min、50 min、60 min 进行强化实验,探讨不同交联时间对壳聚糖纳米微球平均粒径以及空化数的影响.
上述每个因素在各个水平条件下,分别平行重复实验3次,取平均值.
1.2.3 正交实验设计
在单因素实验基础上,选取孔板入口压力(A)、出口压力(B)、交联温度(C)、交联时间(D)这4个因素,以壳聚糖纳米微球的平均粒径为评价指标,按L9(34)进行正交实验,确定制备微球的优化工艺和配方.正交实验因素和水平见表2.
1.2.4 壳聚糖纳米微球的粒径表征
取适量微球,将其分散于去离子水中,取1.0 mL悬浮液于专用比色皿中,采用Nano-ZS90型激光粒度分析仪进行测量,测定微球平均粒径,每个样品测3次,取平均值.
1.2.5 傅里叶变换红外光谱(FT-IR)表征
取干燥样品1~2 mg,采用KBr压片,将压片后的样品放入仪器进行红外光谱分析,以分析5-Fu壳聚糖微粒的主要官能团.测定条件:扫描次数64次,分辨率4 cm-1,扫描波数范围4 000~500 cm-1.
1.2.6 空化数的计算
空化数([Cv])是一个无量纲参数,通常用来反映空化强度.一般来说,当空化数[<]1时,空化现象比较明显,且空化数越小,空化强度越大[23].空化数计算公式为:
[Cv=2(P2-Pv)/ρV2]
式中:[P2]表示孔板下游的恢复压强,Pa;[Pv]表示操作温度下液体的饱和蒸气压,Pa;[ρ]表示液体的密度,kg/m3;[V]表示液体通过孔板的平均流速,m/s.
1.2.7 数据处理
采用Excel 2019软件进行数据统计分析,采用Origin 9.0软件进行图表绘制.
2 结果与讨论
2.1 单因素实验结果
2.1.1 孔板结构对壳聚糖微球粒径以及空化数的影响
孔板结构对壳聚糖微球粒径以及空化数的影响见表3.由表3可知,在孔板空化作用过程中,孔板结构对所制备的微球粒径以及空化数有着重要的影响.当孔板的开孔数不同,比周长相同时,采用开孔率小的孔板,空化数更小(0.10),空化强度更大,所制备的微球平均粒径更小(292.6 nm);当孔板的开孔数不同,开孔率相同,采用比周长大的孔板,空化数更小(0.94),空化强度更大,所制备的微球平均粒径更小(741.3 nm).这一结果说明空化强度对微球的粒度大小存在显著影响,采用开孔率小、比周长大的孔板更有利于制备出粒径小的壳聚糖微球.这主要是由于在管道流量相同的情况下,根据流体连续性方程可知:开孔率小时,流经孔板孔口时的流速变大,空化数减小,空化强度增大,空化效果好[23-25];当开孔率相同时,比周长大的孔板,由于其孔径小,相同流量时通过孔板流速变大,小孔的射流会产生很强的剪切力、强大的冲击波和微射流,从而加剧了空化泡的溃灭,使其空化强度得到提高,空化效果好[23-25],因而所制备的微球粒度更小.因此,选择单孔且孔径为3.0 mm的孔板为宜.
2.1.2 孔板入口压力对壳聚糖微球粒径以及空化数的影响
孔板入口压力对壳聚糖微球平均粒径以及空化数的影响如图3所示.由图3可知,随着孔板入口压力的增大,空化数以及壳聚糖纳米微球的平均粒径均呈下降趋势.当孔板入口压力由0.12 MPa 增大至0.28 MPa时,空化数由0.44降低至0.10,这说明入口压力增大,空化强度显著增强.当孔板入口压力由0.12 MPa 增大至0.20 MPa时,微球的平均粒径由615.3 nm降低至391.9 nm,平均粒径减小了36.3%;当孔板入口压力由0.20 MPa增大至 0.28 MPa时,微球的平均粒径由391.9 nm降低至292.6 nm,平均粒径减小了25.3%.这一结果说明,当孔板入口压力较小时,增大入口压力,空化强度升高,纳米微球的粒径减小更显著.这是因为孔板入口压力增大,液体流速加快,空化数降低,空化中心压降增大,空化强度增大,从而形成更多空化泡[26];且在空化过程中空化泡膨胀的幅度变大,溃灭时产生更多能量[27],孔板下游湍流加剧,空化强度增大,碰撞更剧烈,微观混合效果增强,壳聚糖纳米微球的平均粒径减小.因此,选择入口压力0.28 MPa为宜.
2.1.3 空化出口压力对壳聚糖微球粒径以及空化数的影响
空化出口压力对壳聚糖微球平均粒径以及空化数的影响如图4所示.由图4可知,随着空化出口压力的增大,空化数以及壳聚糖纳米微球的平均粒径增大.当孔板出口压力由0 MPa增大至0.08 MPa时,空化数由0.10增大至0.55,这说明出口压力增大,空化强度减弱.当孔板出口压力由0 MPa 增大至 0.08 MPa時,壳聚糖纳米微球的平均粒径由 292.6 nm增大至446.1 nm,平均粒径增大了52.5%;当孔板入口压力由0.04 MPa增大至0.08 MPa时,壳聚糖纳米微球的平均粒径由446.1 nm增大至 871.5 nm,平均粒径增大了95.4%.这一结果表明,当孔板出口压力达到0.04 MPa后,继续增大出口压力,微球粒径增加更加显著.这主要是由于随着出口压力的增大,液体流速降低,空化数增大,空化强度减弱,微观混合效果减弱,壳聚糖微球的平均粒径增大.因此,选择出口压力0 MPa为宜.
2.1.4 交联温度对壳聚糖微球粒径以及空化数的影响
交联温度对壳聚糖微球平均粒径以及空化数的影响如图5所示.由图5可知,随着交联温度的增大,空化数以及壳聚糖纳米微球的平均粒径减小.当交联温度由30 ℃增大至50 ℃时,壳聚糖纳米微球的平均粒径由493.9 nm减小至321.9 nm,平均粒径减小了34.8%;当交联温度由50 ℃增加至60 ℃,壳聚糖纳米微球的平均粒径由321.9 nm减小至292.6 nm, 平均粒径减小了9.1%.这一结果表明,当交联温度较小时,增大温度,壳聚糖纳米微球的平均粒径减小更加显著.当交联温度由30 ℃增大至60 ℃时,空化数由0.44降低至0.10.这主要是由于温度较低不利于交联反应的进行,当升高温度至60 ℃时,交联反应加快,液体的饱和蒸气压增大,空化数减小至0.10,空化强度增大,微观混合更加均匀,壳聚糖纳米微球的平均粒径减小.当交联温度超过60 ℃时,京尼平不稳定,易分解[28].因此,选择交联温度60 ℃为宜.
2.1.5 交联时间对壳聚糖微球粒径以及空化数的影响
交联时间对壳聚糖微球平均粒径以及空化数的影响如图6所示.由图6可知,随着交联时间的增加,微球的平均粒径先减小,之后基本稳定,空化数无明显变化.当交联时间由30 min增加至40 min时,壳聚糖纳米微球的平均粒径由321.7 nm减小至292.6 nm,平均粒径减小了9%;当交联时间由 40 min增加至60 min ,壳聚糖纳米微球的平均粒径由292.6 nm减小至291.0 nm, 平均粒径几乎不变.这一结果表明,当交联时间小于40 min时,壳聚糖纳米微球的粒径减小显著,继续增加交联时间,壳聚糖纳米微球的变化趋势不明显.这可能是由于当负载京尼平的W/O乳液刚加入负载壳聚糖的W/O乳液时,二者在初始水力空化下混合不够均匀,且负载京尼平的W/O乳液的初始粒度较大,易造成局部京尼平的浓度相对过高,因而初始交联产生的微球粒度较大[29].但随着交联时间的延长,二者在水力空化的剪切作用下逐渐混合均匀,且2种乳液的粒度更小直至不变,因此,交联后得到的粒度逐渐降低,之后几乎不发生变化[29].当交联时间超过40 min,微球的平均粒径几乎不变,因此,选择交联时间40 min为宜.
2.2 孔板空化制备微球的正交实验结果
正交实验结果见表4.由表4的极差(R)分析结果可知,出口压力是影响微球平均粒径大小的关键因素.各因素对平均粒径影响的大小顺序依次为:出口压力(B)>交联温度(C)>入口压力(A)>交联时间(D).由表4的各因素水平和均值(k)可知,以平均粒径为指标优化得到壳聚糖纳米微球制备的最优工艺条件为A3B1C3D2,即孔板入口压力0.28 MPa、出口压力0 MPa、交联温度60 ℃、交联时间40 min.
2.3 孔板空化与传统工艺的制备效果比较
为了考察孔板空化强化乳化交联过程制备壳聚糖微球的效果,将基于几何孔板的水力空化制备的微球粒度与文献报道中基于传统搅拌工艺制备的微球粒度进行比较,结果见表5.由表5可知,采用单孔且孔径为3 mm的孔板,在入口压力0.28 MPa、出口压力0 MPa、交联温度60 ℃、交联时间 40 min的条件下,孔板空化强化乳化交联过程制备的壳聚糖纳米微球平均粒径为292.6 nm.罗美等[30]在搅拌转速600 r/min下,以京尼平为交联剂,所制备得到的微球粒径为34.60 μm;叶漫文等[31]在搅拌转速850 r/min下,以京尼平为交联剂,所制备得到的壳聚糖微球粒径为7.84 μm;Li等[32]以甲醛为交联剂,采用机械搅拌制备得到的壳聚糖微球粒径为43.00 μm;Nayak等[10]在搅拌转速1 000~1 500 r/min下,以戊二醛为交联剂,所制备的微球粒径为60.00 μm~210.00 μm.这说明孔板空化可强化乳化交联过程制备出纳米级的壳聚糖微球,其粒径明显小于传统搅拌工艺下所得微球的粒度.
2.4 红外光谱分析
图7为5-Fu、壳聚糖、壳聚糖微球和5-Fu壳聚糖微球在波数为4 000~5 00 cm-1的红外光谱图.由图7可见,5-Fu的特征吸收峰为1 660.6 cm-1(C═O和 C═C伸缩振动吸收峰),1 423.4 cm-1(—CF═CH—中的C—H的面内弯曲振动吸收峰),1 242.1 cm-1 (C—N伸缩振动吸收峰),875.6 cm-1(—CF═CH—中的C—H的面外弯曲振动吸收峰),813.9 cm-1和746.4 cm-1(—CF═CH—中的C—H的面外变形振动吸收峰).壳聚糖谱图中,3 429.1 cm-1处为—OH和 N—H伸缩振动重叠形成的强吸收峰, 2 921.9 cm-1和2 862.1 cm-1处为—C—H的伸缩振动吸收峰, 1 647.1 cm-1和1 589.2 cm-1处2个特征峰分别为C═O伸缩振动(酰胺Ⅰ峰)及C—N—H的面内弯曲振动(酰胺Ⅱ峰).在壳聚糖与壳聚糖微球谱图中,—OH和 N—H的重叠吸收峰产生了红移,这可能是由于壳聚糖与京尼平发生了亲核反应,在壳聚糖中增加了Schiff碱π键,—OH与π电子云产生微弱缔合,使 —OH伸缩振动峰红移,说明壳聚糖与京尼平通过席夫碱反应与亲核取代反应成功交联.5-Fu壳聚糖微球谱图中,1 448.4 cm-1处出现了5-Fu中的—CF═CH—中的C—H的面内弯曲振动吸收峰,1 249.8 cm-1处出现了5-Fu中的C—N伸缩振动红移吸收峰, 887.2 cm-1处出现了5-Fu中的—CF═CH—中的 C—H的面外弯曲振动红移的吸收峰,808.1 cm-1和756.0 cm-1处出现了5-Fu中的—CF═CH—中的C—H的面外变形振动吸收峰,且在2 927.7 cm-1处, —C—H的伸缩振动吸收峰增强.以上结果说明,在孔板空化作用下,模型药物5-Fu成功负载于壳聚糖微球中,且其结构未被破坏.
同时,在液体水力空化诱导含水(H2O)体系产生的空化效应如:热效应、机械效应和自由基 (·OH)效应等的共同作用下,一些生物大分子可发生降解作用[26,35],或其结构发生变化[36-38];苯系物在空化作用下亦会被氧化降解[39-40].例如,Huang等[35]发现水力空化效应主要通过断裂壳聚糖的 β-(1,4)糖苷键而促使其发生降解,但其结构单元和基本官能团的化学结构没有发生破坏;任仙娥等[37]发现涡流空化处理可改变大豆分离蛋白质溶解性,主要是由于在空化作用下,大豆蛋白的疏水相互作用被破坏,且分子中有离子键生成以及分子中的二硫键发生断裂;解长远等[38]也得到了相似的结论;王永杰等[41]发现文丘里管与孔板组合空化器可降解苯酚废水,主要是由于空化产生的·OH与苯酚上的苯环发生亲电加成反应,生成中间体邻苯二酚、对苯二酚,二者中的苯环继续被氧化,其共轭结构被打开,生成顺丁烯二酸和乙酸[42].然而, 5-Fu既不属于生物大分子,也不具备苯环结构,这与上述物质存在明显差异,这进一步说明其分子结构难以被水力空化作用破坏.但是,水力空化用于制备载药壳聚糖微球时,在模型药物的使用上具有选择性,不宜选择生物大分子类或苯系物类等结构较为复杂精细的药物.
3 結论
本研究采用基于几何孔板的水力空化强化乳化交联过程制备壳聚糖纳米微球,考察了孔板结构、入口压力、出口压力、交联温度、交联时间对空化数及其对纳米微球平均粒径的影响,并与传统工艺进行了比较,所得结论如下:
空化强度对微球的粒度大小存在显著影响;宜选用开孔率(βo)小,比周长(α)大的孔板;在孔板空化强化制备微球的过程中,出口压力是影响微球粒径大小的关键性因素;采用单孔且孔径为 3.0 mm的孔板,在入口压力0.28 MPa、出口压力 0 MPa、交联温度60 ℃、交联时间40 min的优化工艺条件下,所制备得到的纳米微球平均粒径最小为292.6 nm;孔板空化条件下制备的微球粒度明显小于传统工艺制备的微球粒度. FT-IR结果表明,在水力空化作用下,5-Fu结构未被破坏,且成功负载于壳聚糖纳米微球中.以上研究结果表明,孔板空化适用于强化乳化交联过程制备粒径更细的壳聚糖纳米微球.后续可对载药壳聚糖纳米微球的包封率、载药率及释药规律展开进一步研究.
参考文献
[1] CHEN M C,MI F L,LIAO Z X,et al.Recent advances in chitosan-based nanoparticles for oral delivery of macromolecules[J].Advanced Drug Delivery Reviews,2012,65(6):865-879.
[2] CASADIDIO C,PEREGRINA D V,GIGLIOBIANCO M R,et al.Chitin and chitosans:characteristics,eco-friendly processes and applications in cosmetic science[J].Marine Drugs,2019,17(6):369.
[3] YAN Q Y,WENG J Q,WU X Q,et al.Characteristics,cryoprotection evaluation and in vitro release of BSA-loaded chitosan nanoparticles[J].Marine Drugs,2020,18(6):315.
[4] CHO Y J,KIM J T,PARK H J.Size-controlled self-aggregated N-acyl chitosan nanoparticles as a vitamin C carrier[J].Carbohydrate Polymers,2012,88(3):1087-1092.
[5] LIANG J,YAN H,PULIGUNDLA P,et al.Applications of chitosan nanoparticles to enhance absorption and bioavailability of tea polyphenols:a review[J].Food Hydrocolloids,2017,69:286-292.
[6] HE T X,WANG W B,CHEN B S,et al. 5-Fluorouracil monodispersed chitosan microspheres:microfluidic chip fabrication with crosslinking,characterization,drug release and anticancer activity[J].Carbohydrate Polymers,2020,236:116094.
[7] GANGULY K,KULKARNI A R,AMINABHAVI T M.In vitro cytotoxicity and in vivo efficacy of 5-fluorouracil-loaded enteric-coated PEG-cross-linked chitosan microspheres in colorectal cancer therapy in rats[J].Drug delivery,2016,23(8):2838-2851.
[8] NASKAR S,SHARMA S,KUOTSU K.Chitosan-based nanoparticles:an overview of biomedical applications and its preparation[J].Journal of Drug Delivery Science and Technology,2019,49:66-81.
[9] AGNIHOTRI S A,MALLIKARJUNA N N,AMINABHAVI T M.Recent advances on chitosan-based micro- and nanoparticles in drug delivery[J].Journal of Controlled Release,2004,100(1):5-28.
[10] NAYAK U Y,GOPAL S,MUTALIK S,et al.Glutaraldehyde cross-linked chitosan microspheres for controlled delivery of Zidovudine[J].Journal of Microencapsulation,2009,26(3):214-222.
[11] 古永紅,王连艳,谭天伟,等.尺寸均一的壳聚糖微球的制备及其作为胰岛素控释载体的研究[J].生物工程学报,2006,22(1):150-155.
[12] GARG U,CHAUHAN S,NAGAICH U,et al.Current advances in chitosan nanoparticles based drug delivery and targeting[J].Advanced Pharmaceutical Bulletin,2019,9(2):195-204.
[13] YUE Z G,YOU Z X,YANG Q Z,et al.Molecular structure matters:PEG-b-PLA nanoparticles with hydrophilicity and deformability demonstrate their advantages for high-performance delivery of anti-cancer drugs[J].Journal of Materials Chemistry B,2013,1(26):3239-3247.
[14] LV P P,WEI W,GONG F L,et al.Preparation of uniformly sized chitosan nanospheres by a premix membrane emulsification technique[J].Industrial and Engineering Chemistry Research,2009,48(19):8819-8828.
[15] AKAMATSU K,IKEUCHI Y,NAKAO A,et al.Size-controlled and monodisperse enzyme-encapsulated chitosan microspheres developed by the SPG membrane emulsification technique[J].Journal of Colloid and Interface Science,2012,371(1):46-51.
[16] TAKAHASHI T,ITOBAYASHI N,SHONO A,et al.Chitosan nano-spheres production by electrostatic emulsification technique[J].Asia-Pacific Journal of Chemical Engineering,2012,7(S1):54-61.
[17] RIEGGER B R,B?URER B,MIRZAYEVA A,et al.A systematic approach of chitosan nanoparticle preparation via emulsion crosslinking as potential adsorbent in wastewater treatment[J].Carbohydrate Polymers,2018,180:46-54.
[18] 张昆明,陆小菊,黄永春,等.水力空化及其在生物资源领域中的应用研究进展[J].广西科技大学学报,2018,29(2):8-14.
[19] SONAWANE S H,GUMFEKAR S,KATE K,et al.Hydrodynamic cavitation-assisted synthesis of nanocalcite[J].International Journal of Chemical Engineering,2010,210:1-8.
[20] 张昆明,陆小菊,黄永春,等.文丘里管空化强化壳聚糖抗菌纳米微球的制备研究[J].保鲜与加工,2018,18(3):60-66.
[21] 占叶勇,聂勇,陆向红,等.水力空化强化大豆油脱臭馏出物酯化脱酸反应研究[J].中国油脂,2015,40(6):62-65.
[22] 刘宝彪,张昆明,黄永春,等.涡流空化强化载药壳聚糖微球制备效果初探[J].广西科技大学学报,2017,28(3):52-60.
[23] 何相君,聂勇,陆向红,等.水力空化强化制备生物柴油过程的研究[J].精细石油化工进展,2011,12(5):47-51.
[24] CARPENTER J,BADVE M,RAJORIYA S,et al. Hydrodynamic cavitation:an emerging technology for the intensification of various chemical and physical processes in a chemical process industry[J].Reviews in Chemical Engineering,2017,33(5):433-468.
[25] CHUAH L F,YUSUP S,AZIZ A R A,et al.Intensification of biodiesel synthesis from waste cooking oil(palm olein)in a hydrodynamic cavitation reactor: effect of operating parameters on methyl ester conversion[J].Chemical Engineering and Processing:Process Intensification,2015,95:235-240.
[26] WU Y,HUANG Y C,ZHOU Y,et al.Degradation of chitosan by swirling cavitation[J].Innovative Food Science and Emerging Technologies,2014,23:188-193.
[27] 黄永春,袁媛,吴宇,等.壳聚糖溶液水力空化泡动力学的数值模拟[J].现代食品科技,2014,30(5): 150-155.
[28] 唐荣华,段玮,陈波.京尼平交联磁性壳聚糖微球的制备及其脂肪酶的固定化[J].应用化学,2013,30(8):922-926.
[29] RAMISETTY K K,PANDIT A B,GOGATE P R.Novel approach of producing oil in water emulsion using hydrodynamic cavitation reactor[J].Industrial & Engineering Chemistry Research,2014,53(42):16508-16515.
[30] 罗美,尹中华,彭海龙,等.京尼平交联制备壳聚糖微球工艺优化与分析[J].食品与发酵工业,2015,41(9):97-101,107.
[31] 叶漫文,曾曙光,高文峰,等.京尼平交联的丝素蛋白-壳聚糖缓释微球的制备与表征[J].南方医科大学学报,2014,34(6):875-879.
[32] LI W Q,BA H Y,HUANG P,et al.Preparation and properties of 5-fluorouracil-loaded chitosan microspheres for the intranasal administration[J].Drug Research,2018,68(12):673-679.
[33] 叶漫文,曾曙光,高文峰,等.京尼平交联的丝素蛋白-壳聚糖微球的制备及表征[J].日用化学工业,2014,44(6):328-332.
[34] 何强芳,李国明,巫海珍,等.5-氟尿嘧啶壳聚糖微球的制备及其释药性能[J].应用化学,2004,21(2):192-196.
[35] HUANG Y C,WU Y,HUANG W C,et al.Degradation of chitosan by hydrodynamic cavitation[J].Polymer Degradation and Stability,2013,98(1):37-43.
[36] 任仙娥,楊锋,黄永春,等.基于涡流的水力空化对米渣蛋白功能性质的影响[J].食品工业科技,2014,35(14):88-90,94.
[37] 任仙娥,李春枝,杨锋,等.涡流空化改善大豆分离蛋白溶解性的分子间作用机制[J].食品科学,2020,41(3):93-98.
[38] 解长远,王中江,郭增旺,等.射流空化对大豆11S球蛋白结构和功能特性的影响[J].食品科学,2020,41(9):57-65.
[39] 王惠敏,乔慧琼,孙三祥.水力空化降解苯酚、二甲苯试验研究[J].西华大学学报(自然科学版),2010,29(3):101-104.
[40] 王西奎,邢乃军,王金刚,等.水力空化技术在有机废水处理中的应用[J].济南大学学报(自然科学版),2009,23(1):38-41.
[41] 王永杰,晉日亚,孔维甸,等.文丘里管与孔板组合降解苯酚废水研究[J].现代化工,2017,37(4): 160-163.
[42] 卢义玉,左伟芹,李晓红,等.空化水射流-双氧水处理苯酚废水的机理分析[J].重庆大学学报,2008,31(10):1164-1168,1173.
Intensified preparation of genipin-crosslinked chitosan nanospheres by orifice plate-based cavitation
XU Yun1,2,3,4, ZHANG Kunming*1,2,3,4, HUANG Yongchun1,2,3,4, LU Lijin1,2,3,4,DUAN Chao1,2,3,4, YU Huiqun1,2,3,4
(1. School of Biological and Chemical Engineering, Guangxi University of Science and Technology, Liuzhou 545006, China; 2. Guangxi Key Laboratory of Green Processing of Sugar Resources, (Guangxi University of Science and Technology), Liuzhou 545006, China; 3. Guangxi Liuzhou Luosifen Engineering Technology Research Center (Guangxi University of Science and Technology), Liuzhou 545006, China; 4.Province and Ministry Co-sponsored Collaborative Innovation Centre for Sugarcane Industry, Nanning 530004, China)
Abstract: Orifice plate-based cavitation was used to intensify the emulsion crosslinking process to prepare chitosan (CS) nanospheres with 5-fluorouracil (5-Fu) as the model drug and genipin as crosslinking agent. The effects of orifice plate structure, inlet pressure, outlet pressure, crosslinking temperature and crosslinking time on cavitation number and mean particle size of CS nanospheres were investigated, and it was compared with conventional process. The results showed that cavitation intensity had a significant effect on the particle size of CS nanoparticles; the orifice plate with small opening ratio (β0) and large proportion circumference (α) was more beneficial for the preparation of ultrafine CS nanospheres; under the optimized process parameters of orifice plate with single hole of 3.0 mm, inlet pressure at 0.28 MPa, outlet pressure at 0 MPa, crosslinking temperature at 60 ℃, and crosslinking time at 40 min, the mean particle size of CS nanospheres was 292.6 nm; the particle size of CS nanospheres prepared by orifice plate-based cavitation was obviously smaller than that prepared by traditional process; infrared spectroscopy (FTIR) results showed that 5-Fu was successfully loaded into the CS nanospheres, and the structure of 5-Fu was not destroyed by orifice plate-based cavitation, which demonstrated that the orifice plate-based cavitation was suitable to intensify the emulsion crosslinking process to prepare drug-loaded CS nanospheres.
Key words: orifice plate-based cavitation; genipin; chitosan nanospheres; particle size; cavitation number; process parameters; othogonal test design
