弓部开窗技术保留弓上分支血管的临床疗效
2021-11-20王世知邱结华曾庆福章文文徐颖奇朱仙花刘诗琛周为民
张 滕 王世知 邱结华 曾庆福 章文文 徐颖奇 朱仙花 刘诗琛 周为民
南昌大学第二附属医院血管外科,江西 南昌 330000
胸主动脉腔内修复术(thoracic endovascular aortic repair,TEVAR)是治疗胸主动脉瘤和胸主动脉夹层的重要治疗方式[1],但当病变累及升主动脉、主动脉弓或者距左锁骨下动脉(left subclavian artery,LSA)的正常近端锚定区不足时,会使手术难度明显增加[2-3],如何更好地保留弓上分支血管,减少相关并发症至关重要。传统的开放手术虽然在保留弓上分支血管方面效果良好,但存在手术创伤性大、需要依靠体外循环、深低体温停循环、手术并发症相对较大等不足[4]。微创技术及材料的发展为开展杂交手术、“烟囱”支架技术、“潜望镜”技术、开窗技术和分支支架技术拓展近端锚定区提供便利[5]。开窗技术包括机械原位开窗技术和体外预开窗技术,是保留弓上分支血管的主要手术方式,操作难度及手术风险明显低于开放手术。南昌大学第二附属医院通过弓部开窗技术对累及弓部的主动脉夹层及动脉瘤的215例患者进行治疗,取得良好的临床效果,现报道如下。
1 资料与方法
1.1 一般资料
收集2015年10月至2021年3月南昌大学第二附属医院收治的累及主动脉弓部的胸主动脉夹层及主动脉瘤患者临床资料。纳入标准:(1)胸主动脉夹层或动脉瘤累及主动脉弓的患者;(2)主动脉计算机体层血管成像(computed tomography angiography,CTA)或造影检查明确至少需重建一支弓上分支血管;(3)Stanford B 型主动脉夹层或动脉瘤近心端距LSA锚定区不足15 mm,或因解剖关系需覆盖LSA;(4)升主动脉近心端正常锚定区大于15 mm。排除标准:(1)合并严重的肝肾功能不全,不能耐受手术;(2)临床资料缺失不全;(3)主动脉夹层或主动脉瘤累及主动脉根部或冠状动脉;(4)破裂胸主动脉夹层或动脉瘤,需急诊抢救;(5)马方综合征、梅毒及大动脉炎活动期患者。根据纳入、排除标准,最终共纳入215例累及主动脉弓部的胸主动脉夹层及主动脉瘤患者,其中,男性161例,女性54例;年龄25~83岁,平均(59.0±6.0)岁。实行原位开窗手术者198例,实行体外预开窗术者17例。(表1)
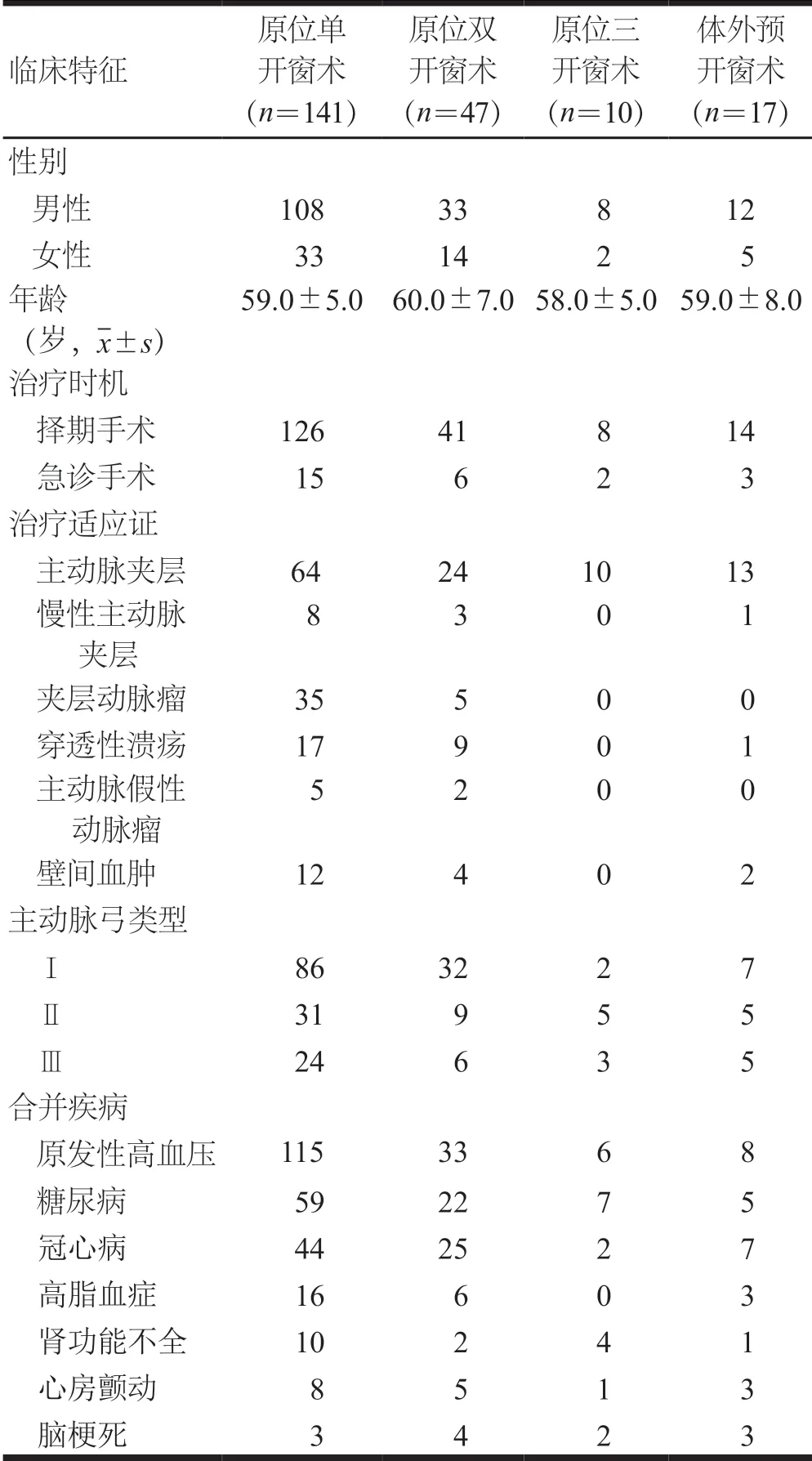
表1 215例累及主动脉弓部的胸主动脉夹层及主动 脉瘤患者基本临床特征
1.2 术前准备
所有患者均于术前经全主动脉CTA诊断为胸主动脉夹层和动脉瘤,根据CTA评估主动脉弓分型,并直接测量升主动脉至降主动脉各部分直径、累及的弓上分支血管的直径、正常锚定区长度、各分支血管间距离,根据测量结果制定科学的手术方式,并优化合理的支架选择。通过心脏彩超评估心功能的手术耐受度。对全部患者均完善术前检查,并给予控制血压、心率、止痛等处理。
1.3 手术方法
1.3.1 原位单开窗术
患者取平卧位,对双侧腹股沟区及左上肢消毒,局部麻醉下右侧股动脉穿刺预置两把ProGlide血管封合器及左侧肱动脉切开显露直视下穿刺成功后,留置血管鞘、造影导管,经造影明确病变后,根据测量结果选择最佳的支架型号,经右侧股动脉路径,于Lunderquist超硬导丝的引导下,释放主动脉覆膜支架,覆盖LSA。经左侧肱动脉路径置入10 F 550 Fustar可调弯鞘,鞘内置入2.6 F 90 cm支撑导管与打磨的V18导丝配合进行穿刺破膜(或借助穿刺针破膜),破膜成功后,依次从0.018”系统2.5~4.0 mm小球囊预扩张,然后更换0.035”系统4~12 mm大球囊并交换0.035”系统超硬导丝逐步扩张破口至满意,然后释放分支支架及后扩张。再次行造影检测,观察见支架释放良好,无内漏,血流良好。(图1)
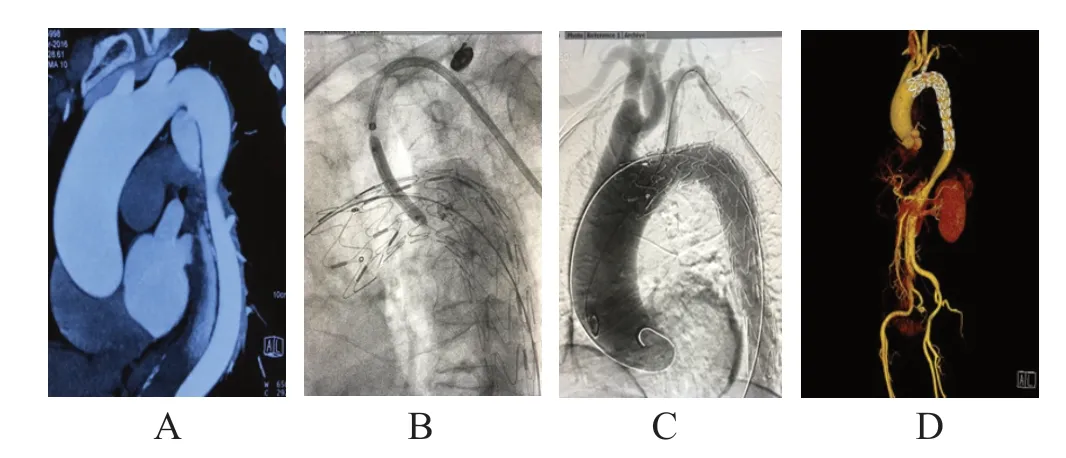
图1 原位单开窗术
1.3.2 原位双开窗术
患者取平卧位,全身麻醉后,解剖左颈总动脉5-0 Prolene无损伤线预缝荷包,左侧肱动脉切开显露直视下穿刺置入血管鞘,右侧股总动脉穿刺预置两把ProGlide血管封合器,留置血管鞘、导管。造影明确病变情况,根据测量结果选择合适的主体覆膜支架,成功释放后,经左颈总动脉内采用10 F血管鞘引入经皮经肝胆管引流(percutaneous transhepatic cholinic drainage,PTCD)穿刺针,穿刺主体覆膜支架并跟进0.035”超硬导丝,经导丝引入4 mm、6mm球囊逐级扩张主体覆膜支架,植入8 mm×40 mm覆膜支架,缝合左颈总动脉。LSA的开窗方法同原位单开窗技术。LSA分支支架加左颈总动脉原位开窗方法为将分支支架的主体和分支经准确定位后,送入主动脉弓部及LSA内,使其后移部分覆盖左颈总动脉,然后采用左颈总动脉穿刺开窗的方法开通并植入覆膜支架。(图2)
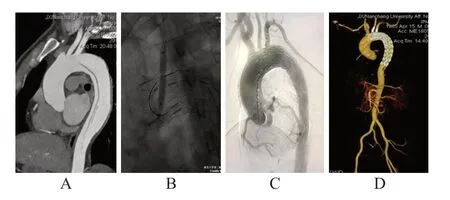
图2 原位双开窗术
1.3.3 原位三开窗术
患者取平卧位,全身麻醉成功后,监测生命体征和颅内血流,解剖游离双侧颈总动脉,近端和远端分别留置10 F血管鞘,切开双侧股总动脉和左侧肱动脉,分别留置10 F血管鞘。经左侧建立股-颈动脉体外转流通路,经造影检查明确病变后,根据测量结果选择相应直径(oversize为5%~10%)主体覆膜支架经右侧股总动脉路径至升主动脉。左前斜位(left anterior oblique,LAO)50°~60°充分展开主动脉弓,选择正常的升主动脉释放主体覆膜支架,以覆盖破口及弓上三分支。经造影检查证实假腔消失后,迅速经左颈总动脉近心端10 F鞘以PTCD穿刺针刺通主体覆膜支架并跟进Amplatz导丝,球囊续贯扩张主体支架,并植入8 mm×40 mm的覆膜支架,缝合左颈总动脉。采用同样的方法经右颈总动脉血管鞘穿刺主体覆膜支架,于头臂干内植入12 mm×40 mm的覆膜支架(分支支架oversize为0%~5%),缝合右颈总动脉。头臂干及左颈总动脉支架释放完成后,停止股颈动脉转流。LSA的开窗方法同原位单开窗术。最后,经造影检查证实主体支架位置满意,各分支支架通畅,假腔消失无内漏。(图3)

图3 原位三开窗术
1.3.4 体外预开窗术
对破口在主动脉弓小弯侧的患者行预开窗手术。患者取平卧位,双侧腹股沟区和左上肢消毒,成功穿刺右股动脉和左肱动脉后留置血管鞘。体外将主体覆膜支架半释放,使用电刀烧灼“Ց”字侧背筋旁覆膜实现开窗,使用5-0 Prolene不可吸收线缝合弹簧圈,并于开窗处覆膜旁做标记。使用两根7号慕丝线将支架回纳至输送系统中。于Lunderquist超硬导丝引导下,将覆膜支架送至预定部位,根据支架上“Ց”标记及弹簧圈定位,将预开窗口对准LSA,经LSA路径的导丝经预开窗口进入覆膜支架内,跟进导管和长鞘后,完全释放支架。经LSA路径跟进球囊扩张预开窗口至满意,释放分支支架。造影示支架释放满意,无内漏。(图4)
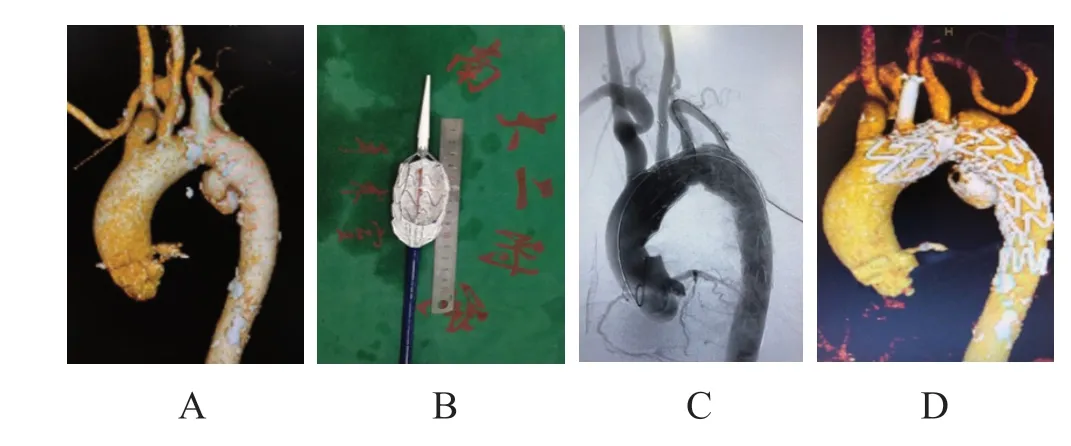
图4 体外预开窗术
1.4 随访
术后1、3、6个月及每年复查全主动脉CTA,必要时行DSA检查,用于评估支架是否移位及形态是否良好,有无内漏,开窗分支支架是否狭窄或闭塞,假腔血栓化程度,有无新发夹层或其他并发症。本研究的随访时间为获得患者最近一次CTA检查结果对应的时间。
1.5 统计学方法
采用描述性统计学方法,计量资料以(±s)表示,计数资料以n(%)表示。
2 结果
2.1 手术效果
实行机械原位开窗手术的技术成功率93.94%(186/198)。1例患者因术中出血而死亡,1例患者术后第3天,经CTA检查发现升主动脉出血,经保守治疗后好转;1例患者因术中升主动脉逆撕后转为开放手术,术后第1天死亡;6例患者术中发生即刻内漏,经弹簧圈栓塞后治愈;3例患者术后住院期间发生脑梗死,后经保守治疗后症状缓解。实行体外预开窗术的技术成功率为100%(17/17)。全部患者中,围手术期主要并发症包括入路血管损伤6例,出血2例,内漏10例,脑梗死3例,主动脉近端逆向撕裂2例,死亡2例。
2.2 手术安全性
原位单开窗术有输血患者1例。原位三开窗术有输血患者1例,其余术式无输血患者。根据手术时间、弓上分支血管阻断时间、破膜时间、出血量、输血等评估手术安全性,具体见表2。
表2 手术安全性指标(±s)
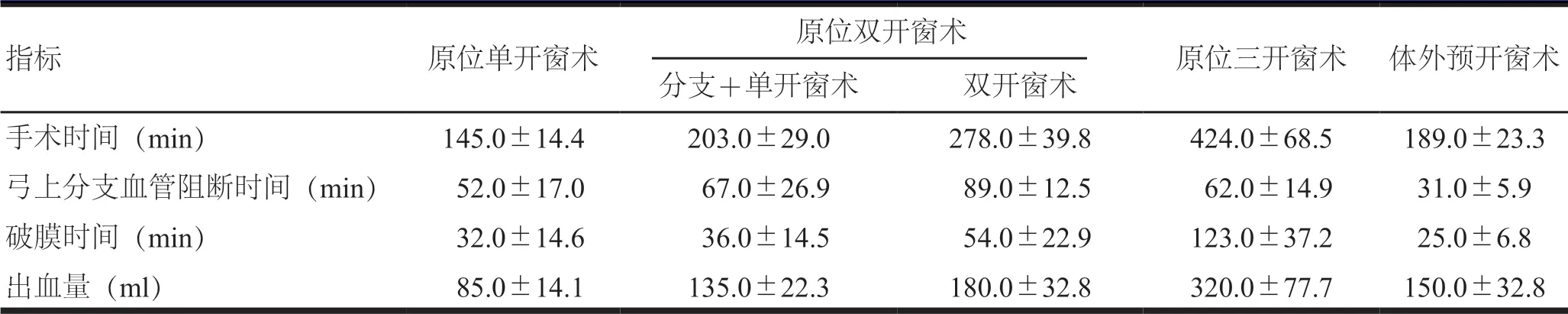
表2 手术安全性指标(±s)
指标 原位单开窗术 原位双开窗术 原位三开窗术 体外预开窗术分支+单开窗术 双开窗术手术时间(min) 145.0±14.4 203.0±29.0 278.0±39.8 424.0±68.5 189.0±23.3弓上分支血管阻断时间(min) 52.0±17.0 67.0±26.9 89.0±12.5 62.0±14.9 31.0±5.9破膜时间(min) 32.0±14.6 36.0±14.5 54.0±22.9 123.0±37.2 25.0±6.8出血量(ml) 85.0±14.1 135.0±22.3 180.0±32.8 320.0±77.7 150.0±32.8
2.3 住院相关数据
全部患者的住院时间为3~21 d,平均(6.2±2.5)d;平均住院费用(12.8±3.3)万元。
2.4 随访结果
随访截至2021年6月,失访35例患者,通过门诊、微信及电话随访3~52个月,中位随访时间为18个月。在随访的患者中,1例患者于术后2个月发生升主动脉逆撕,1例患者发生分支支架闭塞,4例患者出现内漏,2例患者经弹簧圈栓塞后治愈,2例患者的内漏自行消失。其余患者无支架移位或变形,分支支架通畅。
3 讨论
目前,TEVAR是治疗胸主动脉夹层和胸主动脉瘤的主要方式。随着微创技术和器材的发展,治疗指征越来越广泛。常规TEVAR操作简单,风险较低,效果可靠,但当正常锚定区不足15 mm或者主动脉弓扭曲、成角的情况下,常规覆盖LSA将会导致盗血综合征,进而影响大脑的血供,尤其是当左椎动脉为优势动脉时[6]。当病变累及升主动脉或弓上三分支时,常规TEVAR仍然面临着巨大挑战[7]。因此,重建及保留弓上分支血管是治疗胸主动脉夹层和动脉瘤的难点和重点。有研究提出通过开放手术保留弓上分支血管的远期效果较好,但开放手术的创伤大,短期并发症相对较多且严重[8-9]。涉及微创技术保留弓上分支血管的策略包括杂交手术、平行支架技术(包括顺行的“烟囱”技术和逆行的“潜望镜”技术)、开窗技术(包括体外预开窗技术和原位开窗技术)、分支型支架技术。相对于其他技术,开窗技术具有独特的优势,包括创伤较小、内漏发生率低、分支支架狭窄闭塞的发生率低、能够更好地保留原本的血流动力学特点等[10]。
本研究中,2例患者发生出血;1例患者为LSA原位开窗穿刺后出现的升主动脉出血,为打磨的、锐利的V18导丝刺破,经保守治疗后好转;1例患者为原位三开窗穿刺时损伤头臂干出血,虽然经覆膜平行支架技术覆盖,但终因血压过低导致心脏骤停而死亡。若V18导丝穿刺破膜,需从多角度、多层次确定穿刺方向和深度,并且与10 F的Fustar可调弯血管55 cm长鞘配合,避免造成血管损伤等并发症,本研究采用V18导丝打磨结合Fustar及2.6 F 90 cm支撑导管配合进行穿刺破膜,可提高技术成功率,减少出血。围手术期,3例患者出现脑梗死,考虑为开窗时靶血管斑块脱落、空气栓塞和覆膜支架被扩张时小碎片脱落所致,未发生大面积脑梗死,经保守治疗均缓解。因此,于术前行头颈部CTA或血管彩超检查具有重要意义,且能够尽量缩短开窗时间,操作仔细,必要时使用脑保护装置。本研究出现逆撕的2例患者中,1例患者因术中分支支架植入及退出受阻,反复拉扯而导致近端升主动脉发生逆撕,经开放手术仍未能挽救生命;另1例患者为逆撕型Stanford A型主动脉夹层,经保守治疗2个月后,待升主动脉血肿基本吸收后再行机械原位双开窗术,但术后2个月后仍出现近端逆撕而形成新发夹层。夹层逆撕是TEVAR中的严重并发症之一[11],术前需全面评估主动脉弓的形态及分型、弓上三分支间的距离、主动脉弓的扭曲变形情况、需开窗的分支血管的钙化情况及优化支架的选择等。本研究中,10例患者出现不同程度的内漏,主要为Ⅰ型内漏,考虑可能主动脉弓扭曲严重致血管与支架不能完全贴合、oversize过小及形成“鸟嘴现象”、术中术者操作致支架移位等有关,经假腔弹簧圈栓塞术得以解决。
开窗技术因可以保持原有的血流动力学特征,并且具有创伤小、费用少和并发症发生率相对低的优势而被临床广泛应用,但其操作技术要求高,需要经验丰富的医师对患者进行综合评估[12]。体外预开窗技术可根据需重建的分支情况行单开窗术、双开窗术或三开窗术,术中需将预开窗点精准定位分支开口;原位开窗术可最大程度地保留原有的血流动力学特征,但操作难度相对较大,且当分支血管与主动脉弓的角度小于30°时,不易刺破支架覆膜[13]。对于拟行开窗技术的患者,术前需完善全主动脉CTA和颈动脉彩超检查,充分评估主动脉弓的分型和形态、弓上分支血管累及程度及管腔通畅情况,从而确定选择何种手术方式(体内原位开窗术或体外预开窗术)。术中造影明确主体支架置入位置及支架大小,主动脉夹层患者的oversize一般比宿主血管内径放大5%~10%,主动脉瘤患者可放大至20%,分支血管内支架的oversize为0%~5%即可,这样可避免近端Ⅰ型内漏的发生;根据血管形态选择柔韧性适中的覆膜支架,可减少“鸟嘴现象”的发生[14]。术中需多角度投影,明确主动脉弓与分支血管位置及角度的关系,进一步明确穿刺的位点、角度及深度;成功刺破膜后,需从小球囊开始,逐步置换大球囊扩张穿刺点[15]。
综上所述,当胸主动脉夹层或动脉瘤累及主动脉弓时,可采用多种开窗技术,从而更好地保留和重建弓上分支血管,不但能拓展TEVAR的手术指征,而且具有费用低、成功率高、并发症少、中近期效果良好的优势,临床应用价值高,其远期效果则需进一步随访。
