Wnt信号通路在新生血管性眼病中的研究进展
2021-11-19杨俊楠包秀丽
杨俊楠 包秀丽
【摘要】Wnt信号通路作为一条调控细胞增殖、分化和凋亡等活动的信号通路,参与生物血管系统的多种生理和病理过程,在血管发生和新生血管生成方面的研究最为深入。Wnt信号分子是血管形态发生中的关键调控因子,其信号成分的缺失或突变会导致多种新生血管性眼病,如角膜新生血管性眼病、视网膜新生血管性眼病和脉络膜新生血管性眼病。近年来,随着新生血管性眼病的发病率和致盲率逐年上升,新生血管性眼病逐渐得到学者们的重视,深入研究调控新生血管性眼病的Wnt信号通路,对研发新药物和新技术十分重要。该文就Wnt信号通路在眼部病理性血管发生中的作用机制作一综述。
【关键词】Wnt信号通路;新生血管性眼病;Norrin;β-连环蛋白
Research progress on Wnt signaling pathway in neovascular eye diseases Yang Junnan, Bao Xiuli. College of Postgraduate, Inner Mongolia Medical University, Hohhot 010100, China
Corresponding author, Bao Xiuli, E-mail: ophbaxili@hotmail.com
【Abstract】As a signaling pathway that regulates cell proliferation, differentiation and apoptosis, Wnt signaling pathway participates in multiple physiological and pathological processes in the biological vascular system, especially in the angiogenesis and neovascularization. Wnt signaling molecules are the key regulatory factors in vascular morphogenesis, of which the loss-of-function mutations may be involved in neovascular eye diseases, such as corneal, retinal and choroidal neovascular eye diseases. Recently, the incidence and blindness rates of neovascular eye diseases have increased year by year, which have gradually attracted widespread attention from scholars. In-depth research on the Wnt signaling pathway that regulates neovascular eye diseases plays a significant role in the development of new drugs and technologies. This article reviews the mechanism underlying the function of Wnt signaling pathway in ocular pathological angiogenesis.
【Key words】Wnt signaling pathway; Neovascular eye diseases; Norrin; β-catenin
眼部血管的正常发育有赖于血管生成因子和抑制因子之间的动态平衡,当发生缺血缺氧、炎症等情况时,这种平衡被打破就会导致眼部血管发育异常和新生血管生成。新生血管的生成是众多致盲性眼病的共同病理改变,眼部血管系统的发育和分化涉及多因素和多通路的共同调节,Wnt信号通路在其中承担着重要作用。本文将Wnt信号通路在眼部血管发育和新生血管性眼病發生发展中的研究进展进行阐述,以期进一步了解新生血管性眼病的发病机制,并为相关疾病的诊疗提供新思路。
一、Wnt与Wnt信号通路
Wnt是由果蝇的Wingless基因和小鼠的Int1基因组合而成的一类分泌型糖蛋白,可参与调控细胞增殖、分化及凋亡等过程,并能影响血管生成和重塑[1]。根据下游是否受β-catenin的控制,Wnt信号通路主要分为3种:经典Wnt信号通路、Wnt/c-Jun氨基末端激酶(JNK)和Wnt/Ca2+非经典信号通路。
1.Wnt信号通路
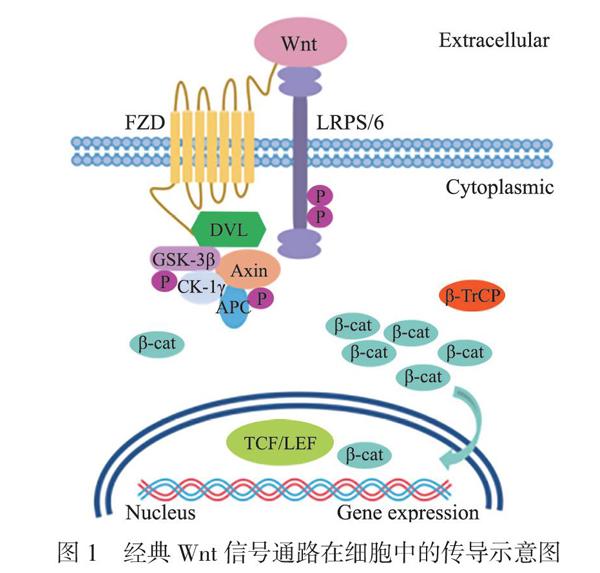
经典Wnt信号通路处于激活状态时,Wnt蛋白与卷曲蛋白(FZD)和LDL受体相关蛋白5/6(LRP5/6)结合,引起蓬乱蛋白(DVL)磷酸化,导致由轴蛋白(Axin)、糖原合酶激酶3β(GSK-3β)、结肠癌抑制因子(APC)、酪蛋白激酶-1γ(CK-1γ) 组成的分解复合物失活。β-catenin在细胞核内与淋巴增强因子和T淋巴细胞因子结合,激活靶基因的表达,作用机制见图1[2-3]。
非经典Wnt信号通路主要有2条:一条为Wnt/JNK信号通路,Wnt蛋白与FZD受体结合激活JNK,进而调控靶基因的转录;另一条为Wnt/Ca2+信号通路,在磷脂酶C介导下,Wnt蛋白与FZD受体结合促使内质网释放Ca2+,激活Ca2+依赖的蛋白激酶Ⅱ调节细胞活动[4]。目前已证实的Wnt信号通路下游靶基因超过100个,包括血管内皮生长因子(VEGF)、E-cadherin和Cyclin D1等,这充分体现了经典Wnt信号通路在生物发育和疾病发生等过程中具有广泛调节作用。
2. Norrin蛋白
Norrin是一种由Norrie病假性神经胶质瘤(NDP)基因编码,Müller胶质细胞产生的分泌型蛋白质,可作为一个特殊的Wnt配体与FZD4结合调节视网膜血管的发生[5]。Norrin可与FZD4、LRP5和四次跨膜蛋白12(TSPAN12)受体结合形成复合物,通过经典Wnt信号通路发挥调控作用。Zhang等[6]发现,Norrin通过诱导FZD4泛素化,TSPAN12作为辅助受体驱使Norrin受体复合体进入溶酶体,发挥其促血管生成作用。LRP5基因缺陷型(LRP5-/-)小鼠表现出视网膜初级血管的延迟出现以及病理性新生血管的生成,这与紧密连接蛋白claudin5的显著下调有关,可见阻断claudin5可抑制新生血管的生成。NDP基因缺陷型(NDPy/-)小鼠的视网膜内血管发育不足导致视网膜缺血缺氧,从而导致酪氨酸激酶受体1、受体2和血小板衍生生长因子-B减少,而HIF-1α和VEGF-A增加,视网膜新生血管(RNV)形成[7]。由此可见,Norrin/FZD4/LRP5/TSPAN12通路在调控视网膜血管生成中发挥重要的调控作用。
3.Wnt信号通路与血管生成
血管发育受多种信号通路精密调控,Wnt信号通路是关键调控系统之一。众多Wnt配体参与调控血管内皮细胞的功能发生和稳态维持,例如Wnt1可增加毛细血管的稳定性、促进细胞的体外增殖,Wnt3a和Wnt5a可诱导细胞的增殖、分化和迁移等过程,Wnt7a和Wnt7b在玻璃体血管退化中介导细胞凋亡。VEGF在胚胎发育起始阶段调控血管生成和血管通透性,病理情况下起着刺激血管内皮细胞增殖和诱导新生血管生成的作用。Wnt信号通路是VEGF的主要调节剂,通过与VEGF中经典Wnt信号通路的TCF位点结合发挥作用,且β-catenin/ TCF复合物还可介导IL-8和基质金属蛋白酶的转录,共同参与调节血管生成[8]。可见,Wnt信号通路是血管生成的重要调节因素,其缺失或突变会影响血管生成。
二、Wnt信号通路与新生血管性眼病
Wnt信号通路在眼的发育、成熟和病变中起着重要作用,当其下游的不同基因如配体Norrin或受体FZD4、LRP5和TSPAN12等突变时,均会引起眼部血管发育异常这一共同的病理特征,这些突变基因有望成为防治新生血管性眼病的潜在靶点。
1.角膜新生血管性眼病
生理情况下,角膜维持其无血管特性得益于血管生成因子与抑制因子之间的动态平衡。发生缺氧、感染、炎症及创伤等病理情况时,角膜新生血管便会形成。在小鼠碱烧伤诱导的角膜新生血管模型中发现,LRP6和β-catenin呈现高表达状态,LRP6通过与极低密度脂蛋白受体结合形成异源二聚体,导致Wnt信号激活和角膜新生血管生成[9]。据研究,过表达的Pax6会导致角膜上皮分化障碍和新生血管形成,Wnt7a可通过下调Pax6的表达来抑制新生血管生成[10]。研究提示,通过应用丝氨酸蛋白酶抑制剂SERPINA3K、姜黄素等均可降低β-catenin的表达水平,抑制角膜新生血管的生成[11]。由此可见,Wnt信号在角膜新生血管的形成中起着关键作用,抑制Wnt信号通路的异常激活可为角膜新生血管性疾病提供新的治疗理念。
2.视网膜新生血管性眼病
2.1 Norrie病
Norrie病是一种X连锁隐性遗传病,又称先天性X连锁智力迟钝盲聋病,主要是由于NDP基因突变导致Wnt信号通路失活所致。其病理学改变为周边视网膜血管发育缺陷、深层血管缺失和玻璃体血管持续存在,眼部表现为白内障、角膜混浊、RNV、视网膜脱离(RD)、玻璃体积血和假性神经胶质瘤等[12]。由于环境、遗传等因素不同,部分患者除眼部症状外,还表现出精神障碍、智力低下、神经性耳聋和性腺机能减退等症状。研究表明,Norrin可以通过特异性结合FZD4来激活经典Wnt信号通路[5]。当Norrin缺陷时,经典Wnt信号通路激活受阻,随之阻碍了视网膜血管的正常发育以及玻璃体血管的退化,导致RNV形成。可见,Wnt信号通路在Norrie病的发生中起着重要作用。
2.2 家族性渗出性玻璃体视网膜病变(FEVR)
FEVR是一种遗传致盲性眼病,病理特征为周边视网膜血管发育异常导致视网膜缺血缺氧,引起RNV形成、血管渗漏以及RD[13]。其临床表现与Norrie病相似,但具有遗传多态性。NDP、FZD4、LRP5和TSPAN12基因与FEVR发生密切相关,约占FEVR病因的50%,均通过Norrin激活經典Wnt信号通路。不同的遗传模式与不同的基因突变有关,涉及FZD4、LRP5和TSPAN12等基因的突变常表现为常染色体显性遗传,LRP5和TSPAN12基因的突变表现为常染色体隐性遗传,而NDP基因的突变表现为X连锁隐性遗传[14]。这些基因的蛋白质产物均可激活Wnt信号通路,因此Wnt信号通路异常会阻碍眼部血管的正常发育。
2.3骨质疏松-假性神经胶质瘤综合征(OPPG)
OPPG因生理表型类似于视网膜神经胶质瘤而得名,被认为是FEVR的一种特殊亚型,为常染色体隐性遗传病。临床表现为视力障碍和骨质疏松,眼部检查可见视网膜毛细血管扩张、渗出和微动脉瘤,骨质疏松症表现为包括脊椎在内的多处骨折和颅骨软化,部分患者还存在认知障碍。据报道,OPPG是由于LRP5突变引起Wnt信号通路受到抑制所致[15]。在LRP5-/-小鼠模型中可见,LRP5是Norrin/FZD4/β-catenin介导的RNV形成中的关键共受体,其突变会导致OPPG的发生[16]。这些研究充分表明,Wnt信号通路在调节视网膜血管生成方面发挥着不可或缺的作用。
2.4 Coats病
Coats病也是一种与Wnt信号相关的新生血管性眼病,又称外层渗出性视网膜病变。病理特征为视网膜毛细血管扩张、微动脉瘤、视网膜下脂质渗出、视网膜血管发育缺陷最终引起RD。近期,有学者发现FZD4的缺失突变以常染色体隐性遗传方式导致Coats病。Wu等[17]发现,RCBTB1作为FZD4/LRP5信号通路的下游分子呈现低表达状态时,可阻碍Norrin-Wnt信号中的β-catenin的核内蓄积,导致视网膜血管发育异常。上述表明Wnt信号通路与Coats病的发生密切相关,这些突变基因可成为该疾病新的治疗靶点。
2.5早产儿视网膜病变(ROP)
ROP的发生始于早产后的高氧环境导致视网膜血管和神经元的发育受阻(Ⅰ期),随着组织缺血缺氧以及新陈代谢需求的增加驱动RNV增殖(Ⅱ期)[18]。感染、高氧、早产和低出生体质量儿等都是ROP的危险因素,高氧是其重要危险因素之一。眼内暂时的高氧环境导致VEGF和促红细胞生成素表达受到抑制,早期发生血管退化和神经元凋亡[19]。随着视网膜发育和代谢需求的增加诱导VEGF高表达,导致RNV生成、渗漏、玻璃体内机化和RD。在氧诱导视网膜病变模型中发现,异位表达于晶状体或视网膜色素上皮的Norrin可通过激活经典Wnt信号通路上调血管生成素-2的表达,沉默血管生成素-2可能减少ROP的发生[20]。此外,通过降低Wnt配体、受体(FZD4和LRP5)以及β-catenin的表达,也可减少ROP中的病理性新生血管。可见,通过抑制Wnt信号通路中的信号分子可以阻断ROP的发生,为其治疗提供可靠的药物靶点。
2.6糖尿病性视网膜病变(DR)
DR是一种在高血糖状态下发生的胰岛素及细胞代谢改变引起血管内皮和血-视网膜屏障受损,导致视网膜血管渗漏、出血和机化膜形成。病变早期表现为非增殖性DR,以微血管瘤、出血点、渗出等为特征,晚期可出现RNV、玻璃体积血和纤维血管膜等增殖性改变。不少研究证实,Wnt信号与DR的发生发展密切相关。DR患者视网膜中的β-catenin和LRP5/6表达上调,敲除β-catenin可以阻断Müller细胞中的Wnt信号通路,使VEGF和TNF-α的表达下调从而抑制视网膜新生血管的产生[21]。此外,在DR患者的血浆和玻璃体液中Dickkopf-1(DKK-1)水平降低,导致其改善视网膜炎症、减少血管渗漏和抑制RNV的作用减弱[22]。除了DKK-1,还有Kallistatin和Mab2F1等Wnt信号抑制剂可在DR中发挥抗新生血管的作用[23]。总之,这些与Wnt信号相关的DR新生血管发生机制进一步证实了Wnt信号在DR发生中扮演着重要角色。
3.脉络膜新生血管性眼病
年龄相关性黄斑变性(AMD)是目前研究较广泛的與Wnt信号相关的脉络膜新生血管性眼病,分为干性和湿性。湿性AMD主要特征为视网膜血管瘤样增生,脉络膜新生血管生成并侵入视网膜下发生渗漏导致RD,故又称为新生血管性AMD(nAMD)。在众多调控nAMD发生的因素中,异常激活的经典Wnt信号通路是一个关键调控因素。nAMD患者的视网膜中Cyclin1、c-Myc、Axin2和VEGF等Wnt信号靶基因表达水平增高,加入Wnt信号通路抑制剂可延缓其发生[24]。研究表明,nAMD患者中Wnt信号表达增加,归因于LRP6表达上调和血管生成抑制因子Kallistatin、DKK-1血浆浓度降低[25]。由此可见,使用抗LRP6抗体或DKK-1等Wnt信号通路抑制剂可阻断经典Wnt信号转导,进而发挥对nAMD的防治作用。
三、展 望
眼部血管的正常发育是多因素、多通路交叉作用的结果,经典Wnt信号通路在其中发挥着不可或缺的作用。该通路的异常激活将会影响眼部血管的正常发育,为众多新生血管性眼病提供血管基础。目前,虽然临床上存在一些治疗新生血管性眼病的方法,但疗效不持久且具有诸多的并发症和潜在风险,探索更优化的治疗方法仍是迫切需要的。鉴于Wnt信号是一个血管生成的重要调节因子,在今后的研究中仍需要进一步阐明其在新生血管性眼病发生发展中的详细机制,从而为新生血管性眼病提供有效的防治思路。
参 考 文 献
[1] Nusse R, Brown A, Papkoff J, Scambler P, Shackleford G, McMahon A, Moon R, Varmus H. A new nomenclature for int-1 and related genes: the Wnt gene family. Cell, 1991, 64(2):231.
[2] Nusse R, Clevers H. Wnt/β-Catenin signaling, disease, and emerging therapeutic modalities. Cell, 2017, 169(6):985-999.
[3] Kretzschmar K, Clevers H. Wnt/β-catenin signaling in adult mammalian epithelial stem cells. Dev Biol, 2017, 428(2):273-282.
[4] Tran F H, Zheng J J. Modulating the wnt signaling pathway with small molecules. Protein Sci, 2017, 26(4):650-661.
[5] El-Sehemy A, Selvadurai H, Ortin-Martinez A, Pokrajac N, Mamatjan Y, Tachibana N, Rowland K, Lee L, Park N, Aldape K, Dirks P, Wallace V A. Norrin mediates tumor-promoting and -suppressive effects in glioblastoma via Notch and Wnt. J Clin Invest, 2020, 130(6):3069-3086.
[6] Zhang C, Lai M B, Khandan L, Lee L A, Chen Z, Junge H J. Norrin-induced Frizzled4 endocytosis and endo-lysosomal trafficking control retinal angiogenesis and barrier function. Nat Commun, 2017, 8:16050.
[7] Luhmann U F, Lin J, Acar N, Lammel S, Feil S, Grimm C, Seeliger M W, Hammes H P, Berger W. Role of the Norrie disease pseudoglioma gene in sprouting angiogenesis during development of the retinal vasculature. Invest Ophthalmol Vis Sci, 2005, 46(9):3372-3382.
[8] Easwaran V, Lee S H, Inge L, Guo L, Goldbeck C, Garrett E, Wiesmann M, Garcia P D, Fuller J H, Chan V, Randazzo F, Gundel R, Warren R S, Escobedo J, Aukerman S L, Taylor R N, Fantl W J. beta-Catenin regulates vascular endothelial growth factor expression in colon cancer. Cancer Res, 2003, 63(12):3145-3153.
[9] Wang Z, Cheng R, Lee K, Tyagi P, Ding L, Kompella U B, Chen J, Xu X, Ma J X. Nanoparticle-mediated expression of a Wnt pathway inhibitor ameliorates ocular neovascularization. Arterioscler Thromb Vasc Biol, 2015, 35(4):855-864.
[10] Ouyang H, Xue Y, Lin Y, Zhang X, Xi L, Patel S, Cai H, Luo J, Zhang M, Zhang M, Yang Y, Li G, Li H, Jiang W, Yeh E, Lin J, Pei M, Zhu J, Cao G, Zhang L, Yu B, Chen S, Fu X D, Liu Y, Zhang K. WNT7A and PAX6 define corneal epithelium homeostasis and pathogenesis. Nature, 2014, 511(7509):358-361.
[11] Zhou T, Chen L, Huang C H, Lin Z, Zong R, Zhu C, Pan F, Ma J X, Liu Z G, Zhou Y. Serine proteinase inhibitor SERPINA3K suppresses corneal neovascularization via inhibiting Wnt signaling and VEGF. Invest Ophthalmol Vis Sci, 2014, IOVS-14-14023.
[12] Lin M, Lu Y, Sui Y, Ni X, Li H, Chen X, Zhao N, Jiang M. A novel c.287G > T NDP missense mutation in a Chinese family with Norrie disease. Ophthalmic Genet, 2020, 41(4):338-340.
[13] 王司儀,孙方格,刘早霞.家族性渗出性玻璃体视网膜病变合并视网膜脱离一例. 新医学, 2017, 48(12): 900-903.
[14] Tauqeer Z, Yonekawa Y. Familial exudative vitreoretinopathy: pathophysiology, diagnosis, and management. Asia Pac J Ophthalmol (Phila), 2018, 7(3):176-182.
[15] Alonso N, Soares D C, V McCloskey E, Summers G D, Ralston S H, Gregson C L. Atypical femoral fracture in osteoporosis pseudoglioma syndrome associated with two novel compound heterozygous mutations in LRP5. J Bone Miner Res, 2015, 30(4):615-620.
[16] Huang W, Li Q, Amiry-Moghaddam M, Hokama M, Sardi S H, Nagao M, Warman M L, Olsen B R. Critical endothelial regulation by LRP5 during retinal vascular development. PLoS One, 2016, 11(3):e0152833.
[17] Wu J H, Liu J H, Ko Y C, Wang C T, Chung Y C, Chu K C, Liu T T, Chao H M, Jiang Y J, Chen S J, Chung M Y. Haploinsufficiency of RCBTB1 is associated with Coats disease and familial exudative vitreoretinopathy. Hum Mol Genet, 2016, 25(8):1637-1647.
[18] Bashinsky A L. Retinopathy of prematurity. N C Med J, 2017, 78(2):124-128.
[19] Chen J, Connor K M, Aderman C M, Smith L E. Erythropoietin deficiency decreases vascular stability in mice. J Clin Invest, 2008, 118(2):526-533.
[20] Ohlmann A, Seitz R, Braunger B, Seitz D, B?sl M R, Tamm E R. Norrin promotes vascular regrowth after oxygen-induced retinal vessel loss and suppresses retinopathy in mice. J Neurosci, 2010, 30(1):183-193.
[21] Zhou K K, Benyajati S, Le Y, Cheng R, Zhang W, Ma J X. Interruption of Wnt signaling in Müller cells ameliorates ischemia-induced retinal neovascularization. PLoS One, 2014, 9(10):e108454.
[22] Qiu F, He J, Zhou Y, Bai X, Wu G, Wang X, Liu Z, Chen Y, Ma J X, Liu Z. Plasma and vitreous fluid levels of Dickkopf-1 in patients with diabetic retinopathy. Eye (Lond), 2014, 28(4):402-409.
[23] Hombrebueno J R, Ali I H A, Ma J X, Chen M, Xu H. Antagonising Wnt/β-catenin signalling ameliorates lens-capsulotomy-induced retinal degeneration in a mouse model of diabetes. Diabetologia, 2018, 61(11):2433-2446.
[24] Tuo J, Wang Y, Cheng R, Li Y, Chen M, Qiu F, Qian H, Shen D, Penalva R, Xu H, Ma J X, Chan C C. Wnt signaling in age-related macular degeneration: human macular tissue and mouse model. J Transl Med, 2015, 13:330.
[25] Chen Y, Hu Y, Lu K, Flannery J G, Ma J X. Very low density lipoprotein receptor, a negative regulator of the wnt signaling pathway and choroidal neovascularization. J Biol Chem, 2007, 282(47):34420-34428.
(收稿日期:2021-03-30)
(本文編辑:郑巧兰)
