蔓荆子黄素对结直肠癌细胞增殖、周期和凋亡的影响及其可能的调控机制▲
2021-11-19张东姣赵彦焕樊丽伟汪景坤付晓霞赵玉红
张东姣 赵彦焕 樊丽伟 汪景坤 李 洵 付晓霞 张 磊 赵玉红
(中国人民解放军陆军第八十二集团军医院消化内科,河北省保定市 071000,电子邮箱:it300u@163.com)
目前,结直肠癌发病率位居全球第三,死亡率位居全球第二,其对人类生活健康造成严重威胁[1]。由于起病隐匿,早期临床症状不明显,大多数结直肠癌患者确诊时已经处于中晚期,有50%~60%患者的肿瘤已经发生转移,因此预后不理想[2-3]。当前,临床上主要采用以手术切除为主、术后放疗和化疗为辅的综合手段治疗结直肠癌[4-5],虽然其可使得部分患者在提高5年生存率上获益,但是复发、耐药性等问题导致这一综合手段的治疗效果不甚理想,因此寻找安全有效的治疗方法迫在眉睫。蔓荆子是马鞭草科植物蔓荆的成熟干燥果实,具有清利头目、疏散风热等功效,常用于治疗风热感冒、头昏头痛、耳鸣等症状[6]。蔓荆子黄素又称为紫花牡荆素,是蔓荆子黄酮类化合物的有效成分之一,具有抗炎、抗菌和抗肿瘤等药理活性[7]。许刚等[8]发现,蔓荆子黄素可以明显抑制p53突变型肺癌细胞的增殖,但是其对结直肠癌细胞的作用及作用机制尚不清楚。泛素样修饰物激活酶2(ubiquitin-like modifier-activating enzyme 2,UBA2)与肿瘤的发生密切相关,研究表明UBA2在结直肠癌组织中高表达,UBA2高表达与晚期结直肠癌和不良预后有关,而下调UBA2表达可抑制结直肠癌细胞的增殖,并促进细胞凋亡[9]。本研究以体外培养的人结直肠癌细胞SW480为研究对象,探讨蔓荆子黄素对结直肠癌细增殖、周期和凋亡的影响,以及其作用机制是否与UBA2有关。
1 材料与方法
1.1 细胞与主要试剂 结直肠癌细胞SW480购于中国科学院上海细胞库;胎牛血清、杜氏改良依格尔培养基(Dulbecco′s modified Eagle medium,DMEM)购于美国Gibco公司(批号分别为10270-106、A4192101);蔓荆子黄素购于南京植佰萃生物公司(批号:479-91-4);LipofectamineTM2000转染试剂盒、TRIzol试剂盒购买于美国Invitrogen公司(批号分别为11614、10196035);阴性对照小干扰RNA(small interfering RNA,siRNA)、UBA2 siRNA、空载质粒载体vector和UBA2过表达质粒载体购于广州锐博生物公司;四甲基偶氮唑盐(methyl thiazolyl tetrazolium,MTT)试剂盒、细胞周期试剂盒、膜联蛋白-V(Annexin Ⅴ)-异硫氰酸荧光素(fluorescein isothiocyanate,FITC)/碘化丙啶(propidium iodide,PI)双染试剂盒购于碧云天生物公司(批号分别为ST316、C1052、C1051M);蛋白裂解液购于北京百奥莱博科技(批号:HR0273-SJL);二喹啉甲酸购于北京索莱宝(批号:PC0015);UBA2抗体、p21抗体、c-myc抗体、B细胞淋巴瘤-2(B-cell lymphoma-2,Bcl-2)蛋白抗体、Bcl-2相关X蛋白(Bcl-2 associated X protein,Bax)抗体、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)抗体购于美国Abcam公司(批号分别为ab185932、ab109310、ab32053、ab32115、ab32428、ab8199);兔抗人IgG抗体二抗购于北京百奥莱博科技有限公司(批号:F020158-ZRY);反转录试剂盒、荧光定量试剂盒购买于购自日本TaKaRa公司(批号分别为RR026A、DRR380A);引物购于上海吉玛公司。
1.2 细胞培养与分组 将SW480细胞复苏后,置于含有10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素的DMEM培养基中,在37℃、5% CO2条件下的恒温培养箱内培养,然后加入胰酶消化,细胞融合至85%时进行传代培养。取对数生长期的SW480细胞制备细胞悬液,调整细胞密度为2×105个/mL,接种至24孔板内,待细胞生长密度至75%时,每孔内加入不同浓度(0、10、20、40 μmol/L)的蔓荆子黄素,在37℃、5% CO2条件下继续培养24 h,作为不同浓度的蔓荆子黄素组。其中,将0 μmol/L和40 μmol/L蔓荆子黄素作为对照组和蔓荆子黄素组,用于检测UBA2 的mRNA和蛋白表达。
另取对数期生长期的SW480细胞,按照LipofectamineTM2000转染试剂盒说明书将阴性对照siRNA、UBA2 siRNA转染至SW480细胞内,6 h后更换培养液,在37℃、5% CO2条件下继续培养24 h,分别记为si-NC组、si-UBA2组;将空载质粒载体和UBA2过表达质粒载体转染SW480细胞6 h后,加入40 μmol/L蔓荆子黄素处理24 h,分别记为蔓荆子黄素+vector组和蔓荆子黄素+UBA2组。
1.3 MTT法检测细胞活力 取各组SW480细胞制备细胞悬液,调整细胞浓度(5×104个/mL)后以100 μL/孔接种至96孔板内,在37℃、5% CO2条件下培养48 h后,每孔依次加入10 μL的MTT试剂,继续培养4 h后,除去培养液,再加入150 μL的二甲基亚砜,待结晶完全溶解后,应用Varioskan LUX 多功能酶标仪(Thermo Fisher公司)检测各孔在490 nm波长处的吸光度值。实验设置3个复孔,重复3次。计算细胞活力,细胞活力=实验组吸光度值/对照组吸光度值×100%。
1.4 流式细胞术检测细胞周期和凋亡 (1)细胞周期:取相应组别SW480细胞,按照3×105个/孔的细胞密度接种于6孔板内,在37℃、5% CO2条件下继续培养24 h后,进行消化、离心(12 000 r/min、15 min),使用磷酸缓冲盐溶液清洗细胞,采用预冷70 %乙醇溶液4℃固定过夜。磷酸缓冲盐溶液清洗2遍,每孔加入10 μL的1 μg/L RNA酶孵育30 min,然后加入10 μL的1 mg/L PI溶液,混匀避光反应,使用Attune NxT流式细胞仪(Thermo Fisher公司)检测细胞周期情况。(2)细胞凋亡:取相应组别SW480细胞,以每孔3×105个接种于6孔板内,在37℃、5% CO2条件下培养24 h,然后12 000 r/min离心15 min,加入结合缓冲液重悬细胞。然后按照Annexin V-FITC/PI双染试剂盒说明书,加入5 μL Annexin V-FITC和10 μL PI,混匀,避光反应15 min,使用流式细胞仪检测细胞凋亡情况。
1.5 蛋白质印迹法检测UBA2、p21、c-myc、Bax、Bcl-2蛋白表达 取相应组别SW480细胞,加入蛋白裂解液提取各组细胞总蛋白,加入二喹啉甲酸检测蛋白浓度,高温变性后,在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳上样处理后,将分离的蛋白凝胶转移在聚偏氟乙烯膜上。脱脂奶粉封闭培养2 h,4℃下加入一抗蛋白(稀释比例为1 ∶600),孵育过夜,室温下加入二抗孵育(稀释比例为1 ∶2000),加电化学发光显色剂显影、曝光。采用Image J软件分析蛋白条带灰度值,以GAPDH作为内参分析目的蛋白相对表达水平。实验设置3个复孔,重复3次。
1.6 实时荧光定量PCR检测UBA2 mRNA的表达 取相应组别SW480细胞,参照TRIzol试剂盒说明书提取细胞总RNA,采用紫外分光光度计检测RNA浓度和纯度。采用反转录试剂盒合成cDNA模板,然后以GAPDH为内参,进行PCR扩增,反应体系包括10 μL SYBR-Green,正、反引物各1 μL,2.0 μL cDNA和无菌蒸馏水6.0μL;反应条件为95℃ 3 min,95℃ 10 s,60℃ 30 s,70℃ 30 s,共40个循环。然后按照2-ΔΔCt法计算得出UBA2 mRNA的相对表达水平。UBA2正向引物:5′-TGGACCGCCATGAGCATGAA-3′,反向引物:5′-AGCCTGGAACAAGGCTTTATTTGT-3′;β-肌动蛋白(β-actin)正向引物:5′-GCTCACCATGGATGATGATATCGC-3′,反向引物:5′-TAGGAATCCTTCTGACCCATGCC-3′。
1.7 统计学分析 使用SPSS 22.0软件进行统计分析。计量资料以(x±s)表示,两组间比较采用t检验,多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05表示差异具有统计学意义。
2 结 果
2.1 不同浓度的蔓荆子黄素对SW480细胞增殖和细胞周期的影响 与0 μmol/L组相比,其他组的细胞活力、S期细胞比例和c-myc蛋白表达均降低,G0/G1期细胞比例和p21蛋白表达均增加(均P<0.05)。10 μmol/L组、20 μmol/L组、40 μmol/L组的细胞活力、S期细胞比例和c-myc蛋白表达均依次降低,G0/G1期细胞比例和p21蛋白表达均依次增加(均P<0.05)。蔓荆子黄素作用细胞48 h,对细胞生长的半数抑制浓度为35.7 μmol/L。见表1和图1。

表1 不同浓度蔓荆子黄素组细胞活力、细胞周期及其相关蛋白相对表达水平的比较(x±s)

图1 不同浓度蔓荆子黄素对SW480细胞周期的影响
2.2 不同浓度的蔓荆子黄素对SW480细胞凋亡的影响 与0 μmol/L组相比,其他组的细胞凋亡率和Bax蛋白相对表达水平均增加(P<0.05),Bcl-2蛋白相对表达水平均降低(均P<0.05);10 μmol/L组、20 μmol/L组、40 μmol/L组的细胞凋亡率和Bax蛋白相对表达水平依次增加,Bcl-2蛋白相对表达水平依次降低(均P<0.05)。见表2和图2。40 μmol/L的蔓荆子黄素作用效果最佳,结合半数抑制浓度,故选择蔓荆子黄素浓度为40 μmol/L进行后续实验。

表2 不同浓度蔓荆子黄素组细胞凋亡率和凋亡相关蛋白相对表达水平的比较(x±s)

图2 不同浓度蔓荆子黄素对SW480细胞凋亡的影响
2.3 蔓荆子黄素对SW480细胞中UBA2表达的影响 与对照组相比,蔓荆子黄素组的UBA2 mRNA和蛋白相对表达水平均降低(均P<0.05),见表3和图3。
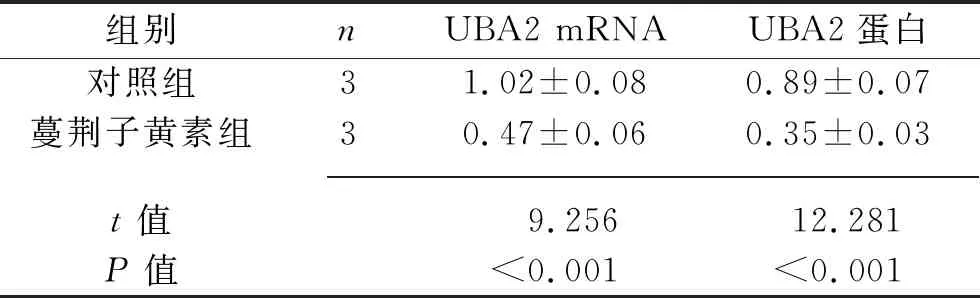
表3 两组SW480细胞中UBA2 mRNA和蛋白相对表达水平的比较(x±s)

图3 两组SW480细胞中UBA2蛋白的表达
2.4 抑制UBA2对SW480细胞增殖和细胞周期的影响 si-UBA2组的UBA2蛋白相对表达水平低于si-NC组(P<0.05),提示转染成功。与si-NC组相比,si-UBA2组的细胞活力、S期细胞比例和c-myc蛋白相对表达水平降低(P<0.05),G0/G1期细胞比例和p21蛋白相对表达水平增加(均P<0.05)。见表4和图4。

表4 抑制UBA2后SW480细胞的活力、细胞周期及相关蛋白相对表达水平(x±s)

图4 抑制UBA2对SW480细胞周期和UBA2蛋白表达的影响
2.5 抑制UBA2对SW480细胞凋亡的影响 与si-NC组相比,si-UBA2组的细胞凋亡率、Bax蛋白相对表达水平增加,Bcl-2蛋白相对表达水平降低(均P<0.05)。见表5和图5。

表5 抑制UBA2后SW480细胞的凋亡率和凋亡相关蛋白相对表达水平(x±s)

图5 抑制UBA2对SW480细胞凋亡的影响
2.6 蔓荆子黄素可能通过调控UBA2对SW480细胞增殖、凋亡和周期的影响 与蔓荆子黄素+vector组相比,蔓荆子黄素+UBA2组的UBA2蛋白相对表达水平、细胞活力、S期细胞比例、c-myc蛋白和Bcl-2蛋白相对表达水平增加,而G0/G1期细胞比例、p21蛋白相对表达水平、细胞凋亡率和Bax蛋白相对表达水平降低(均P<0.05)。见表6、表7和图6。
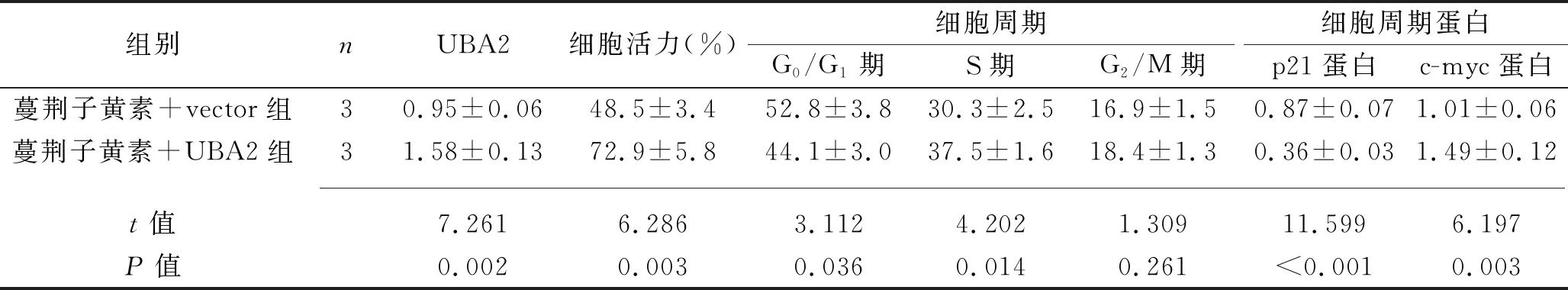
表6 两组SW480细胞的活力、细胞周期及相关蛋白相对表达水平(x±s)

表7 两组SW480细胞凋亡率及凋亡相关蛋白相对表达水平的比较(x±s)

图6 两组SW480细胞的增殖、凋亡、周期及相关蛋白的表达情况
3 讨 论
结直肠癌发病率和病死率逐年升高,其发病机制较为复杂,受家族遗传、环境和饮食方式等因素的影响[9-10]。蔓荆子是中国传统的天然医药,含有丰富的化学成分,如黄酮类、萜类、甾体类、蒽醌类等,其抗肿瘤效果明显,而蔓荆子黄素是黄酮类化合物的成分之一,是抗肿瘤的有效活性成分[11]。研究显示,蔓荆子黄素通过下调β-连环蛋白的表达,抑制口腔鳞状细胞癌细胞的增殖和转移[12];并可通过c-Jun氨基端激酶信号通路抑制食管癌细胞的增殖,并诱导其细胞凋亡[13];其还可以抑制垂体瘤细胞的增殖和诱导其细胞凋亡[14];此外,其可以通过下调周期蛋白依赖性激酶1、c-myc和survivin蛋白表达,抑制非小细胞肺癌的增殖和促进其凋亡,阻滞细胞周期[15]。p21是近年发现的与细胞周期有关的蛋白抑制基因,对细胞生长有重要作用;而c-myc是一种多功能调节基因,可使细胞进行无限增殖,促进细胞增殖及分化[16-17]。因此本研究选择p21和c-myc作为细胞周期相关蛋白进行检测。结果提示,蔓荆子黄素可降低SW480细胞的活力、S期细胞比例,增加细胞凋亡率、G0/G1期细胞比例,上调p21、Bax蛋白表达,并下调c-myc、Bcl-2蛋白表达,这说明蔓荆子黄素能抑制结直肠癌细胞增殖和诱导其凋亡,并阻滞细胞周期,具有明显的抗肿瘤作用。
小泛素样修饰因子1(small ubiquitin-like modifier 1,SUMO)蛋白家族是广泛存在于真核生物的一类高度保守因子,而UBA2是SUMO激活酶的关键因子,在肿瘤细胞中异常表达进而参与肿瘤的发生和发展[16]。UBA2位于人19号染色体q13.11上,在胃癌、肺癌、乳腺癌和结直肠癌等均有表达,与肿瘤的临床特征和不良预后显著相关[17]。有研究表明,UBA2在非小细胞肺癌组织中过表达,其异常表达与肿瘤大小、TNM分期和淋巴结转移显著相关,敲除UBA2可以明显抑制非小细胞肺癌细胞的增殖,阻滞细胞周期,并诱导其细胞凋亡[18]。同时,UBA2在乳腺癌细胞中也呈高表达,莫能菌素通过下调UBA2的表达抑制乳腺癌细胞的增殖和转移,促进其细胞凋亡[19]。此外,有学者发现,下调UBA2的表达可通过下调Wnt/β-catenin信号通路而抑制结直肠癌细胞的增殖和转移[20];敲除UBA2可通过上调p53和p21蛋白的表达从而抑制结直肠癌细胞的增殖并诱导其细胞凋亡[21]。本研究结果显示,经蔓荆子黄素干预后,SW480细胞中的UBA2 mRNA和蛋白表达均下调,由此我们推测UBA2的表达可能与蔓荆子黄素对SW480细胞增殖、周期和凋亡的影响有关。因此,我们进一步将si-UBA2转染至SW480细胞,发现与si-NC组相比,si-UBA2组的细胞活力、S期细胞比例、c-myc蛋白和Bcl-2蛋白相对表达水平降低(P<0.05),细胞凋亡率、G0/G1期细胞比例、p21蛋白和Bax蛋白相对表达水平增加(均P<0.05),这表明抑制UBA2表达可以明显抑制结直肠癌细胞SW480的增殖,并促进其细胞凋亡,使细胞周期阻滞,这与上述研究结果相似。随后,我们再将过表达UBA2的质粒载体转染SW480细胞以上调细胞中的UBA2表达,再给予蔓荆子黄素处理,发现SW480细胞活力、S期细胞比例增加,细胞凋亡率、G0/G1期细胞比例降低,p21、Bax蛋白相对表达水平下调,c-myc、Bcl-2蛋白相对表达水平上调,这说明蔓荆子黄素可能通过调控UBA2表达发挥在结直肠癌细胞中的抗肿瘤作用。
综上所述,蔓荆子黄素可能通过下调UBA2表达,抑制结直肠癌细胞的增殖,使细胞周期阻滞,并诱导其细胞凋亡。本研究中,未设立不加蔓荆子黄素、未进行转染处理的空白对照组,以及不加蔓荆子黄素但是转染了UBA2过表达质粒载体的SW480细胞组,因此所得结论仍需进一步实验加以证实。蔓荆子黄素为结直肠癌的干预研究提供了新的方向,但是目前的研究只局限于体外实验,体内实验研究相对较少,需要深入研究以探讨其应用价值。
