纳米氧化锌对水稻种子发芽和幼苗生长的影响
2021-11-18殷小冬诸俊顾大路杨文飞杜小凤文廷刚孙爱侠钱新民施洪泉贾艳艳
殷小冬 诸俊 顾大路 杨文飞 杜小凤 文廷刚 孙爱侠 钱新民 施洪泉 贾艳艳

摘要:采用室内水培法研究不同粒径、不同质量浓度纳米氧化锌(ZnO NPs)对水稻种子发芽和幼苗生物量的影响。结果表明,在500 mg/L质量浓度下,Zn2+和不同粒径ZnO NPs处理的水稻种子发芽率均在93%以上,与空白对照之间无显著差异;水稻幼苗的生物量生长受到抑制,地上部鲜质量减少幅度为14.29%~33.48%,根鲜质量减少幅度为35.81%~57.29%,根鲜质量均显著低于空白对照,Zn2+处理的地上部鲜质量、根鲜质量较低。由此可见,Zn2+比ZnO NPs对水稻幼苗生长具有更强的毒性。在不同质量浓度下,10 mg/L ZnO NPs处理的水稻苗长、根长分别提高了10.56%、32.26%,在100~500 mg/L ZnO NPs处理下,水稻根长、苗长分别下降了10.73%~16.83%、27.89%~4592%,且质量浓度越高,抑制作用越强。ZnO NPs对水稻根部的抑制作用大于苗部,ZnO NPs的粒径和质量浓度对水稻种子发芽无显著影响,低质量浓度能促进水稻幼苗的生长,而高质量浓度则会产生抑制作用。
关键词:纳米氧化锌;粒径;水稻;种子发芽;幼苗生长
中图分类号:S511.01文献标志码:A文章编号:1002-1302(2021)19-0101-06
金属纳米颗粒(metal nanoparticles,MNPs)是一类极其重要的纳米材料,兼具金属材料和纳米材料的双重属性[1]。作为占居全球产量前5名(TOP5)的MNPs代表之一,氧化锌纳米颗粒(ZnO NPs)被广泛应用于橡胶、化妆品、纺织、抗菌剂和涂料等行业[2]。仅在个人护理用品方面,全球市场上含有ZnO NPs的皮肤护理产品产量约为1万t/年,其中25%的此类纳米颗粒将直接被释放到环境中[3]。
近年来,纳米颗粒在农业中的应用越来越多。研究显示,部分MNPs具有为生物提供可利用的必需金属元素的潜力,可作为肥料用作化肥,也可作为农药使用。例如,叶面喷施ZnO NPs可以显著提高小麦籽粒中锌元素的含量[4];在小麦幼苗期施用CuO NPs、ZnO NPs能够刺激小麦根毛增殖和侧根形成,增加根系对氮、磷等养分的吸收[5];在干旱胁迫条件下,ZnO NPs通过增加小麦叶绿素含量,减轻干旱对小麦的负面影响[6];CuO NPs的应用则显著促进了玉米的生长和籽粒的产量[7]。绿豆在施用TiO2 NPs后,根系土壤磷酸酶、植酸酶活性显著增加,绿豆的叶蛋白、叶綠素含量等物候学指标也得以改善[8]。MNPs对作物的环境毒性效应也有较多报道。室内研究发现,ZnO NPs能够产生活性氧(ROS),从而诱发氧化应激反应,使得荞麦幼苗的根系表皮细胞受损,生物量显著下降[9]。Yang等研究发现,ZnO NPs、CuO NPs的植物毒性作用为浓度依赖性,在2 000 mg/L质量浓度下显著抑制了玉米、水稻根系的伸长[10]。2 000 mg/L CeO2 NPs处理能够降低小麦叶绿素含量,将开花延迟1周,并减小胚乳中淀粉粒的大小和胚泡数量[11]。由此可见,MNPs对作物的影响并不统一。MNP的生物效应需要结合纳米颗粒的种类、浓度、粒径与植物种类、栽培条件,以明确不同纳米颗粒在不同环境下对植物种子萌发和植株生长产生的影响。
本试验选用ZnO NPs这一典型MNP材料作为研究对象,以水稻作为试验植物,通过室内培养皿培养和水培方法研究不同质量浓度、不同粒径ZnO NPs对水稻种子发芽和幼苗生长的影响,以探究ZnO NPs对农田作物的毒性效应,研究结果将为MNPs的合理农用及其环境健康风险的科学评估提供科学依据。
1材料与方法
1.1供试材料
试验所用ZnO NPs购自阿拉丁试剂(上海)有限公司(含量≥99.5%),pH值为6~8;ZnSO4纯度≥99.8%,购自国药集团化学试剂有限公司。所用水稻品种为南粳9108,由江苏天丰种业有限公司提供。
1.2试验设计与方法
室内试验于2020年11月2日在江苏徐淮地区淮阴农业科学研究所中心实验室进行。试验共设置粒径、浓度2个因素。在粒径试验中,ZnO NPs共设置30、90、200 nm 3种粒径水平,以不添加纳米颗粒作为空白对照,以ZnSO4溶液作为锌离子对照,所有处理的质量浓度均为500 mg/L,共设5个处理,分别为无纳米颗粒对照处理(CK)、30 nm粒径ZnO NPs处理(30-500)、90 nm粒径ZnO NPs处理(90-500)、200 nm粒径ZnO NPs处理(200-500)及锌离子对照处理(Zn2+)。在浓度试验中,选取粒径为30 nm的ZnO NPs,设置10、100、500 mg/L 3个浓度水平(分别标记为30-10、30-100、30-500),以不添加纳米颗粒作为空白对照,共设4个处理,分别为无纳米颗粒对照处理(0)、10 mg/L ZnO NPs处理(30-10)、100 mg/L ZnO NPs处理(30-100)以及500 mg/L ZnO NPs处理(30-500)。所有处理均设置3次重复。
试验挑选颗粒饱满、品相良好的水稻种子,用30%过氧化氢溶液消毒8 min后用超纯水浸泡并冲洗5次。选取100粒种子,均匀分布在直径为 100 mm、高15 mm、垫有滤纸的培养皿中。在培养皿中分别添加上述各处理分散液。纳米颗粒溶液使用前经超声波振荡30 min以保证颗粒充分分散开。在每个培养皿中加入4 mL处理液,每种处理方法重复3次,将各个培养皿放入光照恒温培养箱中于25 ℃进行培养。试验开始后每24 h观察1次并记录种子萌发数,以胚根突破种皮 2 mm作为种子发芽的标志,连续7 d没有新的种子发芽视为试验结束。按照国家标准计算种子的发芽率和发芽指数。
种子萌发7 d后,从各处理培养皿中挑选健壮、长势一致的幼苗移栽至相应水培箱中,在温室中继续培养14 d,培养期间每3 d更换1次营养液。取样,测定水稻幼苗根长、苗长、鲜质量,计算根冠鲜质量比、苗长和根长抑制率。
1.3测定项目与方法
水稻种子发芽率、发芽势、发芽指数及活力指数的计算公式如下:
发芽率(GR)=发芽种子数/供试种子数 ×100%;
发芽势(GV)=达到发芽高峰期的种子数/供试种子数×100%;
发芽指数(GI)=∑(Gt/Dt)。式中:Gt为时间t内的发芽种子数(个);Dt为相应的发芽时间(d)。
活力指数(VI)=S×GI。式中:S為幼苗根长(cm),GI为发芽指数。
抑制率(IR)=(A-B)/A×100%。式中:A为空白对照的苗长或根长;B为其他处理的苗长或根长。
水稻幼苗的根长、苗长使用卷尺测定,地上生物量及地下生物量用称质量法测定。所用溶液和化学试剂均为国药集团化学试剂有限公司生产的分析纯产品。
1.4数据分析
试验数据采用SPSS 19.0软件进行统计分析,在0.05水平下Tukeys HSD检验各处理平均值之间的差异显著性。
2结果与分析
2.1不同粒径ZnO NPs处理对水稻种子萌发的影响
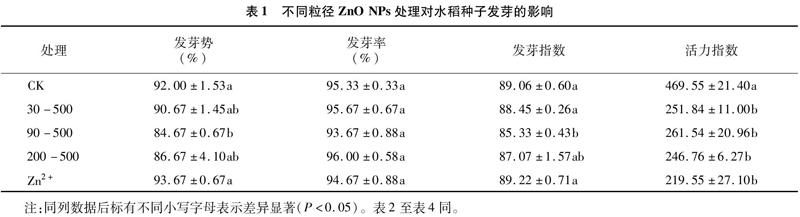
2.1.1不同粒径ZnO NPs处理对水稻种子发芽的影响发芽势可以反映种子的发芽速率和整齐度,发芽指数也是反映种子发芽速度的重要指标[12]。从表1可以看出,与对照相比,ZnO NPs处理的发芽势、活力指数均低于对照,对水稻种子的发芽速度具有一定的抑制作用,当粒径达到90 nm时,抑制作用明显。Zn2+处理可以提高种子发芽势,并且其发芽势高于对照处理,显著高于ZnO NPs处理。所有处理的种子发芽率间无显著差异,均在93%以上,其中200-500处理的发芽率最高,为96.00%。活力指数是种子发芽速率和生长量的综合反映。ZnO NPs、Zn2+处理的活力指数均显著低于CK,可见种子胚根长度发育受到了明显抑制。
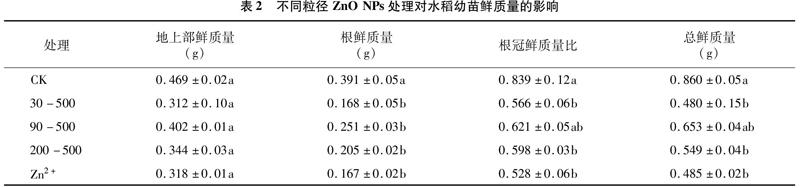
2.1.2不同粒径ZnO NPs处理对水稻幼苗生物量的影响生物量能够直观表现出ZnO NPs对水稻的影响, 由表2可知, ZnO NPs、 Zn2+处理对水稻地上部鲜质量、根鲜质量的影响均呈现不同程度的抑制作用。ZnO NPs、Zn2+处理的地上部鲜质量、根鲜质量均低于对照,地上部鲜质量的减少幅度为1429%~33.48%,但与对照相比无显著差异;根鲜质量的减少幅度为35.81%~57.29%,根鲜质量均显著低于对照,Zn2+处理的地上部鲜质量、根鲜质量较低。ZnO NPs、Zn2+处理的根冠鲜质量比明显低于CK,说明两者显著影响了根系的发育。总体来看,ZnO NPs、Zn2+处理均抑制了水稻幼苗生长,且对地下部的影响高于地上部,而Zn2+处理的毒性更强。
2.1.3不同粒径ZnO NPs处理对水稻苗长、根长的影响由图1可以看出,不同粒径的ZnO NPs、Zn2+均对水稻幼苗的苗长、根长产生了一定的抑制作用,从而对水稻幼苗产生毒性,影响显著。随着ZnO NPs粒径的增大,苗长逐渐减小,不同处理之间无显著差异。Zn2+处理的苗长、根长较低,比ZnO NPs处理的毒性作用更强。ZnO NPs、ZnSO4处理对水稻苗长、根长表现出明显的抑制作用,对苗长的抑制率为16.83%~20.96%,对根长的抑制率为4175%~53.32%,而对根长的胁迫作用远大于对苗长的胁迫作用,这与对生物量的影响表现出相同的趋势。
2.2不同质量浓度ZnO NPs处理对水稻种子萌发的影响
2.2.1不同质量浓度ZnO NPs处理对水稻种子发芽的影响由表3可以看出, 随着ZnO NPs质量浓度的增大,水稻种子的发芽势呈现下降的趋势,不同处理间的差异没有达到显著水平,说明ZnO NPs质量浓度的提高在一定程度上阻碍了水稻发芽的进度;种子的发芽指数也出现了不同程度的降低,但是ZnO NPs质量浓度的提高没有抑制发芽率。不同质量浓度ZnO NPs处理的种子活力指数具有显著差异,且质量浓度越高,抑制作用越强。综上可知,高质量浓度ZnO NPs对种子胚根具有明显影响。
2.2.2不同质量浓度ZnO NPs处理对水稻幼苗生物量的影响由表4可以看出,与对照相比,在低质量浓度下,ZnO NPs对水稻幼苗的地上部分物质积累量有一定的促进作用,当ZnO NPs的质量浓度超过100 mg/L时,水稻的地上部分生长受到一定抑制,但彼此之间无显著差异。不同处理的根鲜质量具有显著差异,且ZnO NPs质量浓度越高,抑制作用越明显。与对照相比,地上部分鲜质量除30-10处理增加了5.12%外,其他处理均有所减少,减少幅度为18.55%~33.48%,地下部分鲜质量的减少幅度为33.36%~57.03%,可见地下部分鲜质量的减少幅度明显大于地上部分。
2.2.3不同质量浓度ZnO NPs处理对水稻苗长、根长的影响由图2可以看出,在不同质量浓度下,ZnO NPs对水稻苗长、根长产生了不同作用。在低质量浓度条件下,ZnO NPs可以促进水稻根长、苗长的生长,与对照相比具有显著差异。在高质量浓度条件下,水稻的根长、苗长则受到显著抑制,且质量浓度越高,抑制作用越明显。在不同质量浓度条件下,水稻苗长抑制率为-10.56%~16.83%,根长抑制率为-32.26%~45.92%。由此可见,ZnO NPs对水稻根长的影响远大于苗长。
2.3不同粒径和质量浓度ZnO NPs处理的方差分析结果
从表5可以看出,在不同粒径下,不同处理ZnO NPs除了对水稻种子的活力指数具有极显著影响外,对发芽指标、幼苗生长指标均无显著影响。在不同质量浓度下,ZnONPs对种子发芽指数有显著影响,对水稻幼苗苗长、根长有极显著影响,对发芽势、发芽率、活力指数、地上部鲜质量、根鲜质量、根冠鲜质量比和总鲜质量均无显著影响。
3讨论
在不同粒径ZnO NPs的水培试验中,200 nm粒径ZnO NPs处理的水稻种子发芽率最高,发芽势、发芽指数也略高于90 nm粒径ZnO NPs处理;在根长和根鲜质量方面,表现为随着粒径增大,水稻种子根生长出现抑制趋势。出现上述现象的原因可能是由于纳米颗粒粒径越小,越有可能通过孔隙进入细胞,细胞壁小管、木质部导管越容易堵塞,造成水分和矿物质营养输送困难,影响幼苗生长发育[13]。文双喜等在水培试验下研究不同粒径纳米TiO2对芦苇种子发芽的影响,发现在高浓度条件下,粒径越小,种子的发芽率、发芽指数、活力指数和幼苗质量生长抑制作用越强,在对金鱼藻种子的研究中也表现出相同的结果[14-15]。有研究发现,Ag NPs降低了黑麦草的长度、根系生物量,而6 nm粒径的降幅高于25 nm粒径。这是由于粒径越小,纳米颗粒的表面积越大,越容易被植物吸收,毒性就越强[16]。目前,关于MNPs的致毒机制仍然存在争议。Chen等认为,纳米金属对植物的毒性主要来源于溶出的金属离子[17];Lee等通过试验发现,Ag NPs对植物的毒性来源于溶解的Ag+[18];García-Gómez等研究发现,ZnO NPs的毒性来源于Zn2+,但不能排除Zn2+、ZnO NPs的共同致毒效应[19];Yin等则否认了金属离子的主效应,通过研究发现Ag NPs对植物的毒性高于金属离子[16]。还有研究表明,在相同浓度下,Zn2+对水稻种子生长的抑制作用要高于ZnO NPs[20],与之前的研究表现出类似的结果,这可能由于ZnSO4的Zn2+浓度过高,超过了ZnO NPs对植物的毒性,而据报道,浓度为20~2 000 mg/L 的ZnO NPs悬液中的Zn2+浓度为 0.3~3.6 mg/L,不会对植物造成影响[21]。低浓度(10 mg/L)ZnO NPs处理促进了水稻苗长、根长的生长,有利于生物量的累积,而在高浓度(100、500 mg/L)条件下,ZnO NPs处理则显著抑制了水稻幼苗的生长。MNPs的低促高抑效应已经得到部分研究的支持。曹冲等在水培试验条件下研究了ZnO NPs对湿地种子萌发的影响,结果表明,在低浓度(0.1、1.0 mg/L)条件下,ZnO NPs能显著促进花叶芦竹种子的根茎长度增加,而100 mg/L ZnO NPs对植物根茎生长则有明显的抑制作用[22]。金盛杨等采用模拟土壤的琼脂培养方法研究了CuO NPs对小麦根系发育的影响,结果表明,10 mg/L CuO NPs可以促进根的伸长、根内超氧化物歧化酶(SOD)活性的增加,而当CuO NPs浓度为100 mg/L时则受到显著抑制[23]。Itroutwar等研究发现,10 mg/L 海藻基生物ZnO NPs从种子发芽率、根长、幼苗长度等多个方面改善了水稻的农业形态特征[24]。在本研究中,不同粒径、不同浓度的ZnO NPs对水稻幼苗生长具有显著影响,而对种子发芽情况没有显著差异,并且对水稻根长的影响大于对苗长的影响,可能是因为种子在萌发阶段受到种皮的保护,可在一定程度上减轻MNPs的胁迫作用,因此水稻种子的发芽率没有受到显著影响。有研究发现,ZnO NPs在水培条件下对小麦发育阶段的影响表现为吸胀阶段<萌动阶段<发芽阶段[25]。种子根部先破皮而出,相对于地上部暴露时间更长,接触面积更大,根部对污染更敏感,受到MNPs的胁迫更深[26-27],因此ZnO NPs对幼苗根部的抑制作用更强。
4结论
ZnO NPs延迟了水稻种子的发芽速度,但对种子的发芽率没有显著影响;ZnO NPs、Zn2+会对水稻幼苗生长产生抑制作用,且对地下部分的胁迫作用大于地上部分。不同粒径的ZnO NPs对水稻生长无显著影响。在同一质量浓度下,相比于ZnO NPs,Zn2+對水稻幼苗根系生长和生物量积累的抑制作用更强,表现出更强的毒性。
不同质量浓度ZnO NPs处理的水稻种子发芽试验结果表明,不同质量浓度的ZnO NPs均延缓了水稻种子的发芽速度,降低了发芽指数,在低质量浓度下水稻种子的发芽率受到一定抑制。ZnO NPs在低质量浓度(10 mg/L)下可促进水稻根长、苗长的生长,促进地上部分物质量的积累,而高浓度ZnO NPs则抑制了水稻幼苗的生长。ZnO NPs对地下部分的影响远大于地上部分。但是,随着MNPs应用与产量的日益增多,在纳米科技合理农用的同时,纳米颗粒的环境暴露与生态风险问题也不容忽视。
参考文献:
[1]张海,彭程,杨建军,等. 金属型纳米颗粒对植物的生态毒理效应研究进展[J]. 应用生态学报,2013,24(3):885-892.
[2]Madhumitha G,Elango G,Roopan S M. Biotechnological aspects of ZnO nanoparticles:overview on synthesis and its applications[J]. Applied Microbiology and Biotechnology,2016,100(2):571-581.
[3]Mackevica A,Hansen S F. Release of nanomaterials from solid nanocomposites and consumer exposure assessment-a forward-looking review[J]. Nanotoxicology,2016,10(6):641-653.
[4]Zhang T,Sun H D,Lv Z Y,et al. Using synchrotron-based approaches to examine the foliar application of ZnSO4 and ZnO nanoparticles for field-grown winter wheat[J]. Journal of Agricultural and Food Chemistry,2018,66(11):2572-2579.
[5]Anderson A J,Mclean J E,Jacobson A R,et al. CuO and ZnO nanoparticles modify interkingdom cell signaling processes relevant to crop production[J]. Journal of Agricultural and Food Chemistry,2017,66(26):6513-6524.
[6]Dimkpa C O,Andrews J,Sanabria J,et al. Interactive effects of drought,organic fertilizer,and zinc oxide nanoscale and bulk particles on wheat performance and grain nutrient accumulation[J]. Science of The Total Environment,2020,722:137808.
[7]van Nguyen D,Nguyen H M,Le N T,et al. Copper nanoparticle application enhances plant growth and grain yield in maize under drought stress conditions[J/OL]. Journal of Plant Growth Regulation,2021. https://doi.org/10.1007/s00344-021-10301-w.
[8]Raliya R,Biswas P,Tarafdar J C. TiO2 nanoparticle biosynthesis and its physiological effect on mung bean (Vigna radiata L.)[J]. Biotechnology Reports,2015,5:22-26.
[9]Lee S,Chung H,Kim S,et al. The genotoxic effect of ZnO and CuO nanoparticles on early growth of buckwheat,Fagopyrum esculentum[J]. Water Air Soil and Pollution,2013,224(9):1668-1678.
[10]Yang Z Z,Chen J,Dou R Z,et al. Assessment of the phytotoxicity of metal oxide nanoparticles on two crop plants,maize (Zea mays L.) and rice (Oryza sativa L.)[J]. International Journal of Environmental Research and Public Health,2015,12(12):15100-15109.
[11]Du W C,Gardea-Torresdey J L,Ji R,et al. Physiological and biochemical changes imposed by CeO2 Nanoparticles on wheat:a life cycle field study[J]. Environmental Science & Technology,2015,49(19):11884-11893.
[12]陈小龙,李前荣,陶媛,等. 常规库存条件下春小麦种子发芽能力随贮藏年限的变化研究[J]. 中国农学通报,2020,36(1):14-18.
[13]王发园. 人工纳米颗粒的植物毒性及其在植物中的吸收和累积[J]. 生态毒理学报,2012,7(2):140-147.
[14]文双喜,王毅力. 水培实验中不同粒径纳米TiO2对芦苇种子发芽和植株生长和生理的影响[J]. 生态毒理学报,2017,12(2):71-80.
[15]文双喜,王毅力. 水培实验中不同粒径纳米TiO2对金鱼藻种子发芽和植株生长和生理的影响[J]. 生态毒理学报,2018,13(6):268-277.
[16]Yin L Y,Cheng Y W,Espinasse B,et al. More than the ions:the effects of silver nanoparticles on Lolium multiflorum[J]. Environmental Science & Technology,2011,45(6):2360-2367.
[17]Chen X L,OHalloran J,Jansen M A K. Time matters:the toxicity of zinc oxide nanoparticles to Lemna minor L. increases with exposure time[J]. Water,Air & Soil Pollution,2018,229(3):99.
[18]Lee W M,Kwak J I,An Y J. Effect of silver nanoparticles in crop plants Phaseolus radiatus and Sorghum bicolor:Media effect on phytotoxicity[J]. Chemosphere,2012,86(5):491-499.
[19]García-Gómez C,Obrador A,González D,et al. Comparative effect of ZnO NPs,ZnO bulk and ZnSO4 in the antioxidant defences of two plant species growing in two agricultural soils under greenhouse conditions[J]. Science of the Total Environment,2017,589:11-24.
[20]王振紅,罗专溪,颜昌宙,等. 纳米氧化锌对绿豆芽生长的影响[J]. 农业环境科学学报,2011,30(4):619-624.
[21]Lin D,Xing B. Phytotoxicity of nanoparticles:inhibition of seed germination and root growth[J]. Environmental Pollution,2007,50(2):243-250.
[22]曹冲,黄娟,王宁,等. 纳米氧化锌对湿地植物种子萌发的影响[J]. 东南大学学报(自然科学版),2017,47(2):416-420.
[23]金盛杨,王玉军,汪鹏,等. 纳米氧化铜对小麦根系生理生化行为的影响[J]. 土壤,2011,43(4):605-610.
[24]Itroutwar P D,Govindaraju K,Tamilselvan S,et al. Seaweed-based biogenic ZnO nanoparticles for improving agro-morphological characteristics of rice (Oryza sativa L.)[J]. Journal of Plant Growth Regulation,2020,39:717-728.
[25]陈泽林,徐长山,张兰兰,等. ZnO NPs对水培小麦(Triticum aestivum L.)种子不同发育阶段的影响[J]. 生态毒理学报,2017,12(6):156-163.
[26]金彩霞,刘军军,鲍林林,等. 磺胺间甲氧嘧啶-镉复合污染对作物种子发芽的影响[J]. 中国环境科学,2010,30(6):839-844.
[27]梅丽娜,袁庆华,姚拓,等. 不同品种苜蓿芽期对重金属镉的耐性研究[J]. 作物杂志,2010(2):15-18.
基金项目:江苏省自然科学基金(编号:BK20200264);淮安市农业科学研究院院长科研发展基金(编号:HNY201601、HNY201709、HNY202028);淮安市农业科学研究院高层次引进人才科研启动发展基金(编号:002201901413)。
作者简介:殷小冬(1996—),男,安徽合肥人,硕士,研究实习员,主要从事土壤养分循环研究。E-mail:1553015412@qq.com。
通信作者:贾艳艳,博士,助理研究员,主要从事作物与土壤养分循环研究。E-mail:yyjia667@163.com。
