肿瘤靶向Pt-Cu基纳米平台用于近红外二区光声成像引导的光热治疗
2021-11-18郑子良曲波涛杨晓荣张瑞平
郑子良 曲波涛 杨晓荣 刘 玲 张瑞平
(山西医科大学第三医院,山西白求恩医院,山西医学科学院,太原 030032)
0 引言
恶性肿瘤的全球发病率和死亡率逐年攀升,在许多国家已成为民众第一大致死原因,严重威胁着人类健康[1]。近年来,恶性肿瘤被认为是精准医疗(precision medicine)主要应用的重大疾病之一,利用分子影像技术(molecular imaging)可进行肿瘤的早期诊断与边界精确化,构建个性化治疗,实现对肿瘤的高效精准诊疗[2]。目前,临床对于肿瘤治疗的方法主要包括手术、化疗、放射治疗以及免疫治疗等,但这些治疗方式存在对正常组织器官的损伤、肿瘤治疗效果有限、增加肿瘤复发与转移几率等诸多不足,严重影响肿瘤的诊断与治疗效果[3]。
光热治疗(photothermal therapy,PTT)作为一种高效的肿瘤治疗手段,由于其侵袭性小和时空选择性高等优势在近年来受到广泛关注[4]。与传统治疗方式相比,PTT具有操作简单、微创、安全、治疗时间短等特点,通过光热剂将照射激光的光能以非热辐射形式转化为热能,从而实现对肿瘤细胞的有效杀伤[5]。目前已开发用于PTT的纳米光热剂包括有机材料和无机材料2大类[6],如吲哚菁绿[7]、聚吡咯[8]、多巴胺[9]等有机材料具有良好的光热性能,但光热稳定性差,光漂白现象严重,限制了其在肿瘤PTT中的应用。因此,科学家将研究重心转向更加稳定且结构易于控制的无机纳米材料,这些材料主要包括金属纳米颗粒(金纳米棒[10]、钯纳米片[11]、合金纳米颗粒[12]等)、碳纳米材料(碳量子点[13]、碳球[14])、半导体纳米材料(硫化铜[15]、硫化银[16])等。无机纳米材料拥有生物毒性低、热稳定性强、光热灵敏度高、光转换效率高等优势,极具临床应用前景。PTT实现精准治疗离不开影像学技术的有效引导。光声(photo⁃acoustic,PA)成像作为一种新型的光学成像技术,同样是利用光热效应,将光转化为声波实现成像[17]。光声成像结合了光学成像和超声成像,具有较深的组织穿透性,可以利用高的分辨率精准定位肿瘤、清晰勾勒肿瘤轮廓,从而有效引导光热治疗[18]。特别是第二近红外区(the second near⁃infrared window,NIR⁃Ⅱ,1000~1700 nm)的PA成像,由于该区域人体各组织器官对光子的吸收、散射显著降低,无背景信号干扰,与常规近红外一区PA成像相比,有效改善了成像质量,实现了良好的空间分辨率、组织穿透力和高信噪比PA成像性能[19]。因此,利用具有NIR⁃Ⅱ光学吸收性能的纳米药物可有效结合PA成像与PTT治疗性能,实现高效的肿瘤诊疗一体化作用效果。
理想的NIR⁃Ⅱ纳米光热剂不仅具备良好的诊疗性能,还要在肿瘤部位实现有效聚集才能达到最佳效果。众所周知,由于纳米药物在肿瘤部位的吸收和代谢速率是动态平衡的,只有当沉积量达到一定数量时才能进行诊断和治疗[20]。然而,仅利用高渗透长滞留(enhanced permeability and retention,EPR)效应促使纳米药物向肿瘤区域递送,易出现积累与滞留不足,影响最终的诊疗效果[21]。因此,如何增强纳米药物在肿瘤部位的有效富集,是提升诊疗性能至关重要的一项挑战。恶性肿瘤细胞不受周围细胞因子影响与机体调控,从而导致形态、细胞代谢、分化能力及组织血供等方面的显著差异,促使肿瘤区域呈现个性化微环境特性[22]。研究表明,带正电荷的纳米颗粒易于通过特殊的胞吞途径穿透深层肿瘤,但带正电的纳米粒子在循环期间很容易被内皮网状系统(reticuloendothelial system,RES)清除,通过表面修饰,可使得纳米颗粒在肿瘤微环境作用下,实现电荷翻转,正电荷特异性表达[23]。基于肿瘤区域诸多特点,研究者致力于开发电荷翻转的刺激响应型纳米平台,实现肿瘤部位表面电荷和颗粒大小等物理化学性质的响应性改变,以提升纳米药物的靶向性和富集量,减少毒副作用[24]。因此,通过简单高效的方式将正、负电性优势结合,开发特异性肿瘤诊疗药物极具临床应用前景。
综上所述,我们设计并构筑一种肿瘤微环境响应性翻转表面电荷纳米平台Pt⁃Cu@PLL@HA(图1,PLL=聚赖氨酸,HA=透明质酸),通过肿瘤特异性靶向聚集,实现在NIR⁃ⅡPA成像引导下对肿瘤的精准NIR⁃ⅡPTT治疗。选取具有良好NIR⁃Ⅱ光学吸收性能的Pt⁃Cu合金纳米材料作为核相,通过层层(layer⁃by⁃layer,LBL)自组装技术,在其表面依次均匀包覆带正电荷的PLL和带负电荷的HA。利用HA的负电性增加纳米平台体内循环过程,结合EPR效应与HA的主动靶向性在肿瘤部位高效富集。由于肿瘤组织中的透明质酸酶(HAase)可将Pt⁃Cu@PLL@HA外部HA层(-)快速降解,暴露出内部PLL层(+),纳米平台发生响应性电荷翻转。带有正电荷的Pt⁃Cu@PLL在进入肿瘤细胞过程中,易呈现溶酶体逃逸现象,增加纳米平台的肿瘤细胞摄取量,从而大幅提升肿瘤诊疗效果,为构筑NIR⁃Ⅱ诊疗一体化纳米平台提供新思路。

图1 Pt⁃Cu@PLL@HA纳米平台的构筑及其诊疗机制示意图Fig.1 Schematic illustration for preparation and therapeutic mechanism of Pt⁃Cu@PLL@HA nanoplatform
1 实验方法
1.1 药品及试剂
聚乙烯吡咯烷酮(PVP,Mw=30 000)、硝酸铜(Cu(NO3)2·3H2O)、六 水 合 氯 铂 酸 (H2PtCl6·6H2O,37.5%)、甘氨酸、PLL(Mw=150 000)、HA 均购于阿拉丁生化科技有限公司(中国上海);台盼蓝购于Sigma⁃Aldrich公司;细胞增殖检测试剂盒Cell Counting Kit⁃8(CCK⁃8)购于博斯特生物技术有限公司。所有试剂均未进行进一步纯化。实验用水为超纯水(ρ>18 MΩ)。
1.2 Pt-Cu合金的制备
室温条件下,将80 mg PVP加入2.5 mL超纯水中,充分搅拌至完全溶解,加入预先配制的1 mL H2PtCl6(20 mmol·L-1)溶液和 1 mL Cu(NO3)2溶液(20 mmol·L-1)。随后,将40.0 mg甘氨酸加入混合溶液中,25℃下高速搅拌30 min,形成均匀的黄绿色溶液。将反应混合物转移到含有聚四氟乙烯内衬的15 mL高压反应釜中,在200℃下反应6 h,冷却至室温。将混合溶液以4 500 r·min-1的转速离心,用超纯水洗涤3次,固体产物真空冷冻干燥得到Pt⁃Cu合金。
1.3 Pt-Cu@PLL@HA的制备
采用LBL自组装技术制备样品。将5 mL Pt⁃Cu合金水溶液(2 mg·mL-1)分散于10 mL超纯水中,超声 15 min,滴加 2 mL PLL(10 mg·mL-1)水溶液,在37℃下搅拌1 h,离心收集固体Pt⁃Cu@PLL。随后,将得到的Pt⁃Cu@PLL分散在5 mL去离子水中,缓慢加入10 mL HA(2 mg·mL-1)水溶液。反应1 h后离心收集Pt⁃Cu@PLL@HA,用超纯水洗涤数次,固体沉淀经真空冷冻干燥得到Pt⁃Cu@PLL@HA。
1.4 表征分析仪器
采用JEM 2100F(200 kV)型透射电子显微镜(TEM)对材料的形貌及结构进行分析。使用Rigaku D/max⁃2500 型衍射仪测定样品在 5°~80°范围内的X 射线衍射(XRD)图,工作条件:CuKα辐射(λ=0.154 059 8 nm)、管电压50 kV、管电流200 mA、扫描速度 5(°)·min-1。动态光散射(DLS)的尺寸分布和样品的ζ电位在Malvern电位分析仪上测试。X射线光电子能谱(XPS)的测定使用Thermo⁃VG Scientific ESCALAB250光谱仪,以AlKα为射线源(150 W)。FT⁃IR光谱在Vertex PerkinElmer 580 BIR分光光度计(Bruker)上采集,使用KBr压片进行制样分析。样品的UV⁃Vis光谱采用TU⁃1901双光束紫外可见分光光度计(PerkinElmer)测定。热重-差热(TG⁃DTA)分析采用Rigaku的TG 8101D型仪器,在空气气氛中以10℃·min-1的加热速率,从室温升温至800℃。
1.5 体外细胞毒性评价
以购自中国科学院(中国上海)的小鼠乳腺癌细胞(4T1)为细胞模型,以RPMI 1640为培养基,在培养基中加入体积分数10%的灭活胎牛血清(FBS),加入1%双抗(青霉素/链霉素)防止细菌污染。细胞置于细胞培养箱中,在37℃、CO2体积分数5%的气氛条件下培养。采用标准CCK⁃8方法分别测定Pt⁃Cu和Pt⁃Cu@PLL@HA的体外细胞毒性以及激光照射后细胞杀伤性能。将4T1细胞悬液以每孔8 000个的密度均匀播种在96孔板中,每孔加入100 μL培养液,在37℃、CO2体积分数5%的条件下培养24 h,贴壁后,弃去培养液,向孔中加入100 μL含不同浓度Pt⁃Cu或Pt⁃Cu@PLL@HA(0、12.5、25、50、100、200和400 μg·mL-1)的新鲜培养基。孵育 24 h后,去除含有样品的培养基,加入 10 μL CCK⁃8 溶液(5 mg·mL-1)与培养液混合,共孵育2 h,使用酶标仪(BioTek Epoch 2)在450 nm处测量吸光度。
对于体外细胞光热性能分析,将1×105个4T1细胞置于直径35 mm的培养皿中,培养24 h。经磷酸盐缓冲盐溶液(PBS,pH=7.4)冲洗后,用含不同浓度的Pt⁃Cu或Pt⁃Cu@PLL@HA(0、12.5、25、50、100、200和 400 μg·mL-1)溶液孵育 4 h。随后用 PBS 冲洗细胞,并浸泡在300 μL的介质中,在强度为1.0 W·cm-2的1 064 nm激光下照射5 min,细胞在37℃下再培养30 min。加入CCK⁃8溶液共孵育2 h,通过酶标仪检测细胞杀伤情况;同样条件下,采用台盼蓝染色,在荧光显微镜下观察细胞。
1.6 活体PA成像
雌性BALB/c裸鼠(6~8周龄,17~19 g)购自北京维通丽华实验动物科技有限公司。动物实验中,所有动物操作规程均符合《中国国家实验动物管理和使用条例》的标准。动物协议经山西医科大学机构动物使用与关爱委员会批准(批准号:2016LL141,中国太原)。将小鼠驯化至少7 d后,在小鼠左腿背皮下注射4T1细胞(3×106个)建立瘤模型。当肿瘤体积达到75 mm3以上时,在尾静脉注射Pt⁃Cu@PLL@HA材料(15 mg·kg-1),利用实时多光谱光声层析成像系统(MSOT),分别于注射前及注射后 1、4、8、12、24 h麻醉小鼠进行PA成像,研究材料在肿瘤部位的聚集特性。
1.7 活体光热治疗
将荷瘤小鼠随机分为3组(每组4只)进行不同治 疗 :(1)PBS+laser、(2)Pt⁃Cu+laser、(3)Pt⁃Cu@PLL@HA+laser。在尾静脉分别注射样品(15 mg·kg-1),用1 064 nm激光(1.0 W·cm-2)照射整个肿瘤区域5 min。采用红外热成像系统监测肿瘤区域平均温度。用公式(ab)2/2计算肿瘤体积,其中a和b分别表示肿瘤长度和宽度。12 d后,处死所有小鼠,收集肿瘤进行苏木精和伊红(H&E)染色。
1.8 统计分析
所有结果均以均数±标准差(S.D.)的形式记录。采用单因素方差分析进行统计学意义分析。*P<0.05,**P<0.01,***P<0.001。
2 结果与讨论
2.1 Pt-Cu@PLL@HA的形貌与理化特性
对Pt⁃Cu@PLL@HA的形貌、结构及物化性能进行分析,如图2所示。利用水热合成的Pt⁃Cu合金纳米颗粒(图2A)呈花簇状结构,粒径均一,平均粒度为56.2 nm。通过LBL自组装过程,在Pt⁃Cu颗粒表面包覆 PLL 和 HA,从 TEM 图 可以看出(图 2B),Pt⁃Cu@PLL@HA纳米颗粒外部具有明显的壳层结构包覆,壳层厚度约为10.9 nm,表明利用LBL技术在Pt⁃Cu颗粒表面成功构筑包覆壳层。Pt⁃Cu@PLL@HA的元素映射图(图2C)显示所含Pt、Cu元素以及壳层C、N等元素在样品颗粒中呈现均匀分布。通过XRD对样品中Pt、Cu元素的存在形式进行分析,由图2D可以看出,在41.1°、47.7°、69.3°处出现的特征衍射峰介于金属Pt(PDF No.04⁃0802)与金属Cu(PDF No.04⁃0836)的衍射峰之间,表明 Pt⁃Cu 是合金相。经PLL和HA修饰后,Pt⁃Cu晶体结构未发生改变,说明Pt⁃Cu合金具备良好的稳定性,有利于生物活体应用。进一步,利用XPS探究Pt⁃Cu@PLL@HA中Pt、Cu元素的价态。图2E为样品的Pt4f能级光谱,结合能为70.65和74.06 eV处的吸收峰分别对应Pt0的Pt4f7/2和Pt4f5/2轨道[25]。71.67和75.06 eV处出现的较弱吸收峰是表面Pt氧化导致。此外,由于样品中含有Cu元素,出现在75.74 eV的吸收峰可归属于Cu3p峰。图2F为Pt⁃Cu@PLL@HA的Cu2p谱图,分析表明,在932.13和951.85 eV处的峰与Cu02p峰相吻合[26]。由此证明样品中 Pt、Cu元素以 Pt⁃Cu合金形式存在。
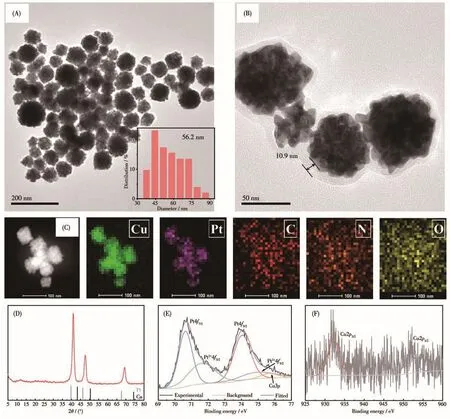
图2 (A)Pt⁃Cu与(B)Pt⁃Cu@PLL@HA的TEM图;(C)Pt⁃Cu@PLL@HA的元素映射图像;Pt⁃Cu@PLL@HA的(D)XRD图、(E)Pt4f和(F)Cu2p的XPS谱图Fig.2 TEM images of(A)Pt⁃Cu and(B)Pt⁃Cu@PLL@HA;(C)Corresponding elemental mappings of Pt⁃Cu@PLL@HA;(D)XRD patterns,high⁃resolution XPS spectra of(E)Pt4f and(F)Cu2p of Pt⁃Cu@PLL@HA
2.2 Pt-Cu@PLL@HA的构筑分析和响应性能
Pt⁃Cu@PLL@HA的合成是利用正负电荷间相互作用的LBL技术,由于Pt⁃Cu合金带负电荷,通过静电结合,将带正电性的PLL和带负电性的HA依次包覆在Pt⁃Cu纳米颗粒上。在LBL包覆过程中对样品进行ζ电位和粒径分析。由图3A可知,通过PLL的包覆,样品的ζ电位从-5.5 mV翻转为Pt⁃Cu@PLL的22.6 mV,随后再次翻转至Pt⁃Cu@PLL@HA的-37.9 mV。通过逐级包覆样品的颗粒尺寸(流体力学直径)逐渐增大,从Pt⁃Cu合金的粒径64.6 nm增大至Pt⁃Cu@PLL@HA 的80.22 nm(图3B),充分证明PLL和HA依次成功包覆在Pt⁃Cu合金颗粒表面。此外,Pt⁃Cu@PLL@HA的颗粒尺寸使得样品具有良好的EPR效果,有利于样品在肿瘤部位的高效富集[27]。进一步对Pt⁃Cu@PLL@HA的稳定性进行分析(图3C),分别在水、PBS、生理盐水和RPMI 1640培养基中孵育24 h后,Pt⁃Cu@PLL@HA保持胶体稳定性,粒径与ζ电位未发生明显变化,这表明Pt⁃Cu@PLL@HA具有良好的生理稳定性和长血液循环性能。当样品进入肿瘤微环境,样品外部的HA被肿瘤组织中的HAase快速降解,样品内部的PLL暴露,发生电荷翻转。Pt⁃Cu@PLL@HA在模拟肿瘤微环境HAase的作用下(图3D),样品粒径与电位发生明显变化,随着外表面HA的降解,样品表面电位向正电荷方向变化,反应180 min后ζ电位增大为19.31 mV,粒径减小至65.01 nm,表明在肿瘤部位样品表面的HA可有效降解,释放内部Pt⁃Cu@PLL纳米颗粒。

图3 Pt⁃Cu、Pt⁃Cu@PLL和Pt⁃Cu@PLL@HA的(A)ζ电位和(B)流体力学直径;(C)Pt⁃Cu@PLL@HA在水、PBS、生理盐水和RPMI 1640培养基中24 h后的流体力学直径和ζ电位;(D)HAase作用下Pt⁃Cu@PLL@HA的流体力学直径和电位变化Fig.3 (A)ζ potentials and(B)hydrodynamic diameters of Pt⁃Cu,Pt⁃Cu@PLL and Pt⁃Cu@PLL@HA;(C)Hydrodynamic diameters and ζ potentials of Pt⁃Cu@PLL@HA in water,PBS,saline and RPMI 1640 medium after 24 h;(D)Hydrodynamic diameter and ζ potential changes of Pt⁃Cu@PLL@HA
2.3 Pt-Cu@PLL@HA的光热性能
图4 A为Pt⁃Cu@PLL@HA的吸收光谱图。Pt⁃Cu@PLL@HA在600~1 400 nm范围存在广谱光吸收能力,特别是在1 000 nm之后的NIR⁃Ⅱ依旧保持较高的光吸收强度,表明Pt⁃Cu@PLL@HA可作为光热肿瘤治疗潜在的候选材料。基于良好的吸光性能,将不同浓度的Pt⁃Cu@PLL@HA溶液(25、50、100、200 和 400 μg·mL-1)分别在 1 064 nm(1.0 W·cm-2)近红外激光下照射5 min,分析材料的光热性能。如图4B所示,当Pt⁃Cu@PLL@HA溶液在激光照射下,即使在低浓度(25 μg·mL-1)时温度也会迅速升高,而纯水在照射后温度变化可忽略不计。并且随着Pt⁃Cu@PLL@HA浓度提高,其升温速率不断增加,表明Pt⁃Cu@PLL@HA的光热效应具有浓度依赖性。此外,从红外热像图(图4C)也可直观地看出Pt⁃Cu@PLL@HA在不同条件下的升温差异。众所周知,纳米光热剂的光热稳定性是其未来应用的关键[28]。 将 Pt⁃Cu@PLL@HA 溶 液 (400 μg·mL-1)在1 064 nm激光开/关循环照射5次后,检测其光热稳定性(图4D)。5次循环过程中升温效果没有明显的偏差,光热性能也没有明显的衰退,表明Pt⁃Cu@PLL@HA纳米材料具有优异的光热稳定性。综上分析,Pt⁃Cu@PLL@HA在NIR⁃Ⅱ的1 064 nm激光照射下表现出良好的光热特性,表明此材料适合作为NIR⁃Ⅱ纳米光热剂实现肿瘤高效光热治疗。

图4 (A)Pt⁃Cu@PLL@HA的吸收光谱图;不同浓度Pt⁃Cu@PLL@HA溶液(0、25、50、100、200和400 μg·mL-1)在1 064 nm(1 W·cm⁃2)激光照射300 s的(B)升温曲线图和(C)热成像图;(D)Pt⁃Cu@PLL@HA的光热稳定性Fig.4 (A)Absorption spectra of Pt⁃Cu@PLL@HA;(B)Photothermal heating curves and(C)infrared thermal images of Pt⁃Cu@PLL@HA solution with different concentrations(0,25,50,100,200 and 400 μg·mL-1)under laser irradiation(1 064 nm,1 W·cm-2)as a function of time(0⁃300 s);(D)Photothermal stability of Pt⁃Cu@PLL@HA
2.4 Pt-Cu@PLL@HA的细胞毒性
采用CCK⁃8法检测Pt⁃Cu@PLL@HA对人脐静脉内皮细胞(HUVEC)和4T1细胞(小鼠乳腺癌细胞)的细胞活性影响。如图5A所示,即使在高浓度Pt⁃Cu@PLL@HA(400 μg·mL-1)中孵育 24 h 后,细胞活力仍保持在95%以上,表明Pt⁃Cu@PLL@HA细胞毒性较低,具有良好的生物相容性。基于以上细胞毒性,利用1 064 nm激光辐照,分析Pt⁃Cu和Pt⁃Cu@PLL@HA对4T1细胞的杀伤性能。图5B表明,Pt⁃Cu@PLL@HA孵育的4T1细胞存活率明显低于Pt⁃Cu处理组,并且2组细胞存活率随溶液浓度增加变化趋势基本一致,这一现象说明聚合物包覆可有效提升细胞对材料的摄取量,并且包覆层对Pt⁃Cu光热性能影响较小。利用台盼蓝细胞染色观察Pt⁃Cu和Pt⁃Cu@PLL@HA在1 064 nm激光照射下的细胞活性(图5C)。Pt⁃Cu@PLL@HA组细胞无明显死亡,细胞存活率高,这与图5A的CCK⁃8细胞活性相吻合,进一步证实该材料良好的细胞相容性。在1 064 nm激光照射下,Pt⁃Cu@PLL@HA+Laser组细胞的死亡率明显高于Pt⁃Cu+Laser组,呈现出大量细胞死亡现象,表明Pt⁃Cu@PLL@HA是一种极具应用前景的NIR⁃Ⅱ光热剂。
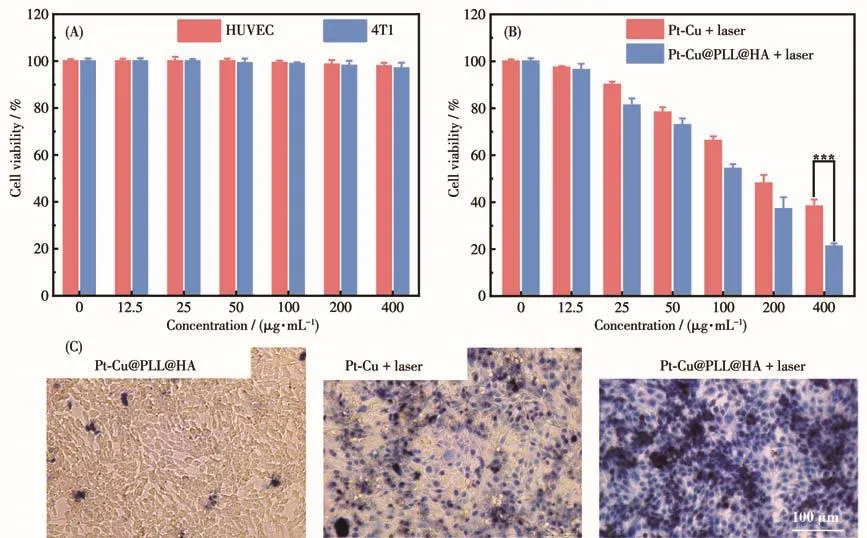
图5 (A)不同浓度Pt⁃Cu@PLL@HA分别孵育HUVEC和4T1细胞的存活率;(B)经不同浓度的Pt⁃Cu和Pt⁃Cu@PLL@HA孵育4T1细胞后在1 064 nm(1 W·cm-2)激光照射5 min下的细胞活性;(C)不同样品与4T1共孵育后分别进行1 064 nm(1 W·cm-2)的激光照射,通过台盼蓝染色死细胞;***P<0.001Fig.5 (A)HUVEC and 4T1 cell viabilities after incubation with Pt⁃Cu@PLL@HA with various concentrations;(B)Cell viability of 4T1 cells after incubation with Pt⁃Cu and Pt⁃Cu@PLL@HA under laser irradiation(1 064 nm,1 W·cm-2,5 min);(C)Micrographs of 4T1 cells incubated with the samples before or after irradiation with 1 064 nm laser(1 W·cm-2),where dead cells are stained with trypan blue;***P<0.001
2.5 Pt-Cu@PLL@HA的光声成像
通过体外分析Pt⁃Cu@PLL@HA的PA信号评价其光声特性。如图6A所示,观察到在1 064 nm处PA强度与Pt⁃Cu@PLL@HA浓度呈线性关系,随着溶液浓度的提升,PA信号呈上升趋势,表明对体内Pt⁃Cu@PLL@HA浓度定量分析的可行性。基于以上结果,对4T1荷瘤小鼠进行Pt⁃Cu@PLL@HA尾静脉注射(15 mg·kg-1),在注射前后不同时间点(0、1、4、8、12和24 h)监测Pt⁃Cu@PLL@HA活体PA成像性能。图6C中肿瘤区域PA信号随着时间的推移逐渐增强,在整个肿瘤内的对比度明显高于周围组织,并在给药后12 h达到最佳聚集效果,给药24 h肿瘤部位的光声强度逐步减弱。此外,通过对PA信号的半定量分析(图6B),给药后12 h肿瘤部位的PA强度约为给药前的13.4倍,进一步证明Pt⁃Cu@PLL@HA可作为一种优异的PA成像剂,其能够有效识别肿瘤区域,指导诊断和治疗。

图6 (A)不同浓度Pt⁃Cu@PLL@HA的PA强度;4T1荷瘤鼠静脉注射Pt⁃Cu@PLL@HA后在1 064 nm激光照射下不同时间点的(B)PA强度变化和(C)活体PA成像Fig.6 (A)PA intensities of Pt⁃Cu@PLL@HA with different concentrations;(B)PA intensity changes and(C)PA imaging of 4T1 tumor⁃bearing mice after Pt⁃Cu@PLL@HA injection under 1 064 nm laser irradiation
2.6 Pt-Cu@PLL@HA活体光热治疗
为进一步阐明Pt⁃Cu@PLL@HA的活体PTT疗效,分别对 4T1 荷瘤鼠进行 PBS、Pt⁃Cu 和 Pt⁃Cu@PLL@HA三种尾静脉给药,根据PA成像的最佳滞留时间,给药12 h后对肿瘤部位进行1 064 nm(1 W·cm-2)激光照射5 min,用热成像技术评价体内抑瘤效果。如图7A和7B所示,PBS对照组的肿瘤部位仅观察到微小的温度变化;而Pt⁃Cu组和Pt⁃Cu@PLL@HA组在相同的激光照射下,最终温度分别升高至47.68和51.89℃,Pt⁃Cu@PLL@HA在所有光热辐照时间点上都表现出最高的温度值,这表明样品由于包覆层在肿瘤微环境的HA特异性降解与PLL的细胞高效摄取,有效提升了肿瘤区域的富集量,增强了光热治疗性能。持续监测PTT治疗Pt⁃Cu和 Pt⁃Cu@PLL@HA 组小鼠(图 7C),Pt⁃Cu@PLL@HA组表现出良好的热消融作用,光热治疗小鼠12 d后肿瘤成功消除;而Pt⁃Cu组小鼠出现明显的肿瘤复发现象,光照治疗区域出现火山形瘤体。经Pt⁃Cu@PLL@HA 光热治疗后(图 7D),荷瘤鼠肿瘤体积显著减小,表现出优异的肿瘤抑制效果。此外,3组治疗小鼠体重12 d内均无明显下降趋势(图7E),进一步证明Pt⁃Cu@PLL@HA良好的生物相容性和生物安全性。图7F为3组治疗小鼠肿瘤组织H&E分析,Pt⁃Cu@PLL@HA光热治疗后,肿瘤组织遭到破坏,呈现明显的细胞凋亡,表明Pt⁃Cu@PLL@HA在NIR⁃Ⅱ光照条件下具备高效的PTT治疗效果,有效消融癌细胞。此外,Pt⁃Cu@PLL@HA光热治疗后,小鼠的主要器官(包括心、肝、脾、肺和肾)未见明显坏死或生理形态变化(图7G)。综上所述,Pt⁃Cu@PLL@HA具有较高的肿瘤富集与摄取能力,可实现高效的NIR⁃Ⅱ光热治疗性能。

图7 4T1荷瘤鼠静脉注射PBS、Pt⁃Cu或Pt⁃Cu@PLL@HA后对肿瘤区域激光辐照(1 064 nm,1 W·cm-2)的(A)红外热成像和(B)肿瘤温度变化曲线;(C)光热治疗后不同治疗组的小鼠照片;各治疗组小鼠(D)肿瘤体积和(E)体重随时间的变化图;(F)治疗结束后收集小鼠肿瘤组织的H&E染色;(G)Pt⁃Cu@PLL@HA治疗组小鼠主要器官的H&E染色图像;标尺:100 μm;***P<0.001Fig.7 (A)IRT images and(B)corresponding temperature curves of 4T1 tumor⁃bearing mice injected with PBS,Pt⁃Cu or Pt⁃Cu@PLL@HA under laser irradiation(1 064 nm,1 W·cm-2);(C)Representative photographs of mice of different groups after PTT;(D)Tumor volume and(E)body weight of mice from different groups after PTT;(F)H&E staining of the tumor tissues collected from mice at the end of treatment;(G)H&E⁃stained images of major organs collected from mices in Pt⁃Cu@PLL@HA group;Scale bar:100 μm;***P<0.001
3 结论
基于Pt⁃Cu纳米合金良好的NIR⁃Ⅱ吸收性能,通过LBL技术构筑可在肿瘤部位高效富集的Pt⁃Cu@PLL@HA纳米平台,实现NIR⁃Ⅱ PA成像引导下的精准NIR⁃ⅡPTT肿瘤治疗。通过表征手段对Pt⁃Cu@PLL@HA纳米平台的颗粒形貌、元素存在形式、体外响应效果以及NIR⁃Ⅱ光热性能进行系统性分析,表明Pt⁃Cu@PLL@HA具有理想的光热效应与生物相容性。基于HA层在肿瘤区域的降解特性,促使PLL层(+)暴露,发生电荷翻转,增加肿瘤细胞摄取量。进一步通过一系列细胞、活体实验证实,相比Pt⁃Cu纳米颗粒,Pt⁃Cu@PLL@HA能够有效进入肿瘤细胞,实现高效肿瘤热消融效果。
猜你喜欢
杂志排行
无机化学学报的其它文章
- Mn-Based Coordination Polymer:Facile Synthesis,Structure and Application in Glucose Electrochemical Sensing
- Preparation of Dehydrated Ni-Fe Hydrotalcite-like Compounds as an Eco-Friendly Catalyst for Highly Selective Acetalization of Biomass-Derived Furfural
- Synthesis,Structure Regulation and Characterization of Cadmium(Ⅱ)Complexes Based on Imidazole Carboxylic Acid Ligands
- Difunctional Effects of Organo-Modified T-Type Zeolite Membranes for Dewatering from Organic Solution
- Controlling Distribution of Gold Nanoparticles in Au@ZIF-8 Core-Shell Structures for Sensing Fluorescent Molecules with Photoluminescence
- Structures and Luminescence Property of Two Co(Ⅱ) and Cd(Ⅱ)Supramolecular Coordination Networks Created via Synergistic Effect of Coordination Bonds and Secondary Interactions
