羊卓雍错不同湖区水体真菌群落结构及其多样性
2021-11-18王艳红郭小芳
郝 兆,王艳红,德 吉,郭小芳
西藏大学理学院, 拉萨 850000
湖泊是陆地水圈的重要组成部分,也是地表各圈层彼此相互作用的节点,在调节区域气候变化、维系区域生态平衡以及促进区域经济发展等方面发挥着重要作用[1]。我国幅员辽阔,湖泊数量多、类型全、分布广,全国面积大于1.0 km2的湖泊2759个,总面积91019.6 km2,被认为是世界上湖泊生态类型最为丰富的国家之一[1-2]。微生物群落作为水生态系统的重要组成部分,是驱动湖泊等水体地球化学循环和生态系统运行的关键[3]。大量研究表明,微生物群落不仅是生态系统的功能因子,其群落结构及多样性还会对环境变化做出迅速响应,可以作为衡量湖泊生态系统稳定性的重要指标[4-7]。由于水生生态系统中99%以上的微生物尚未被培养出,这就导致绝大多数的微生物还未被人们所认识[8]。高通量测序技术因其不依赖微生物的纯培养,可以对微生物群落结构做出更加准确的描述[9]。目前,高通量测序技术对微生物群落结构的研究方法已经比较成熟,国内外利用高通量测序技术探讨湖库微生物群落结构及多样性的研究陆续开展,多数研究表明湖泊微生物群落结构及多样性主要受环境因素影响,如温度、溶解氧、pH、电导率以及湖泊营养状态等[10-17]。但已有研究大多针对湖泊细菌群落,对真菌群落研究相对较少。
青藏高原平均海拔在4000 m以上,是全球海拔最高、面积最大的陆地生态系统,素有“世界屋脊”、“亚洲水塔”之称[18]。青藏高原湖泊资源丰富,面积在1.0 km2以上的湖泊1091个,合计总面积44993.3 km2,分别占全国湖泊总数量和总面积的39.5%和49.5%[2]。独特的地理单元及气候条件使得高原湖泊孕育着丰富的微生物资源[19]。羊卓雍错流域位于西藏南部,流域东西向长144 km,南北向宽100 km,流域面积6100 km2,流域内分布着数个自然湖泊,常年的自然演变以及人类活动使得各湖泊间水体理化因子存在较大差异,是研究高原湖泊水体微生物群落结构及多样性的理想场所[20-21]。长期以来,由于地理位置的限制,对羊卓雍错流域生物资源的研究大多集中于鸟类及植物方面[22-26],对微生物的研究相对较少,仅见于湖岸放线菌生防潜力和多样性研究以及部分湖区沉积物中细菌群落结构垂直分布研究[27-28]。开展羊卓雍错水体真菌群落结构及多样性研究能够为羊卓雍错环境保护以及青藏高原微生物多样性研究提供理论依据,并为羊卓雍错水体真菌资源的开发和利用奠定基础。
1 材料与方法
1.1 研究区域及水样采集
羊卓雍错位于青藏高原南部,西藏自治区山南地区浪卡子县境内,是雅鲁藏布江南岸和喜马拉雅山北麓最大的封闭性内陆咸水湖,与纳木错、玛旁雍错并称为西藏三大圣湖[29]。羊卓雍错属高原堰塞湖,湖泊形状很不规则,湖岸曲折蜿蜒,多年的自然演化使得其主湖区附近独立出空母错、沉错以及巴纠错3个小湖。目前,主湖区西侧经河道与空母错相连,空母错东侧经河道与沉错相连[29]。空母错主要由冰川融水补给,水位较高,羊卓雍错、沉错以及巴纠错主要以降水补给为主,冰川融水补给相对较少[21]。羊卓雍错湖面海拔为4440 m,湖水平均面积为643.98 km2,平均周长为709.41 km,水深一般为30—40 m,最深可达59 m,湖水储量约为160×108m3[30-31]。羊卓雍错地处喜马拉雅山北坡雨影区,属藏南山地灌丛草原半干旱气候,流域年均温2.9 ℃,年均降水363.4 mm,5—9月降水量占全年降水量的90%以上[21,32]。


图1 羊卓雍错流域水体采集样点分布Fig.1 Distribution of sampling sites in Yamzhog Yumco Lake

表1 羊卓雍错水体采集样点概况Table 1 General situation of sampling sites in Yamzhog Yumco Lake
1.2 理化性质测定

1.3 DNA的提取和高通量测序
将冷冻保存的样品送往北京诺禾致源科技股份有限公司。DNA的提取采用CTAB法[33],利用1%琼脂糖凝胶电泳检测DNA的纯度和浓度。采用带Barcode的真菌ITS1区引物:ITS2- 2043R(5′-GCTGCGTTCTTCATCGATGC- 3′)、ITS5- 1737F(5′-GGAAGTAAAAGTCGTAACAAGG- 3′)以及高效高保真酶进行PCR。PCR扩增产物使用2%琼脂糖凝胶电泳检测,根据PCR产物浓度进行等量混样,充分混匀后使用2%琼脂糖凝胶电泳检测,目标条带使用Qiagen公司的胶回收试剂盒回收产物。使用TruSeqTMDNA PCR-Free Sample Preparation Kit进行文库构建,构建好的文库经过Qubit和Q-PCR定量,文库合格后使用NovaSeq 6000进行上机测序。
1.4 数据分析
根据Barcode序列和引物序列从高通量数据中拆分出各样本数据,截去Barcode和引物序列后使用FLASH V1.2.7软件对序列进行拼接。拼接得到的原始Tags数据(Raw Tags)使用 Qiime V1.9.1软件进行过滤。使用Uparse V7.0.1001软件对过滤后的数据进行聚类,以97%的一致性将序列聚类成为可操作分类单元(OTU,operational taxonomic units),使用 Qiime V1.9.1软件中的Blast方法结合Unit V7.2数据库进行物种注释分析,最后以样本中最小数据量为标准进行均一化处理。
基于均一化处理后的OTU数据,使用 Qiime V1.9.1软件进行α-多样性的计算。相关性分析以及差异性分析采用SPSS 20.0软件的Pearson相关性系数法和单因素方差分析(ANOVA),多重比较分析使用Duncan检验法,完全连接聚合聚类、非度量多维尺度分析以及ANOSIM检验使用R 4.0.1软件进行,冗余分析使用CANOCO 5软件进行,绘图使用R 4.0.1软件以及Origin 2019软件进行。
2 结果与分析
2.1 羊卓雍错水体理化性质


图2 羊卓雍错各样点水体理化因子Fig.2 Aquatic environmental factors of different sites in Yamzhog Yumco Lake
各区域理化因子差异性分析显示(图3),就水体pH值而言,羊卓雍错沿岸区和羊卓雍错湖心区显著高于空母错沿岸区和沉错沿岸区;就EC、TDS以及盐度而言,羊卓雍错沿岸区及羊卓雍错湖心区均显著高于沉错沿岸区,沉错沿岸区均显著高于空母错沿岸区;就TP而言,空母错沿岸区及沉错沿岸区显著高于羊卓雍错沿岸区;其他理化因子在各区域间则没有显著差异(P>0.05)。
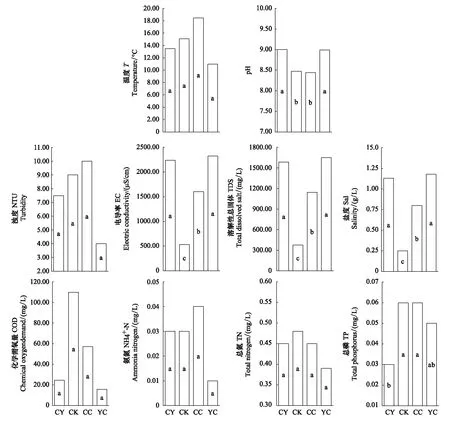
图3 羊卓雍错各区域水体理化因子差异性分析Fig.3 Aquatic environmental factors of different regions in Yamzhog Yumco LakeCY: 羊卓雍错沿岸区 Coastal area of Yamzhog Yumco Lake; CK: 空母错沿岸区 Coastal area of Kongmo Co Lake; CC:沉错沿岸区 Coastal area of Chen Co Lake; YC: 羊卓雍错湖心区 Yamzhog Yumco Lake center; 不同字母代表不同区域间在P<0.05水平上差异显著
2.2 羊卓雍错水体浮游真菌多样性特征
由表2可知,从羊卓雍错各样点水体中共检测到4649个OTU,其中4号样点OTU数量较多,而9号样点较少。各样本Coverage指数均在99%以上,Coverage指数与各样点稀疏曲线(图4)均表明,本次研究的测序深度已达到较高水平,能够代表样本中微生物的真实情况。分析丰富度指数和多样性指数可以发现,Ace指数与Chao 1指数拥有相似的变化趋势,均表明7号、5号、4号样点水体真菌丰富度较高而9号样点较低。Shannon指数显示,4号与7号样点水体真菌多样性最高,9号样点多样性则最低。Simpson指数表明水体真菌多样性最高的为7号和4号样点,水体真菌多样性最低的为8号样点。各区域差异性分析显示,羊卓雍错沿岸区(CY)OTU数量显著高于羊卓雍错湖心区(YC)(P<0.05),其他指数在不同区域间的差异则不显著(P>0.05)。
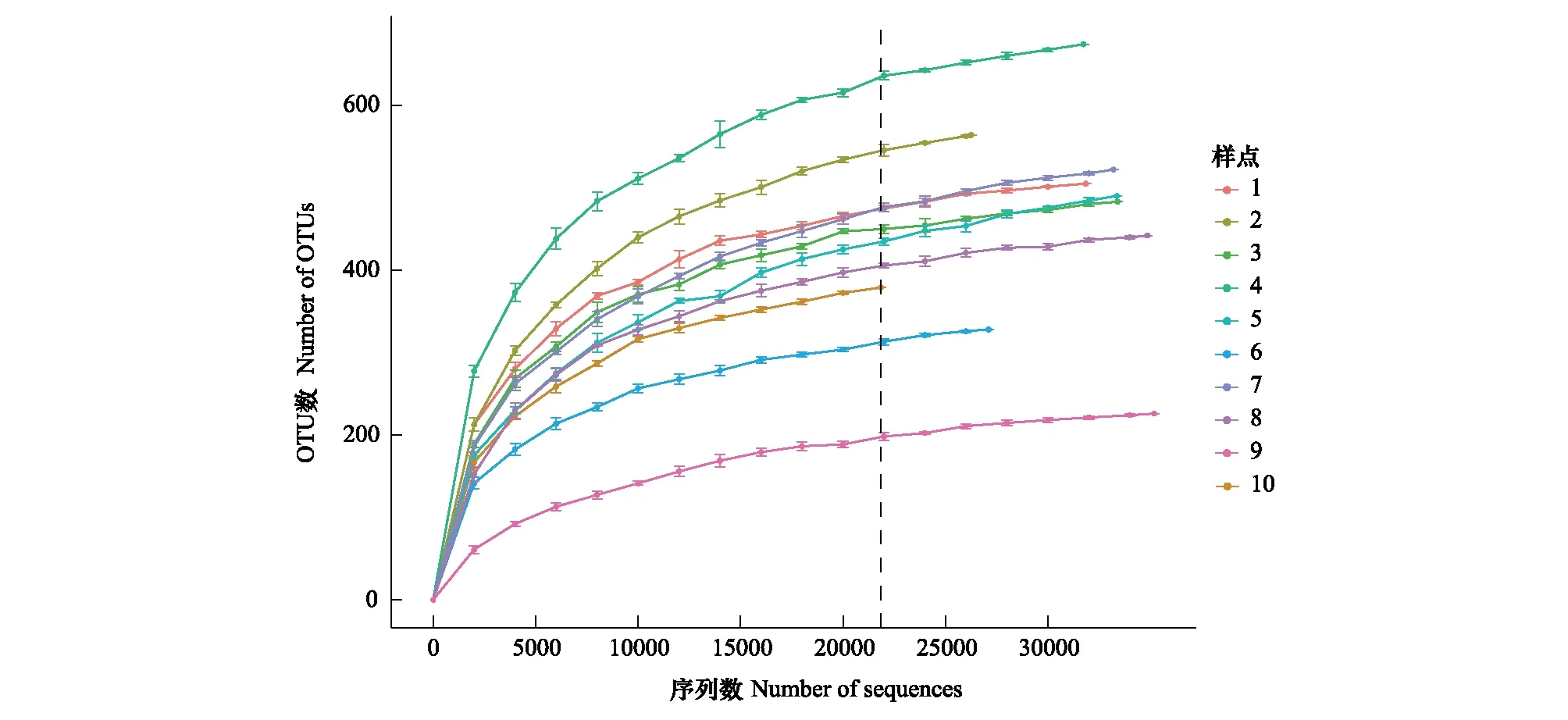
图4 羊卓雍错水体真菌在97%水平上的稀疏曲线Fig.4 Rarefaction curves of aquatic fungal samples in Yamzhog Yumco Lake at cutoff level of 97%OTU: 可操作分类单元 Operational taxonomic units

表2 羊卓雍错水体真菌α-多样性指数Table 2 The α-diversity indexes of aquatic fungal in Yamzhog Yumco Lake
2.3 羊卓雍错水体真菌群落结构组成
对各OTU代表序列进行物种注释,对门水平及属水平下的物种进行分析发现,由于当前数据库的局限性,本实验中真菌群落较多OTU属未知类群,相似结果在其他研究中也有出现[11,16,34]。1—10号样点门水平下未知类群所占的比例分别为32.1%、77.3%、51.5%、46.6%、86.5%、81.2%、45.1%、30.3%、94.4%、97.3%,属水平下未知类群所占的比例分别为52.2%、83.7%、79.7%、78.1%、96.4%、98.0%、66.8%、41.4%、97.1%、98.6%。为更直观体现各样本相对丰度较高的门类与属类及其比例,选取门水平下除未知类群外的物种以及属水平下除未知类群外相对丰度排名前10的物种的相对丰度生成柱状堆积图,结果如图5所示。
羊卓雍错各样点水体已注释真菌分属于子囊菌门(Ascomycota)、被孢霉门(Mortierellomycota)、担子菌门(Basidiomycota)、壶菌门(Chytridiomycota)、毛霉菌门(Mucoromycota)、罗兹菌门(Rozellomycota)、球囊菌门(Glomeromycota)和捕虫霉亚门(Zoopagomycota)。由图5可知羊卓雍错水体已注释真菌相对丰度最高的门类为子囊菌门(Ascomycota),在各样点相对丰度占比分别为12.8%、26.6%、72.6%、16.9%、47.2%、80.1%、54.4%、90.3%、87.1%、63.0%;其次为被孢霉门(Mortierellomycota),在各样点相对丰度占比分别为52.4%、13.7%、5.3%、33.1%、2.1%、0.9%、0.3%、0.1%、2.5%、1.8%;担子菌门(Basidiomycota)相对丰度也较高,在各样点相对丰度占比分别为7.0%、51.1%、4.1%、12.2%、32.9%、15.3%、32.4%、5.4%、4.0%、21.5%。由真菌属水平柱状堆积图可以看出(图5),Alternaria相对丰度最高,集中表现在5号、8号以及9号样点,其值均在78%以上。其次为Mortierella,集中表现在1号和4号样点,其值分别为74.5%和80.6%。2号、3号、6号、7号样点中相对丰度较高的属分别为Dioszegia、Xalocoa、Russula、Cyberlindnera,其值分别为65.0%、40.3%、42.0%以及55.2%。10号样点真菌属水平分布则较为均匀,Alternaria、Cyberlindnera以及Helicoma均具有较高的相对丰度。

图5 各样点水体真菌在门水平及属水平物种分布柱状堆积图Fig.5 The relative percent contribution of aquatic fungal community at the phyla level and genus level for the different sitesZoopagomycota: 捕虫霉亚门; Rozellomycota: 罗兹菌门; Mucoromycota: 毛霉菌门; Mortierellomycota: 被孢霉门; Glomeromycota: 球囊菌门; Chytridiomycota: 壶菌门; Basidiomycota: 担子菌门; Ascomycota: 子囊菌门; Trapelia: 褐边衣属; Helicoma: 蜗孢属; Russula: 红菇属; Dioszegia: 未命名; Trametes: 栓菌属; Xalocoa: 未命名; Bifiguratus: 未命名; Cyberlindnera: 塞伯林德纳氏酵母属; Mortierella: 被孢霉属; Alternaria: 链格孢属
使用Venn图来展示各样点及各区域共有和特有OTU数量,结果如图6所示,虽然各湖区间有水道连接,但共有OTU数量仅为36。各区域Venn图显示,羊卓雍错沿岸区(CY)OTU数最多,为961;其次为沉错沿岸区(CC),为667;空母错沿岸区(CK)OTU数也较多,为610;羊卓雍错湖心区OTU数则最少,为480。各区域共有OTU数为197,分别占羊卓雍错沿岸区(CY)OTU数的20.5%,空母错沿岸区(CK)OTU数的32.3%,沉错沿岸区(CC)OTU数的29.5%,羊卓雍错湖心区(YC)OTU数的41.0%。各区域间共有OTU数显示,羊卓雍错沿岸区(CY)与沉错沿岸区(CC)共有OTU比例最高,占两区域OTU数的46.0%;其次为空母错沿岸区(CK)与沉错沿岸区(CC),占两区域OTU数的45.4%;空母错沿岸区(CK)与羊卓雍错湖心区(YC)共有OTU比例则最低,为32.0%。
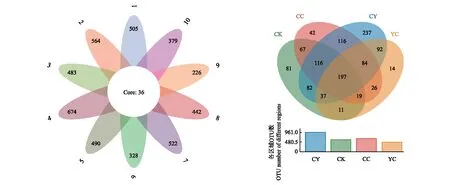
图6 各样点及各区域水体真菌OTU水平Venn图Fig.6 Venn diagram of aquatic fungal OTU levels in different sites and different regions
采用基于OTU水平Bray-Curtis距离的非度量多维尺度(NMDS,non-metric multidimensional scaling)分析以及采样点完全连接聚合聚类(completelinkage agglomerative clustering)得到不同湖区水体真核微生物群落结构组成(图7)。非度量多维尺度分析结果显示,不同湖区中的真核微生物群落分别聚为一类,ANOSIM检验组间差异显示,组间差异显著大于组内差异(R=0.772,P=0.001),说明分组合理,4个湖区真核微生物群落结构存在一定的差异。相比其他湖区所属样点,9号及10号样点虽同属羊卓雍错湖心区(YC),但真核微生物群落结构存在一定差异。完全连接聚合聚类结果显示,位于空母错和沉错连接处两侧的5号及7号样点真核微生物群落结构具有较高的相似性,而距两湖区连接处较远的6号及8号样点具有较高的相似性。
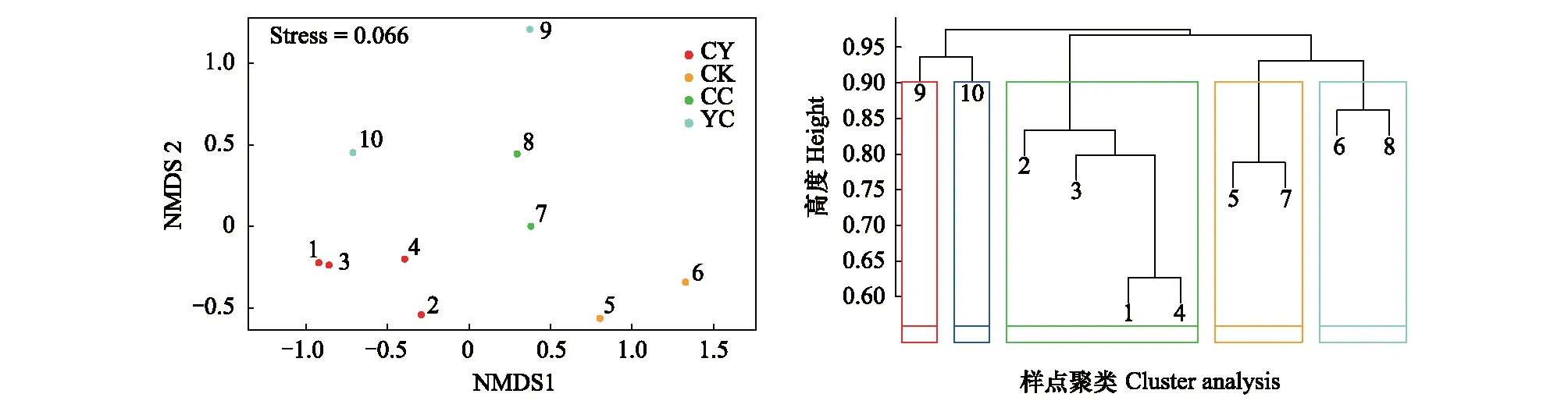
图7 基于Bray-Curtis 距离的非度量多维尺度(NMDS) 分析和采样点聚类Fig.7 Nonmetric multidimensional scaling (NMDS) and Cluster analysis plots using Bray-Curtis dissimilarity distance
2.4 羊卓雍错水体真菌多样性与水体理化因子的相关性分析

图8 羊卓雍错水体真菌α-多样性指数及水体理化因子Pearson相关性系数Fig.8 Pearson correlation coefficient between aquatic fungal α-diversity indexes and environmental factors in Yamzhog Yumco Lake*表示在P<0.05水平上显著; **表示在P<0.01水平上显著
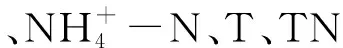
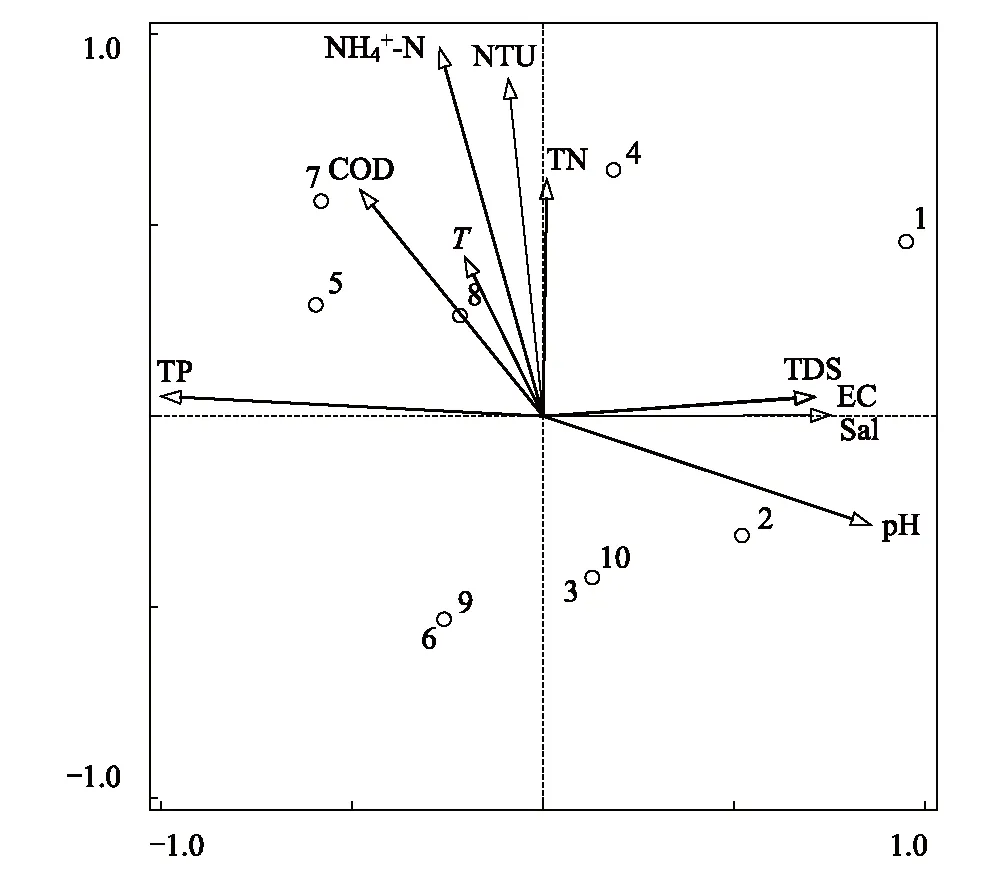
图9 羊卓雍错水体真菌与理化因子RDA分析排序图 Fig.9 RDA ordination diagram of aquatic fungal associated with environmental factors in Yamzhog Yumco Lake
3 讨论
真菌在水生生态系统中起着重要作用。文献显示,真菌在其生命周期中大量利用周围难以被其他生物利用的营养物质,并通过孢子及菌丝体进入水生生态系统食物链,其生命活动极大促进了水生生态系统物质循环,其群落结构及多样性也在一定程度上反映了湖泊水体的质量状况[35-36]。本研究的四个区域间虽有水体连接,但地理位置、补水方式以及人为活动方式的不同使得其水体理化性质存在较大差异。自2005年以来,羊卓雍错湖面蒸发加剧,湖面剧烈萎缩,湖水浓缩,致使羊卓雍错沿岸区及羊卓雍错湖心区pH、EC、TDS以及盐度均显著高于空母错沿岸区以及沉错沿岸区[21]。由于空母错主要由冰川融水补给,水面高度较羊卓雍错和沉错高,其湖水在丰水期补充羊卓雍错以及沉错[21],水体中溶解性物质随水流流出,造成空母错沿岸区EC、TDS以及盐度显著低于其他3个区域。就TP而言,羊卓雍错沿岸区显著低于空母错沿岸区及沉错沿岸区,这可能是由于羊卓雍错沿岸区分布有全世界海拔最高的抽水蓄能电站,抽取雅鲁藏布江河水以及下放羊卓雍错湖水的运作机制一定程度上稀释了羊卓雍错沿岸区的TP含量。

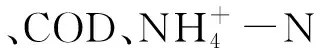
经Unite数据库比对后,被注释的真菌门包括:子囊菌门、被孢霉门、担子菌门、壶菌门、毛霉菌门、罗兹菌门、球囊菌门和捕虫霉亚门,其中子囊菌门、被孢霉门以及担子菌门是羊卓雍错各样点水体真菌的主要门类,子囊菌门以及担子菌门在各样点均有较多分布,其也是水体中常见的2个真菌门类[37],被孢霉门则主要分布于羊卓雍错沿岸区(1—4号样点)。被孢霉门多被发现于土壤中,是土壤真菌的常见门类[38]。鉴于羊卓雍错沿岸区为羊卓雍错主要旅游区域且1号及4号样点位于当地居民主要生产活动场所附近,大量的人为活动增加了土壤微生物群落与沿岸水体微生物群落交流的机会,这可能是被孢霉门在羊卓雍错沿岸区水体中大量分布的主要原因。就被注释的真菌属而言,羊卓雍错沿岸区4个样点中,1号及4号样点主要以Mortierella为主,而2号及3号样点则分别以Dioszegia和Xalocoa为主,Mortierella相对丰度较低,这可能是由于羊卓雍错水电站以及羊卓雍错观景台的设置一定程度上减少了土壤微生物群落与水体微生物群落的交流所造成的。Dioszegia为耐冷酵母,在冰冻圈广泛分布[39],但在本研究中仅在2号样点有大量分布,在其他样点则很少出现。2号样点位于羊卓雍错蓄能电站,推测Dioszegia是随雅鲁藏布江河水输入至羊卓雍错。相较于羊卓雍错沿岸区的其他样点,3号样点Xalocoa、Bifiguratus以及Helicoma相对丰度均较高,这可能是由于Mortierella相对丰度的降低为其他属微生物腾出生存空间所致。分析位于空母错的两个样点发现,5号及6号样点属水平组成较为相似,但5号样点Alternaria相对丰度为78.6%,占据绝对优势,6号样点水体真菌属水平分布则较为均匀。这可能是由于5号样点除TP外的各项营养元素均显著高于6号样点所致。从位于沉错的两个样点可以看出,7号及8号样点属水平组成差异较大,其中8号样点Alternaria相对丰度可以达到92.5%,郑保海等[40]研究发现,Alternaria丰度与水体温度呈极显著正相关,推测8号样点较高的水体温度使得Alternaria大量富集,限制了其他属微生物的生长,进而造成了这两个样点间水体真菌属水平的组成差异。 9号与10号样点同属羊卓雍错湖心区,其中10号样点位于雍布朵寺旁,为信教群众采集圣水处,靠近湖心小岛的地理位置加之频繁的采集圣水活动是导致10号样点属水平真菌组成区别于9号样点而接近沿岸区各样点的可能原因。就各样点真菌被注释情况而言,5号、6号、9号及10号样点在门水平和属水平存在大量未知类群。空母错主要由冰川融水补给,入湖河流对周边环境微生物资源存在富集作用,这可能是5号及6号样点存在大量未知真菌类群的原因。相较于沿岸区,湖心区营养物质含量及水体温度较低,更加恶劣的生存环境是9号及10号样点真核微生物多为未知类群的可能原因。

各区域间水体真菌群落结构差异明显,NMDS分析结果可以将各区域明显区分开,但相较于分属于其他区域的样点,分属于羊卓雍错湖心区的9号及10号样点间水体真菌群落结构差异较大,同样的结果在完全连接聚合聚类分析中也有所体现,这进一步说明了地理位置及人为活动对水体真菌群落结构具有较大影响。由于不同统计分析方法侧重不同,不同于NMDS分析所展现出的结果,完全连接聚合聚类分析显示,5号与7号样点间水体真菌群落结构具有较大的相似性,6号与8号样点间水体真菌群落结构具有较大的相似性。观察5号与7号样点地理位置可知,5号与7号样点分别位于连接空母错与沉错的河道两端,样点间水体真菌群落更大的交流频率是造成这种现象的可能原因。在完全连接聚合聚类分析中,羊卓雍错沿岸区的4个样点展现出不同程度的相似性,位于当地居民主要生产劳动场所附近的1号与4号样点水体真菌群落结构具有较高的相似性,位于羊卓雍错蓄能电站的2号样点与1号及4号样点间水生真菌群落结构则相似性较低。赵君等[41]研究发现,土地利用方式对袁河流域浮游细菌群落结构有显著影响,本研究结果一定程度上说明了人为干扰方式的不同对羊卓雍错沿岸区水体真菌群落结构的影响也不尽相同。
4 结论