磷酸盐转运蛋白OsPT4影响水稻氮磷积累与利用的机理研究
2021-11-18孙雅菲宋科秦秦孙丽娟薛永
孙雅菲 宋科 秦秦 孙丽娟 薛永
磷酸盐转运蛋白OsPT4影响水稻氮磷积累与利用的机理研究
孙雅菲#宋科#秦秦 孙丽娟 薛永*
(上海市农业科学院 生态环境保护研究所/上海市农业环境保护监测站/上海市设施园艺技术重点实验室,上海 201403;#共同第一作者;*通信联系人,E-mail:exueyong@163.com)
【】磷酸盐(Pi)转运蛋白OsPT4是水稻Pht1家族成员之一,负责Pi吸收以及向地上部的转运。探究超表达对不同Pi条件下水稻氮(N)和磷(P)积累与利用的影响及其机理具有重要意义。以日本晴背景的超表达株系为研究材料,通过设置正常供Pi与缺Pi的水培与桶培实验,检测生殖生长阶段不同组织中的相对表达量,探究不同Pi处理条件下不同组织(叶片、叶鞘、茎秆、稻壳、穗柄和糙米)中的N和P浓度,并计算Pi吸收率及N和P利用效率,同时分析株高、单株产量、千粒重和结实率等产量构成因素。在水稻生殖生长阶段的根系中相对表达丰度较高,超表达使水稻剑叶、叶鞘、茎秆、稻壳、穗柄和糙米中的总P浓度不同程度提高,并显著提高了不同Pi处理条件下的Pi吸收与利用效率。同时,的超表达可显著提高正常供Pi与缺Pi土壤条件下的单株产量与千粒重,以及缺Pi土壤中生长的结实率。除此之外,的超表达使缺Pi条件下瘪壳与糙米中总N浓度平均升高16.8%和19.8%,N利用效率平均升高6.6%。超表达不仅显著提高Pi吸收与利用效率,同时对不同Pi条件下的生理氮素利用率起促进作用。
磷;氮;;磷素利用率;氮素利用率
磷(phosphorus, P)是植物生长发育所必需的大量元素之一,也是制约水稻产量形成的重要因素。植物获取的磷形态主要包括三种可溶性磷酸根离子,即H2PO4−、HPO42−和PO43−[1, 2]。磷酸盐的化学特性导致其容易被酸性土壤中的铁铝氧化物以及石灰性土壤中的碳酸钙化合物等固定,难以被植株吸收和利用[3, 4]。水稻(L.)是供给世界一半以上人口的主要粮食作物。中国作为世界上水稻种植面积最大的国家,目前种植面积达3100万hm2,占全国粮食作物总种植面积的27.4%,产量约占全国粮食总产的36.1%,供全国60%人口食用[5]。然而,我国大约2/3的耕地土壤呈现缺磷状态,研究磷素利用率对提高水稻产量意义重大。
土壤中无机态磷(Pi)经细胞膜由根际进入植物体内的过程由多个磷转运蛋白共同完成[4, 6]。磷吸收动力学研究表明,植物中存在双重吸收系统。在高P条件下启动低亲和力转运系统,在低P条件下启动高亲和力转运系统,可见高亲合力磷酸盐转运蛋白有着在缺P条件下负责根系吸收P的功能。目前已有报道指出,植物编码磷酸盐转运蛋白的基因分为、、和四个基因家族[7]。迄今为止,植物中被克隆的磷酸盐转运蛋白基因大多属于家族。Pht1磷酸盐转运蛋白家族作为细胞膜上的H2PO4−/nH+共运体,是植物吸收与转运P的主要通道。双子叶植物拟南芥的Pht1家族中包含9个成员,均受缺P诱导,、、和只在根冠、根毛以及表皮等与土壤直接接触的细胞中表达[8, 9]。单子叶模式植物水稻中有13个(OsPT1~13)成员[7],除及受菌根特异诱导外,其他大多数成员受缺P诱导[10]。和在水稻根系吸收P的过程中起重要作用,其中后两者主要在根系中表达[11-14]。磷极度缺乏的环境,对P的获取与再分配起关键作用,与存在互作关系[15]。OsPT4作为高亲和磷酸盐转运蛋白,负责P的吸收与向地上部的转运,并显著促进种子胚发育[16]。在磷素由营养器官往生殖器官运输过程中发挥重要作用[17]。和受缺P胁迫强烈诱导,除了负责P吸收外,在P吸收过程中还存在功能冗余[18]。由此可见,尽管家族成员众多,但不同成员在P动态平衡中行使的功能各有不同。
氮(N)作为组成重要大分子(如核酸、蛋白质和叶绿素等)的关键成分,同样是植物生长不可或缺的大量元素[19]。近年来,植物中N和P互作研究受到人们的关注。控制N和P动态平衡的调控网络间普遍存在串联和互作关系。如拟南芥中两个基因(Nitrogen Limitation Adaption)和(Phosphate2)负责调控磷酸盐转运蛋白的运输,导致地上部磷素积累依赖于外界N供应[20-22],而HRS1将通过转录及转录后调控来控制硝酸盐与磷信号[23]。另外,在拟南芥中PHR1控制AtNIGT1/HRS1并通过硝酸盐转运蛋白NRT2.1调控硝酸盐转运[24, 25]。在水稻和小麦中,N平衡与稳态依赖于NRT1.1和PHR1/ PHL1共同参与的磷酸盐饥饿响应[26],磷信号抑制因子SPX4与细胞质PHR2互作,防止其转运至细胞核,并与硝酸盐传感器NRT1.1b相互作用[27, 28]。然而,作为磷酸盐传感器的Pht1家族成员对N动态平衡以及作物N利用效率的影响尚不清楚。
本研究以日本晴及其超表达株系为材料,一方面通过荧光定量PCR技术进一步细化编码磷酸盐转运蛋白的OsPT4在生殖生长阶段不同组织的时空表达模式,推理OsPT4的超表达在生殖生长期水稻各组织中的作用;另一方面通过创建的OsPT4超表达材料深入研究OsPT4的超表达对不同供磷条件下水稻产量、不同组织N和P的积累及其利用效率的影响,研究结果将为后续的氮磷协同高效利用并高产的水稻分子育种提供重要依据。
1 材料与方法
1.1 材料
供试材料为日本晴(wild type, WT,L. Nipponbare)及其超表达株系(南京农业大学资源与环境科学学院孙淑斌教授课题组提供)。
1.2 方法
1.2.1 营养液培养实验
水稻种子经30% NaClO震荡消毒30 min后用蒸馏水洗净,37℃恒温箱暗培3 d催芽,待种子露白后,将转基因株系转入25 mg/L潮霉素水溶液中筛选1周,2叶1心时,挑选长势良好且一致的水稻幼苗移栽入7 L中转箱,每箱16穴,每穴1株,用海绵固定在塑料泡沫板的孔中。以磷酸二氢钾为磷源,设置正常供磷(+P, 200 μmol/L)和缺磷(−P, 10 μmol/L)两种水培处理磷浓度,以正常供磷水平为准,低磷营养液中用KCl补充相对缺失的钾元素,其余营养成分配方包括NH4NO3(1.25 mmol/L),CaCl2(1 mmol/L),MgSO4(1 mmol/L),Na2SiO3(0.5 mmol/L),K2SO4(0.35 mmol/L),EDTA-Fe (20 µmol/L),H3BO3(20 µmol/L),MnCl2(9 µmol/L),ZnSO4(0.77 µmol/L),(NH4)6Mo7O24(0.39 µmol/L)以及CuSO4(0.32 µmol/L),pH调至5.5。培养温度及光照时长为白天16 h(30℃)/黑夜8 h(22℃)。光照强度为40 000 lx。正常供磷与缺磷处理时长为21 d,处理期间每3 d于下午4点更换营养液。
1.2.2 拷贝数鉴定方法
从叶片中提取的基因组DNA(100 μg)在37℃下用RⅠ和dⅢ消化过夜。然后将其在0.01 g/mL ()琼脂糖凝胶上分离,并转移到Hybond-N+尼龙膜上(Amersham)。在65℃下用地高辛(DIG)标记的潮霉素抗性基因()作为探针进行杂交。65℃下洗涤印迹,并使用感光成像仪(Typhoon 8600)进行分析。
1.2.3 土培实验
采6份土样消煮,测定土样总氮、总磷含量和C/N 比(分别为0.117 mg/g、9.872 mg/g和2.04 mg/g )。然后对土壤基质进行施肥处理,分别施40和160 mg/kg的KH2PO4,1个月后采用Olsen法测定土壤中的有效磷浓度,得到实际有效磷浓度为 13和36.8 mg/kg的土样,分别代表低磷和正常供磷水平。水稻种子经30% NaClO震荡消毒30 min后用蒸馏水洗净,37 ℃恒温箱暗培3 d催芽,待种子露白后,将三个转基因超表达株系转入25 mg/L潮霉素水溶液中筛选1周,2叶1心时,挑选长势良好且一致的水稻幼苗移栽进行桶培(10 kg土壤),每桶种植2株水稻,分别为野生型和三个不同的超表达材料各1株,每种处理设置5个重复。
1.2.4 农艺性状统计方法
在水稻完熟期,自水稻苗齐地面处至穗顶点测量株高。收获后通过调查主穗饱粒与瘪粒数计算结实率;并通过称重测量单株产量及千粒重。
1.2.5 荧光定量PCR
用营养液培养水稻野生型和3个超表达株系至21 d,分别取整个植株装入小自封袋中并立即放入液氮中,以备提取RNA。剩余样品放入−70 ℃冰箱内保存备用。RNA的提取及反转录获得cDNA的步骤参见张占田等[29]。
利用引物设计软件 Primer Premier 5设计实时PCR检测表达量所用引物(表1)。荧光PCR 条件均为20 μL反应体系,反应条件如下:95 ℃下变性3 min,然后95 ℃下10 s,60 ℃下10 s, 72 ℃下15 s,循环数40;72℃下充分延伸10 min。20 μL反应体系包括擎科qPCR试剂盒(2×TSINGKE Master qPCR Mix)10 μL,正向(F)引物和反向(R)引物(表1)各1 μL,cDNA 模板1 μL,无菌水7 μL。配制混合物充分混匀后平均分配至96孔PCR板中。反应条件如下:95 ℃下30 s,95 ℃下10 s,60 ℃下10 s, 72 ℃下15 s,40次循环;72 ℃下延伸5 min。设定在每个循环的变性期结束后,程序自动记录上一循环最后10%时间的平均荧光值。荧光种类选择SYBR Green 490。所有设定保存后运行程序,输入正确的 PCR体系的体积后开始运行。记录值,根据2−ΔCt方法计算分析定量结果[30]。

表1 OsActin和OsPT4的定量PCR序列
1.2.6 植株总磷含量测定及磷素吸收与利用效率计算
于水稻营养生长期及生殖生长期采集不同组织,在105℃下杀青30 min,70℃下烘干至恒重,随后样品经粉样机粉碎后混匀,各称取样品0.05 g置于100 mL消化管中,用浓H2SO4-H2O2混合消煮。待冷却后定容,用钼锑抗比色法,在722紫外可见分光光度计下于800 nm处比色测定[32]。
磷吸收效率=P/,其中P代表整个植株的吸磷量,代表根系干物质量[31]。磷利用效率计算方法:磷利用效率=/P,P代表地上部磷含量,代表地上部干物质量[32]。
1.2.7 植株总氮含量测定及生理氮素利用率计算
称取烘干磨碎后的植株样品0.5 g,放置于消煮管中,每个管中加入1 mL去离子水润湿样品,随后加入5 mL浓硫酸摇匀过夜。先在230℃下消煮30 min,等到消化管中烟雾升到管口时,再将温度升高到280℃继续消煮30 min,加入适量的H2O2,混匀样品直至澄清状态,再持续消煮10 min。等待消煮管冷却后定容样品到100 mL。总氮浓度用AA3单通道连续流动分析仪(德国Bran +Luebbe公司)测定。生理氮素利用率计算方法:=/。代表产量,代表施氮量,计算方法参考文献[33]。
1.2.8 数据统计与分析
采用SigmaPlot 12.0和SPSS 24进行数据分析。
2 结果与分析
2.1 OsPT4在水稻不同生长期的表达模式
利用荧光定量PCR检测日本晴野生型(WT)中在幼穗分化期(12周)和孕穗期(14周)不同组织器官中的相对表达量。如图1所示,在水稻(日本晴)中呈组成型表达。其中,在幼穗分化期,根系中的相对表达丰度最高,叶片中次之,其他组织(茎基部、叶鞘和未成熟穗)中相对表达量略低。在孕穗期,根系中的相对表达丰度依然最高。与根系中相对表达量相比,剑叶、剑叶叶鞘、倒2叶及倒2叶叶鞘中表达丰度次之,其他营养组织(茎基部)及繁育组织(花梗、花轴和小穗)中表达丰度较低。

数据均为平均数(n = 3)。
Fig. 1. Relative expression ofin different organs at different growth stages of rice.
2.2 OsPT4对水稻营养生长期磷素积累的影响
为研究超表达对水稻氮磷养分利用效率的影响,利用转基因技术获得多个的超表达株系,经Southern-blot鉴定拷贝数,选取3个单拷贝株系进行试验(图2-A)。经荧光定量PCR检测,3个超表达株系的相对表达量分别为WT的9.7、7.4及5.4倍(图2-B)。
将苗龄为10 d的WT和超表达株系(、和)分别移入正常供磷(+P)和缺磷(−P)营养液中处理21 d,统计不同株系地上部和根部干物质量。如图3所示,在+P条件下,、和地上部干物质量与野生型相比分别增加了19.5%、15.2%和9.3%,根部分别增加20.4%、19.3%和17%;在−P条件下,三个超表达株系的地上部干物质量分别增加了26.5%、21.6%和9.6%,根部分别增加8.6%、14.9%和12.8%(图3-A~B)。对全P含量检测发现,在+P和−P两种处理条件下,的超表达均显著提高水稻地上部及根部全磷含量(图3-C~D)。其中,+P条件下、和地上部全磷含量分别比野生型上升9.4%、14.3%和11.4%,根部分别增加27.7%、23.5%和19.1%;−P条件下超表达株系地上部全磷含量分别增加52.2%、38.5%和37.9%,而根部则分别增加15.4%、13.6%和13.1%。
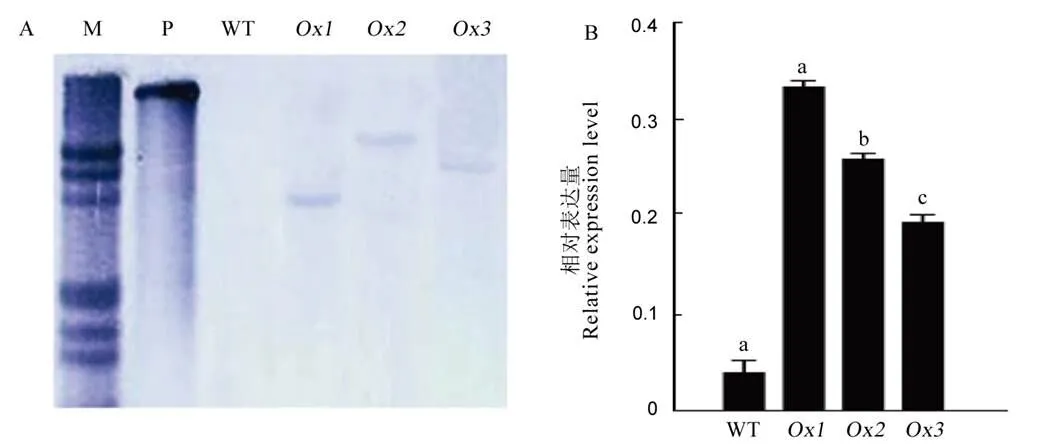
A-OsPT4超表达材料拷贝数鉴定;B-超表达材料中OsPT4的相对表达量。M代表标记物,P代表阳性对照。不同字母表示在5%水平上差异显著。WT-野生型;Ox1~ Ox3-三个超表达株系。数据均为平均数±标准差(n = 3);不同字母表示同一时期内各株系在0.05水平上差异显著。
Fig. 2. Molecular identification ofoverexpressing lines.
2.3 OsPT4对水稻磷吸收及利用效率的影响
与野生型相比,的超表达可显著提高各组织中总P含量(图4)。其中,与野生型相比,在+P土壤条件下,超表达株系的剑叶、叶鞘、茎秆、稻壳、穗柄和糙米中总P含量分别提高了12.9%、15.5%、17.1%、22.0%、56.3%和17.3%; −P土壤条件下,分别提高了61.4%、48.1%、53.6%、38.4%、61.0%和47.4%(图4)。
为了进一步研究在不同P环境下的超表达对水稻磷素的吸收与利用影响,我们统计并计算了超表达株系磷素吸收与利用效率。如图5所示,的超表达显著提高了+P及−P土壤条件下水稻磷素吸收与利用效率。
2.4 OsPT4对水稻植株形态、产量及其构成的影响
对+P和−P土壤条件下超表达株系的农艺性状(株高、单株产量、结实率和千粒重)的统计分析显示,−P土壤条件下的水稻各株系生长发育均受到不同程度的抑制,并且在两个P处理土壤条件下,超表达株系的长势均优于野生型(图6-A~B)。虽然超表达株系的株高与野生型相比均出现矮化(图6-C),但单株产量均显著上调,在+P和−P条件下、和的单产分别平均升高7%和9.1%(图6-D)。的超表达并没有使+P条件下的结实率显著增加,但却使−P条件下的水稻结实率平均增加10.6%(图6-E)。另外,与野生型相比,超表达株系的千粒重在+P和−P条件下分别平均升高9.3%和10.7%(图6-F)。

数据均为平均数(n = 4);不同字母表示同一时期内各株系在0.05水平上差异显著。下同。
Fig. 3. Overexpression of OsPT4 increases the biomass and total P concentration under both +P and −P conditions during vegetative growth stage.
Fig. 4. Overexpression offacilitates the P accumulation of rice under both +P and −P soil conditions during reproductive growth stage.
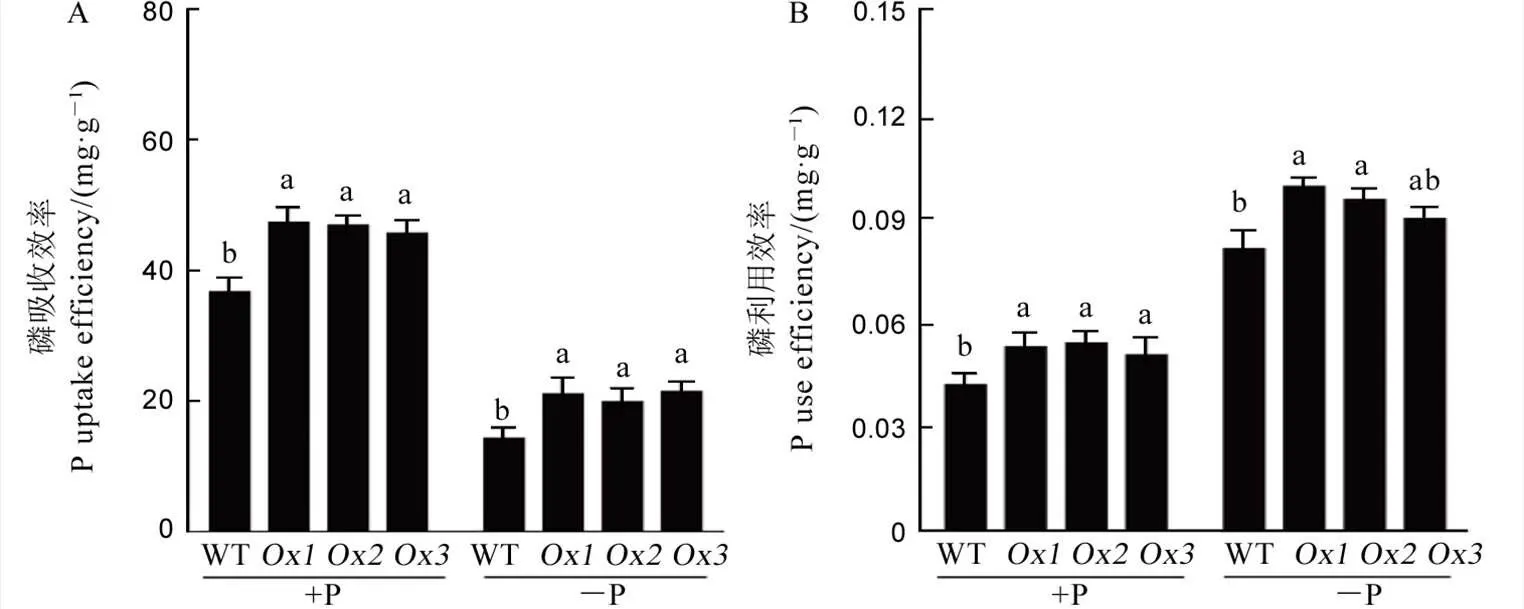
图5 OsPT4的超表达提高正常供磷和缺磷土壤条件下水稻磷吸收及利用效率
Fig. 5. Overexpression offacilitates the Pi uptake and use efficiency of rice under both +P and −P soil conditions.

图6 OsPT4超表达材料在正常供磷与缺磷土壤中的农艺性状分析
Fig. 6. Phenotype ofoverexpressing lines grown in +P and −P soil conditions.
2.5 OsPT4对水稻磷素和氮素利用率的影响
在+P条件下,超表达株系瘪壳中的总氮含量与WT无显著性差异,而糙米中的总氮含量比野生型平均高8.5%。−P条件下的超表达导致瘪壳及糙米中总氮含量均显著升高,其中瘪壳平均增加16.8%,糙米中的平均上升19.8%(图7-A)。与WT相比,在−P条件下,的超表达使生理氮素利用率显著升高(图7-B);然而在+P条件下,两者无显著性差异。
3 讨论
已有报道显示,为高亲和磷酸盐转运蛋白,负责磷素的吸收与向地上部的转运[16]。定量与组织定位结果表明,在根部的表达明显强于地上部叶片,在生殖生长阶段,在胚中的表达较为强烈,而在胚乳和穗柄中的表达较弱[16]。本研究对水稻幼穗分化期和孕穗期表达模式的检测也印证了其在根系中表达量最高的结果,这一表达模式特点与其他几种磷酸盐转运蛋白家族基因也十分相似(、、和)[12, 15, 17]。同时,繁育器官(包括未成熟小穗、花梗、花轴和小穗)中的相对表达量较低(图1),这说明孕穗期及幼穗分化期可能主要行使根系从土壤中吸收P的功能,而非P向繁育器官的转运。
在作物生长发育过程中,由于P易于固定在土壤中,且利用效率非常低,P饥饿已成为提高作物产量和改善质量的主要限制因素之一[34]。前期研究证明,对水稻营养生长期根系对P的吸收起促进作用,且同时负责磷素由根部向地上部的转运,其超表达可显著提高+P和−P条件下根系和地上部的总P及无机态P含量[16, 35]。对超表达株系在不同P处理水培条件下的总P检测也证实了这一结果(图3)。然而,目前对在生殖生长阶段不同P土壤环境下对水稻P动态平衡,及其对该时期P吸收与利用效率的影响仍知之甚少。对生殖生长期超表达材料在不同P处理土壤条件下不同组织中总P含量的检测发现,无论是+P还是−P条件下,的超表达均可提高营养组织和繁育组织中的总P积累(图4)。这些结果说明不仅可以促进+P土壤环境下水稻生殖生长阶段各组织中的P积累,同时也可增加−P环境下各组织中的P积累。同时,研究发现可以促进+P和−P土壤环境下的P吸收与利用效率(图5)。可见在水稻生育后期P的吸收与利用过程中起重要作用。已知的超表达促进+P土壤条件下的单株产量、千粒重以及胚的发育[16]。本研究结果显示,不仅可以增加+P条件下单株产量及千粒重,还可增加−P条件下的结实率、单株产量及千粒重(图6)。由此可推断,提高水稻在−P土壤中P的积累及利用效率,促进了繁育器官的发育,增加−P条件下的水稻产量。
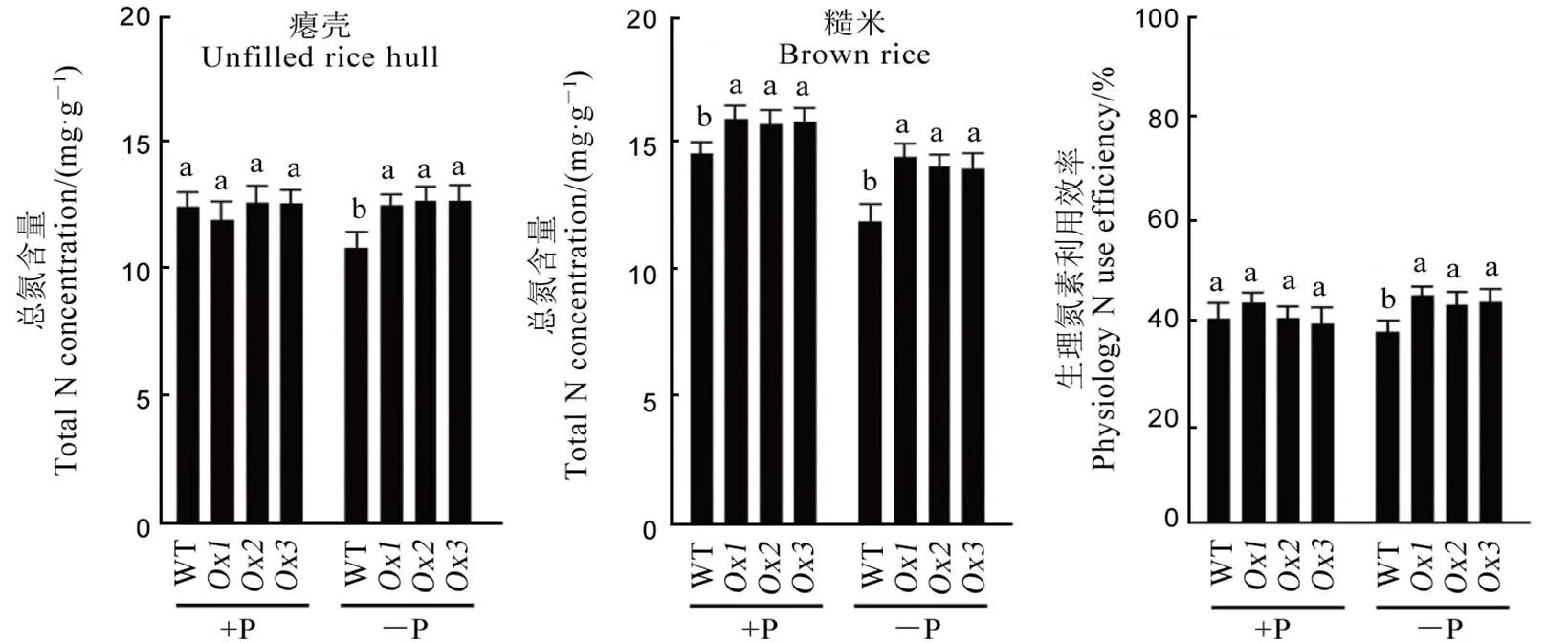
图7 正常供磷和缺磷土壤中OsPT4超表达材料繁育器官总氮含量及水稻生理氮素利用率
Fig. 7. Total N concentration in reproductive tissues and physiology N use efficiency ofoverexpressing lines under both +P and −P soil conditions.
P和N是植物生长发育的两种最重要的大量营养元素。近年来,N和P养分间的互作受到人们的关注。在拟南芥、水稻和玉米中,N缺乏可改变P中心转录因子PHR1半衰期及其积累,从而影响P的调控通路[21, 23, 25, 26, 28]。虽然磷酸盐转运蛋白参与N和P互作通路,但其对不同P条件下N利用的影响尚未可知。本研究显示,在水稻生殖生长阶段,的超表达可显著提高−P条件下瘪壳中以及+P与−P条件下籽粒中的总氮含量,并可使−P条件下生理氮素利用率明显上调(图7)。由此可见,作为高亲和磷酸盐转运蛋白,对水稻−P条件下的氮素利用率同样具有促进作用。这一结果为水稻N和P的互作关系及互作调控网络的完善提供了理论依据。综合以上结果可知,的超表达在协同促进水稻P的吸收与利用以及−P土壤条件下的N利用中具有十分重要的应用价值,也说明在水稻依赖于外界P供应的N素调控网络中可能行使重要功能,这一部分的机理研究仍有待于进一步深入。
[1] Mimura T. Regulation of phosphate transport and homeostasis in the plant cells [J]., 1999, 191: 149-200.
[2] Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use: Critical adaptations by plants for securing a nonrenewable resource [J]., 2003, 157: 423-447.
[3] Schachtman D P, Reid R J, Ayling S M. Phosphorus uptake by plants: From soil to cell [J]., 1998, 116: 447-453.
[4] Raghothama K G. Phosphate acquisition [J]., 1999, 150: 665-693.
[5] 朱德峰, 张玉屏, 陈惠哲, 向镜, 张义凯. 中国水稻高产栽培技术创新与实践. 中国农业科学, 2015, 48: 3404-3414.
Zhu D, Zhang Y, Chen H, Xiang J, Zhang Y K. Innovation and practice of high-yield rice cultivation technology in China., 2015, 48: 3404-3414. (in Chinese with English abstract).
[6] Smith F W, Mudge S R, Rae A L, Donna G. Phosphate transporter in plants [J]., 2003, 248: 71-83.
[7] Gu M, Chen A, Sun S, Xu G. Complex regulation of plant phosphate transporters and the gap between molecular mechanisms and practical application: What is missing? [J]2016, 9: 396-416.
[8] Poirier Y, Bucher M. Phosphate transport and homeostasis in[J]., 2002, (1): e0024.
[9] Remy E, Cabrito T R, Batista R A, Teixeira M C, Sá-Correia I, Duquel P. The Pht1; 9 and Pht1;8 transporters mediate inorganic phosphate acquisition by theroot during phosphorus starvation [J]., 2012, 195: 356-371.
[10] Paszkowski U, Kroken S, Roux C, Briggs S P. Rice phosphate transporters include an evolutionarily divergent gene specifically activated in arbuscular mycorrhizal symbiosis[J]., 2002, 99: 13324-13329.
[11] Sun S, Gu M, Cao Y, Huang X, Zhang X, Ai P, Zhao J, Fan X, Xu G. A constitutive expressed phosphate transporter, OsPht1;1, modulates phosphate uptake and translocation in phosphate-replete rice[J].,2012, 159: 1571-1581.
[12] Ai P, Sun S, Zhao J, Fan X, Xin W, Guo Q, Yu L, Shen Q, Wu P, Miller A J, Xu G. Two rice phosphate transporters, OsPht1;2 and OsPht1;6, have different functions and kinetic properties in uptake and translocation [J]., 2009, 57: 798-809.
[13] Zhang F, Wu X, Zhou H, Wang D, Jiang T, Sun Y, Cao Y, Pei W, Sun S, Xu G. Overexpression of rice phosphate transporter geneenhances phosphate uptake and accumulation in transgenic rice plants [J]., 2014, 384: 259-270.
[14] Liu F, Wang Z, Ren H, Shen C, Li Y, Ling H-Q, Wu C, Lian X, Wu P. OsSPX1 suppresses the function of OsPHR2 in the regulation of expression ofand phosphate homeostasis in shoots of rice [J]., 2010, 62: 508-517.
[15] Chang M X, Gu M, Xia Y W, Dai X L, Dai C R, Zhang J, Wang S C, Qu H Y, Yamaji N, Ma J F, Xu G H. OsPHT1;3 mediates uptake, translocation and remobilization of phosphate under extremely low phosphate regimes [J].2019, 179: 656-670.
[16] Zhang F, Sun Y, Pei W, Jain A, Sun R, Cao Y, Wu X, Jiang T, Zhang L, Fan X, Chen A, Shen Q, Xu G, Sun S. Involvement of OsPht1;4 in phosphate acquisition and mobilization facilitates embryo development in rice [J]., 2015: 82, 556-569.
[17] Jia H F, Ren H Y, Gu M, Zhao J, Sun S, Zhang X, Chen J, Wu P, Xu G. The phosphate transporter gene OsPht1;8 is involved in phosphate homeostasis in rice [J]., 2011, 156: 1164-1175.
[18] Wang Y F, Pineros M A, Wang Z Y, Wang W X, Wang W, Li C, Wu Z, Kochian L V, Wu P. Phosphate transporters OsPHT1;9 and OsPHT1;10 are involved in phosphate uptake in rice [J].2014, 37: 1159-1170.
[19] Marschner H. Mineral Nutrition of Higher Plants[M]. London: Academic Press, 1995.
[20] Peng M, Hannam C, Gu H, Bi Y M, Rothstein S J. A mutation in NLA, which encodes a RING-type ubiquitin ligase, disrupts the adaptability ofto nitrogen limitation [J].2007, 50: 320-337.
[21] Kant S, Peng M, Rothstein S J. Genetic regulation by NLA and microRNA827 for maintaining nitrate dependent phosphate homeostasis in[J]., 2011, 7: e1002021.
[22] Lin W Y, Huang T K, Chiou T J. NITROGEN LIMITATION ADAPTATION, a target of MicroRNA827, mediates degradation of plasma membrane-localized phosphate transporters to maintain phosphate homeostasis in[J]., 2013, 25: 4061-4074.
[23] Medici A, Marshall-Colon A, Ronzier E, Szponarski W, Wang R, Gojon A, Crawford N M, Ruffel S, Coruzzi G M, Krouk G. AtNIGT1/HRS1 integrates nitrate and phosphate signals at theroot tip [J]., 2015, 6: 6274.
[24] Kiba T, Inaba J, Kudo T, Ueda N, Konishi M, Mitsuda N, Takiguchi Y, Kondou Y, Yoshizumi T, Ohme-Takagi M, Matsui M, Yano K, Yanagisawa S, Sakakibara H. Repression of nitrogen starvation responses by members of theGARP-type transcription factor NIGT1/HRS1 subfamily[J].2018, 30: 925-945.
[25] Maeda Y, Konishi M, Kiba T, Sakuraba Y, Sawaki N, Kurai T, Ueda Y, Sakakibara H, Yanagisawa S. A NIGT1-centred transcriptional cascade regulates nitrate signaling and incorporates phosphorus starvation signals in[J].,2018, 9: 1376.
[26] Medici A, Szponarsk W, Dangeville P, Safi A, Dissanayake I M, Saenchai C, Emanuel A, Rubio V, Lacombe B, Ruffel S, Tanurdzic M, Rouached H, Krouk G. Nitrogen actively controls the phosphate starvation response in plants [J]., 2019, 31: 1171-1184.
[27] Lv Q, Zhong Y, Wang Y, Wang Z, Zhang L, Shi J, Wu Z, Liu Y, Mao C, Yi K, Wu P. SPX4 negatively regulates phosphate signaling and homeostasis through its interaction with PHR2 in rice [J]., 2014, 26: 1586-1597.
[28] Hu B, Jiang Z, Wang W, Qiu Y, Zhang Z, Liu Y, Li A, Gao X, Liu L, Qian Y, Huang X, Yu F, Kang S, Wang Y, Xie J, Cao S, Zhang L Wang Y, Xie Q, Kopriva S, Chu C. Nitrate-NRT1.1B-SPX4 cascade integrates nitrogen and phosphorus signaling networks in plants [J]., 2019, 5: 401-413.
[29] 张占田, 孙雅菲, 艾昊, 罗闻真, 冯冰, 孙文献, 徐国华, 孙淑斌. 水稻转录因子基因的时空表达特征及其在营养生长中的调控 [J]. 中国水稻科学, 2018, 32: 427-436.
Zhang Z T, Sun Y F, Ai H, Luo W Z, Feng B, Sun W X, Xu G H, Sun S B. Expression patterns and regulation of transcription factor genein vegetative growth in rice [J]., 2018, 32: 427-436. (in Chinese with English abstract).
[30] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-method [J].2001, 25: 402-408.
[31] Elliott G C, Lauchli A. Phosphorus efficiency and phosphate iron interactions in maize [J]., 1985, 77: 399-403.
[32] Siddiqi M Y, Glass A D M.Utilization index: A modified approach to the estimation and comparison of nutrient utilization efficiency in plants [J].1981, 4: 289-302.
[33] Fan X, Tang Z, Tan Y, Zhang Y, Luo B, Yang M, Lian X, Shen Q, Miller A J, Xu G. Overexpression of a pH-sensitive nitrate transporter in rice increases crop yields [J].2016, 113: 7118-7123.
[34] Lynch J P. Root phenes for enhanced soil exploration and phosphorus acquisition: Tools for future crops [J]. Plant, 2007, 156: 1041-1049.
[35] Ye Y, Yuan J, Chang X, Yang M, Zhang L. The phosphate transporter gene OsPht1; 4 is involved in phosphate homeostasis in rice [J].2015,10: e0126186.
Research on the Mechanisim of OsPT4 Regulating the Accumulation and Utilization of Nitrogen and Phosphorus in Rice
SUN Yafei#, SONG Ke#, QIN Qin, SUN Lijuan, XUE Yong*
(Shanghai 201403, China; These authors contributed equally to this work; Corresponding author: E-mail, exueyong@163.com)
【】The phosphate (Pi) transporter, OsPT4, is a member of the Pht1 family of rice, responsible for Pi uptake and transportation. It is important to explore the effect ofoverexpression on nitrogen (N) and phosphorous (P) accumulation and utilization in rice under different Pi conditions and its mechanism. 【】The-overexpressing lines with Nipponbare background were used as material. Through the hydroponic and pot-cultivated experiments with (+Pi) or without Pi (−Pi) supply, the relative expression ofin different tissues during reproductive growth stage was detected. The N and P concentrations in different tissues (leaf blade, leaf sheath, stem, rice hull, panicle axis and brown rice) under different Pi treatments were also measured. In addition, the Pi absorption rate and N/P use efficiency were calculated, and the plant height, yield per plant, 1000-grain weight and seed setting rate were analyzed. 【】The relative expression ofwas higher in rice roots during reproductive growth stage. Overexpression ofincreased the total P concentration in rice flag leaf blade, leaf sheaths, stems, rice hull, panicle axis and brown rice to varying degrees, and significantly improved the Pi absorption and use efficiency under different Pi regimes. Meanwhile,overexpression could significantly increase the yield per plant, 1000-grain weight and seed setting rate in +Pi and −Pi soils. In addition, the overexpression ofalso increased the total N concentration in unfilled rice hull and brown rice by 16.8% and 19.8%, and the N use efficiency by 6.6% under Pi-deficiency. 【】The overexpression ofnot only promotes the Pi uptake and use efficiency, but also facilitates the physiology N use efficiency in different Pi conditions.
phosphorus; nitrogen;; phosphorus use efficiency; nitrogen use efficiency
10.16819/j.1001-7216.2021.200803
2020-08-03;
2020-12-04。
上海市青年英才扬帆计划资助项目(19YF1443200);上海市科技兴农重点攻关项目[沪农科推字(2020)2-1];国家青年自然科学基金资助项目(31902102);上海市农业科学院国家自然科学基金匹配项目[生科创-GT2020(匹配-3)];上海市农业科学院卓越团队计划资助项目[2017(A-03)]。
