供铁水平对杉木幼苗叶片叶绿素荧光参数和抗氧化酶活性的影响
2021-11-18伍丽华代林利胡永颜费裕翀叶义全陈爱玲曹光球
伍丽华,代林利,胡永颜,费裕翀,叶义全,3,陈爱玲,曹光球,3*
(1.福建农林大学 林学院,福建 福州 350002;2.福建省沙县官庄国有林场,福建 沙县 365500;3.国家林业和草原杉木工程技术研究中心,福建 福州 350002;4.福建农林大学 资源与环境学院,福建 福州 350002)
【研究意义】铁是植物生长发育中所必须的重要营养元素之一,直接参与植物光合作用、呼吸作用、蛋白质的合成等重要生物学过程,但当土壤中铁的积累达到植物耐受的极限,便会阻碍植物的生长发育,造成毒害作用[1]。本文以改良霍格兰完全营养液为培养液,通过模拟生物培养的方法,分析杉木幼苗叶叶绿素含量、叶绿素荧光以及酶活性对不同供铁水平的响应,研究结果为杉木林高效培育奠定理论参考依据。【前人研究进展】唐建军等[2]的研究显示,水稻(Malus domestica)在铁胁迫条件下,生物量积累减少,叶片中叶绿素含量和根系活力显著降低。李向婷[3]和梁剑等[4]的研究同样表明,油橄榄(Olea euro⁃paea)幼苗在受到铁胁迫时,随着胁迫浓度和胁迫时间的增加,过氧化氢酶、多酚氧化酶和超氧化物歧化酶等抗氧化酶活性呈现先上升后下降的趋势,丙二醛含量则不断上升,表明当油橄榄受到的铁胁迫浓度超过其耐受范围时,会大量积累活性氧自由基,造成叶片膜脂过氧化和膜损伤。研究普遍认为Fe2+是植物所吸收利用铁的主要形态,其含量的高低决定着铁有效性的高低,其中土壤pH、氧化还原电位值是影响铁有效性最为重要的因子[5]。【本研究切入点】杉木(Cunninghamia lanceolate)是我国南方最重要的针叶速生造林树种,种植面积已达17×106hm2,占全国人工林面积的24.0%和世界人工林面积的6.5%,对林业的生产和开发具有至关重要的作用[6-7]。南方山地红壤为富铁铝化的酸性土壤,且随着工业的发展及杉木纯林连栽,南方杉木人工林土壤pH 呈逐渐下降的趋势[8-11]。较低的pH 值使得红壤中沉积铁的溶解度提高,造成土壤中Fe2+的过量积累,杉木的生长发育可能受到潜在的铁毒害作用。目前,国内外学者对于杉木土壤中铁元素研究大多数集中在全铁上[12-13],对于土壤中Fe2+对杉木的毒害效应[14]研究较少,因而加强Fe2+对杉木毒害的内在机制研究显得尤为重要和迫切。
植物在长期的进化过程中,为缓解逆境所带来的胁迫损伤,自身形成了一套保护酶系统,通过增强抗氧化酶活性提升抗氧化作用,从而提高对逆境的抗性,防止活性氧自由基毒害植物[13-16]。叶片叶绿素含量以及叶绿素荧光参数等指标对于环境变化较为敏感,反映了植株本身对于环境胁迫的应答反应[17]。目前越来越多的学者倾向于从杉木叶片保护酶系统、光合及叶绿素荧光特性的角度探究杉木对于环境胁迫的响应机制[18-20]。【拟解决的关键问题】本论文针对杉木培育过程中存在的潜在铁毒害这一问题,以1 年生杉木幼苗为研究对象,通过室内沙培试验,以不同Fe2+浓度的改良霍格兰营养液为培养液,分析不同培养时间杉木幼苗叶片丙二醛含量、抗氧化酶活性、叶绿素含量及叶绿素荧光特性等指标的变化,研究结果可揭示杉木在Fe2+胁迫环境下的生理防御机制,为杉木人工林的合理经营管理提供理论依据。
1 材料与方法
1.1 材料来源
试验地位于福建农林大学国家林业草原杉木工程技术研究中心田间实验室大棚内(26°09′N,119°27′E),属于中亚热带季风湿润气候,年平均气温23 ℃,地区年降水量1 600~1 900 mm,雨季多集中在3—9 月份,全区日照时间为1 668~1 972 h,无霜期达326 d。供试杉木幼苗为福建省尤溪国有林场提供的同一家系1 年生实生苗,平均地径为(0.54±0.06)cm,平均苗高为(19.30±1.24)cm,平均冠幅为(27.4±1.86)cm。
1.2 试验设计
2018 年4 月中旬,挑选生长一致、无病虫害杉木幼苗作为试验用苗。培养桶摆放采用完全随机区组设计,3 个随机区组,每个随机区组4 个小区,每个小区对应1 个处理。依据前人测定的南方杉木人工林不同层次土壤有效铁含量平均值作为参考值[10,21-23],试验添加液配制以霍格兰完全营养液为母液,分别添加不同量的FeSO4·7H2O,使培养液Fe2+浓度分别为20(T1),30(T2),40 mg/kg(T3)(其中30 mg/kg 处理为南方杉木林土壤有效铁含量),共3 个处理,以不加FeSO4·7H2O 的霍格兰完全营养液为对照(CK)。
幼苗培养方式为沙培培养。用纯水洗净杉木幼苗根系后,将苗木移入装有纯水的培养桶中培养2 d,再置于Hoagland 完全营养液中缓苗7 d。缓苗结束后,将杉木移入装有相同质量沙为培养基质的培养桶(直径20 cm、四周涂成黑色的塑料桶(V=4 L))中,所选的沙为河沙,经过3 mm 孔筛过掉滤较大的杂质,然后将过滤后的沙子放入20%的硫酸浸泡2 h 去除有机物质,再用纯水冲洗至沙子pH 呈中性,干燥之后放入培养桶中,随后加入相应的培养液进行培养[27],每个处理加培养液2.5 L。每个处理3 个重复,每个重复12 桶,每桶种植2 株杉木幼苗,共种植杉木288 株。培养液高于沙表面约5 cm。每隔2 d 加入少量纯水,使各处理培养液保持原有水平。试验期间每天06:00 和18:00 各通气一次,每次通气时间为30 min。处理时间为60 d,分别在处理第15,30,45,60 天时进行采样,用消毒过的剪刀剪取杉木幼苗上部高度一致的完全展开的健康新叶进行各项生理指标的测定,试验重复3 次。

表1 Hoagland-Arnon完全营养液配方Tab.1 Formula of Hoagland-arnon complete nutrient solution
1.3 测定方法
叶绿素含量采用丙酮-无水乙醇提取法[25],称取0.05 g 鲜叶剪碎置于试管中,再加入反应液放于25 ℃环境中暗处至颜色变白,最后于663,645 nm波长测定吸光度。相关计算公式有:
叶绿素a 浓度(mg/g)=12.7A663-2.69A645,叶绿素b 浓度(mg/g)=22.9A645-4.68A663,叶绿素含量=叶绿素浓度×0.005 L/0.05 g。杉木叶片叶绿素荧光参数采用PAM-2500 便携式叶绿素荧光仪(德国)测定,测定前叶片暗适应30 min,分别记录初始荧光F0和最大荧光Fm,并计根据公式Fv/Fm=(Fm-F0)/Fm,Fv/F0=(Fm-F0)/F0计算影响参数。
杉木叶片多酚氧化酶(PPO)活性的测定采用邻苯二酚法,过氧化物酶(POD)活性的测定采用愈创木酚法,超氧化物歧化酶(SOD)活性的测定采用氮蓝四唑(NBT)光化还原法来,过氧化氢酶(CAT)活性的测定采用紫外吸收法,丙二醛(MDA)含量的测定采用硫代巴比妥酸(TBA)[26-28]。
1.4 数据处理
采用Excel 2010对试验数据进行整理及制表,运用SPSS软件进行单因素方差分析。
2 结果与分析
2.1 铁胁迫对杉木幼苗叶绿素含量的影响
光合作用是植物合成有机物的重要途径,而叶绿素是参与植物光合作用的主要物质,叶绿素含量的高低反映着植物光合能力的强弱,是指示植物生长发育的重要指标之一。从表2分析可知,随着培养时间的延长,同一处理上的叶绿素a、叶绿素b和叶绿素a+b含量均呈现上升趋势,CK、T1、T2处理上的叶绿素a含量在不同时间上均达显著性差异(P<0.05),而叶绿素b、叶绿素a+b、叶绿素a/b 含量在不同处理天数上无一致显著性规律。当培养60 d 时铁浓度处理的叶绿素a、叶绿b 和叶绿素a+b 的含量与15 d 时相比分别提高了62.16%~94.12%、58.33%~92.67%、33.33%~119.15%,而叶绿素a/b含量则表现出下降趋势,其中培养60 d 时铁浓度处理较15 d 时相比,叶绿素a/b 含量降低了1.12%~16.45%;就同一培养时间不同处理差异而言,随着铁浓度增加,叶绿素b 和叶绿素a+b 含量呈现先升高后降低的趋势,而叶绿素a/b 含量则呈现相反趋势,表现出先降低后升高。在15 d时,T1、T2、T3叶绿素含量均与CK 处理间未达显著性差异(P>0.05),在45 d、60 d时,T1、T2、T3叶绿素a含量均与CK处理间达显著性差异(P<0.05),其余处理时间上,T1、T2、T3 叶绿素含量与CK 处理间无明显同一的差异性。在处理60 d 时,相比于CK 处理下,T1、T2 和T3 处理叶绿素a 含量分别下降了16.46%、26.58%和38.71%,叶绿素b 含量分别下降19.35%、25.81%和27.93%,叶绿素a+b 含量分别下降了7.21%、24.32%和23.55%。叶绿素a/b 比值在处理期间均以T3 处理最高,其处理下的叶绿素a/b 比值相比于CK、T1 和T2 处理分别提高了23.55%、20.75%和24.03%,且差异达到显著水平(P<0.05)。
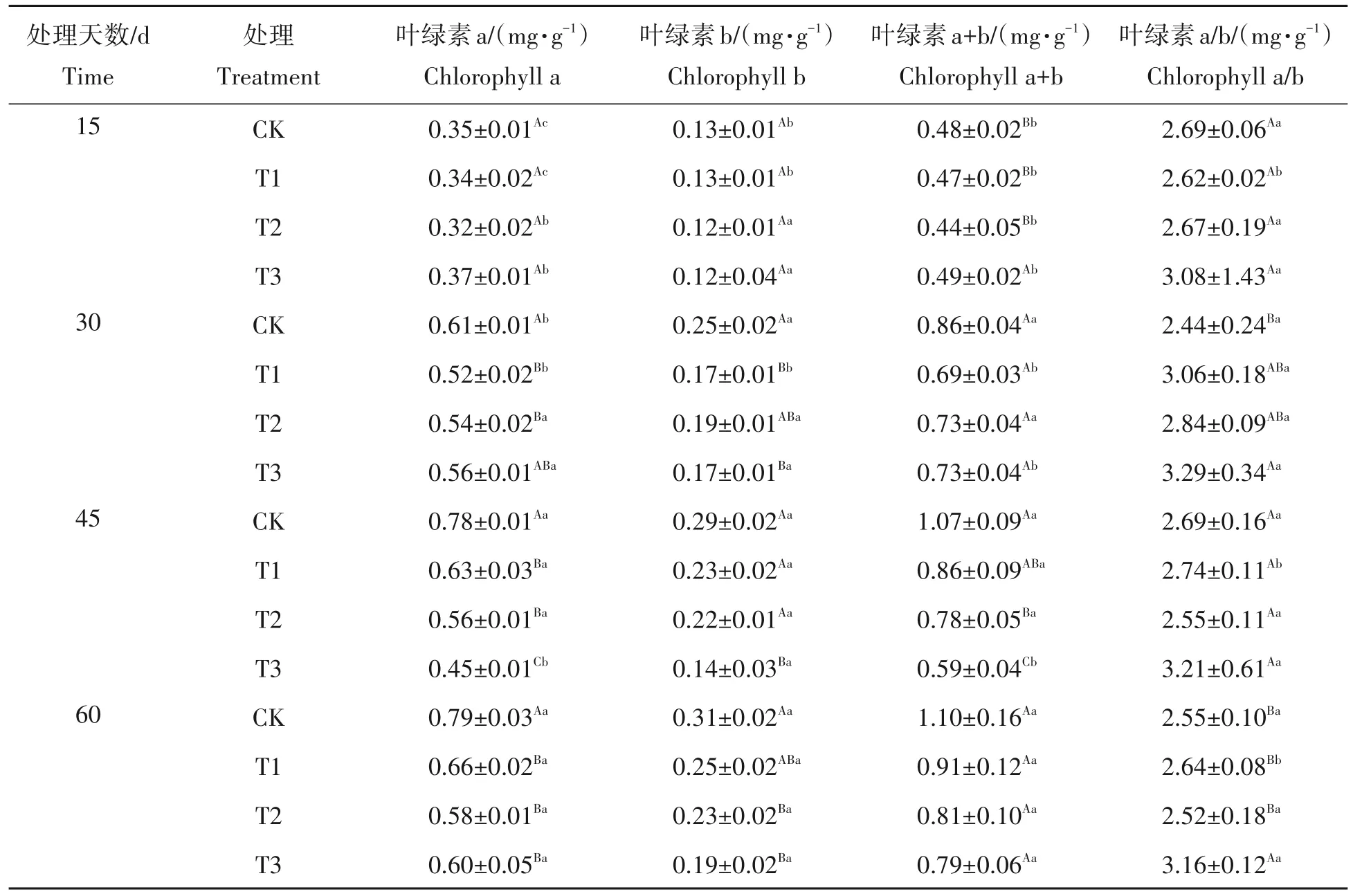
表2 铁胁迫对杉木幼苗叶绿素含量的影响Tab.2 Effect of iron stress on chlorophyll content of Cunninghamia lanceolate seedlings
2.2 铁胁迫对杉木幼苗叶绿素荧光特性的影响
叶绿素荧光参数指示着植物叶片光系统对光能的吸收、传递、耗散和分配,通过对叶绿素荧光参数的分析可以明确植物生长和受逆境胁迫的生理状态,F0为初始荧光,Fm为最大荧光,Fv/Fm、Fv/F0和Fm/F0分别代表PSⅡ最大光化学效率、潜在活性和捕获激发能的效率,是研究植物胁迫的重要参数。表3 分析可知,就同一处理不同培养时间而言,随着培养时间的延长,CK 和T1 处理下的F0含量均表现降低的趋势,而T2、T3 处理则表现出相反的趋势,随培养时间延长含量升高。CK、T1、T3 处理下的Fm表现为随培养时间延长,呈现先降低后升高的趋势,T2 处理则一直呈现升高的趋势。CK 与T1 处理上的Fv/Fm均表现为先降低后升高,在60 d 时又降低的趋势,T2、T3 处理则表现为先降低后升高的趋势。CK、T1、T2、T3 处理下的Fv/F0值均表现为先降低后升高的趋势,Fm/F0值在T3 处理上表现一直降低的趋势。随着培养时间的延长,处理下的F0、Fm、Fv/Fm、Fv/F0和Fm/F0无显著的差异性。当培养至60 d 时铁浓度处理的F0值相较于15 d 处理相比,T1、T2、T3 处理分别提高了14.31%、12.88%、13.15%,其余处理无显著的变化规律。就同一培养时间不同处理差异而言,随着铁浓度的增加,F0不断升高,Fm、Fv/Fm、Fv/F0和Fm/F0则不断下降,其中各处理间的F0和Fv/Fm未达显著差异(P>0.05)。在处理30 d时,CK 处理下的Fm、Fv/F0和Fm/F0与T1、T2 和T3 处理差异最大,均达到显著水平(P<0.05),且相比于CK 处理,T1、T2 和T3 处理下的Fm分别下降了23.28%、25.74%和31.24%,Fv/F0分别下降了30.49%、36.12%和48.38%,Fm/F0分别下降了25.95%、30.76%和41.25%。总体而言,在试验期间随者处理时间的增加,F0不断上升,而Fm和Fv/Fm在各个处理时间差异较小,相比于处理15 d 时,各处理下的Fv/F0和Fm/F0相对较低。

表3 铁胁迫对杉木幼苗叶绿素荧光的影响Tab.3 Effect of iron stress on chlorophyll fluorescence of Cunninghamia lanceolate seedlings
2.3 铁胁迫对杉木幼苗保护酶活性及MDA含量的影响
从表4 可知,就同一处理不同培养时间而言,随着培养时间的延长,CK、T1、T2、T3 处理下的MDA表现为先降低后升高,在60 d 处理上又表现降低的规律,而POD 活性表现为相反的趋势,随培养时间的延长呈现先升高后降低,在60 d 上又表现为升高的规律,SOD 活性均表现为先降低后升高的趋势,在60 d 时间上值最大。PPO 活性在不同处理上无明显一致变化规律。当培养60 d 的CK、T1、T2、T3 处理上的MDA 含量、SOD、PPO 活性与15 d 相比分别降低了45.10%、47.80%、37.01%、19.01%;4.47%、16.87%、1.81%、1.25%;22.07%、67.39%、78.89%、73.65%;而培养60 d 的CAT、POD 活性与15 d相比分别升高了33.93%、70.93%、171.92%、105.06%;22.82%、24.52%、26.61%、11.33%。在60 d 时间上CK 处理下的MDA 含量均低于其它处理。不同培养天数上,CK 处理下的保护酶活性及MDA 含量均未达显著性差异(P>0.05),T1、T2、T3 处理下的SOD、POD 活性在不同培养时间上也未达显著性差异(P>0.05),T1、T2、T3 处理在不同培养时间下的PPO 活性与15 d 间达显著性差异(P<0.05)。就同一培养时间不同处理差异而言,不同铁浓度处理的MDA 含量均表现出高于CK 处理,且不同处理间未达显著性差异(P<0.05)。CAT 活性则以CK 处理最高,处理15 d 时,CK 处理下的CAT 活性显著高于其它处理,相比于CK,T1、T2 和T3 处理分别降低了43.12%、48.02%和47.63%,且此时期不同铁浓度处理与CK 处理间均达显著性差异(P<0.05)。随着铁浓度升高,CAT 活性整体上呈现先降低后升高的趋势。SOD 和PPO 活性同样以CK 处理最高,相比于CK,T1、T2 和T3 处理分别降低了4.32%、4.32%、7.78%;15.66%、15.88%、4.41%。其中PPO 活性并未随着处理浓度的提升表现出一致的规律,在30 d、45 d、60 d 时,不同铁浓度处理的PPO 活性与CK 处理间均达显著性差异(P<0.05)。SOD 活性在试验期间随处理浓度的提升不断降低,CK 处理下的SOD 活性在处理期间,与其它处理间差异均未达到显著水平(P>0.05)。不同处理间POD 活性差异则未有较为一致的规律,且在试验期间差异均未达到显著水平(P>0.05)。
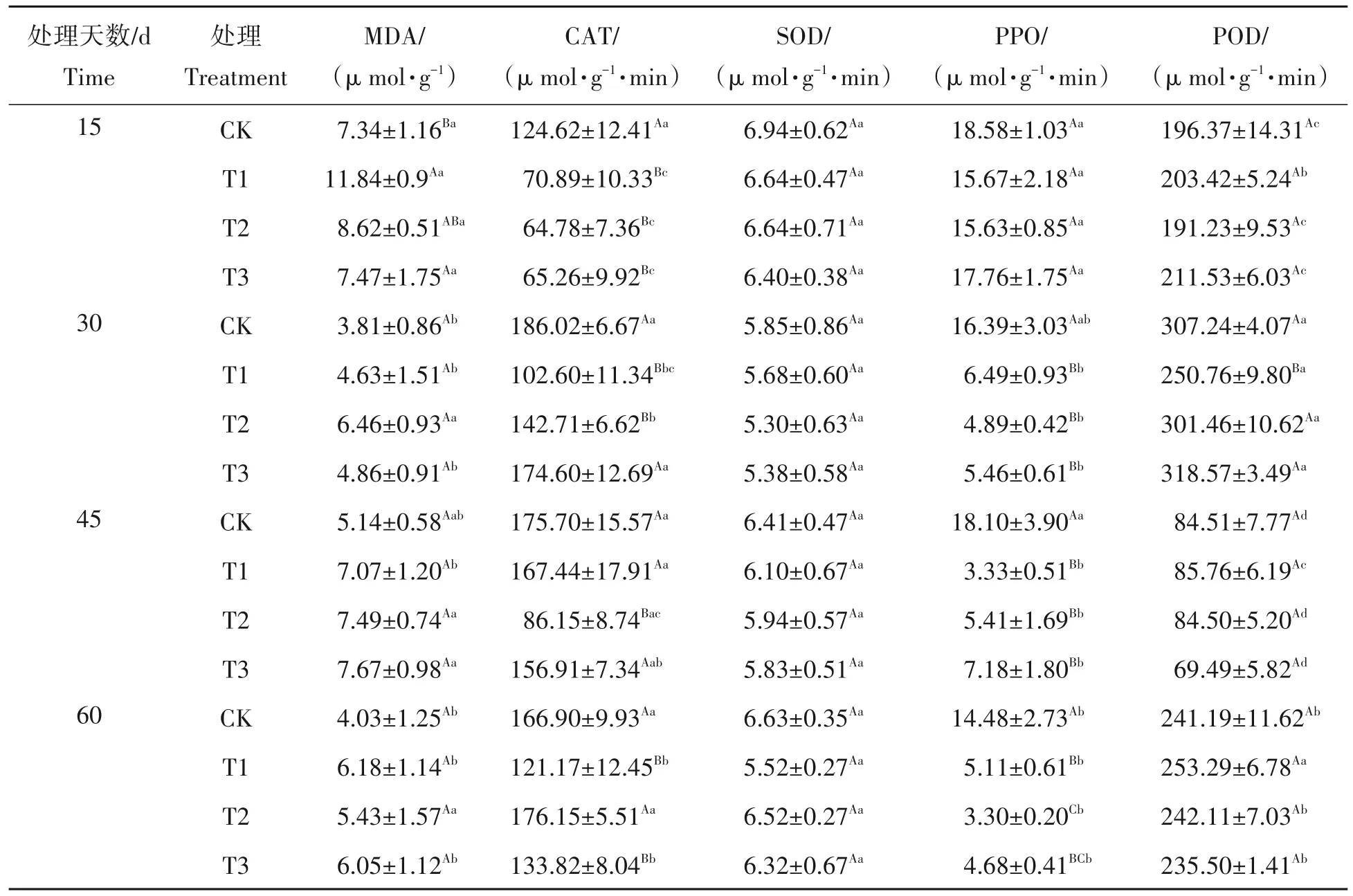
表4 铁胁迫对杉木幼苗保护酶活性及MDA含量的影响Tab.4 Effects of iron stress on protective enzyme activity and MDA content of Cunninghamia lanceolate seedlings
3 结论与讨论
光合作用是植物生长过程中重要的生理反应,其效率高低可直接反映植物的生长状况,当植物处于逆境胁迫时,植物对环境的抗逆性和本身生长状况的变化会影响植物光合作用过程[29-30]。叶绿素含量作为反映叶片光合能力重要指示,是植物对光能的吸收、传递、转化的重要场所[31],当植物处于胁迫时,叶绿素水解酶活性升高,导致叶绿素合成过程减弱,加速了其分解,会影响叶绿素含量变化[32-33]。铁作为叶绿素合成所必须的重要元素组成成分,对维持叶绿素的结构和功能具有重要的作用[34],本试验结果显示,在处理15 d 时,各处理间的叶绿素a、叶绿b 和叶绿素a+b 的含量无明显差异,而处理15 d 后均以CK处理含量最高,且叶绿b和叶绿素a+b的含量具有随处理浓度增加而不断下降的变化趋势。这可能是由于处理前期杉木幼苗自身的应激系统和酶系统使其正常代谢活动仍保持较为稳定的水平,而随着处理时间和处理浓度的增加,幼苗自身的调节系统无法抵抗外界的胁迫。赵燕等[35]研究亚铁离子对水稻生长发现,当环境中的铁元素浓度过高时,植物根系吸收过量Fe2+输送至各个器官中,而进入叶片中的离子则会累积至叶绿体中,产生大量的自由基,从而氧化分解叶片中的叶绿素,使叶绿素含量降低[36],与本文研究结果一致。由此可见,当营养液中铁的含量过高时,将导致叶绿素含量降低,不利于叶片光能的吸收,从而最终阻碍杉木幼苗的光合作用,降低其生物量的积累。值得注意的是,杉木幼苗叶片叶绿素a/b比值在处理期间,T3 处理最高,显著高于其它处理,表明该浓度处理下铁胁迫对叶绿素a和b的影响具有显著差异,Sun 等[37]认为叶绿素a 对金属胁迫要敏感于叶绿素b,且杨颖丽等[38]研究不同铁浓度对小麦叶片叶绿素影响也发现,中高浓度的铁胁迫对叶绿素a 含量显著减少,而对叶绿素b 含量影响不明显。本试验中,随培养时间延长,不同浓度处理上叶绿素a含量变化灵敏,无同一规律可言。随着处理时间的增长,除45 d、60 d时,T2处理的杉木幼苗叶片叶绿素a/b比值均要低于CK 处理,其余时间上加铁浓度的处理均要高于CK,呈现这种规律可能是在T3铁浓度时,指示着类囊体的垛叠程度加大,具有缓解光抑制作用,是杉木幼苗应对铁胁迫的一种自我调节机制[39]。
叶绿素荧光可直观反映光合作用过程对光能的吸收、分配以及消耗等反应,能体现出植物受胁迫的情况[40]。当植物受到胁迫时,会破坏叶绿体光合机构,抑制PSⅡ活性并降低PSⅡ原初光能转换效能[41]。所以,叶绿素荧光动力学方法可以快速、灵敏、无损伤探测逆境对植物光合作用的影响。本研究中随着处理浓度的增加,F0不断升高,Fm、Fv/Fm、Fv/F0和Fm/F0则不断下降。闫芳等[42]研究不同盐浓度处理下的黄瑞香叶片发现,随着盐浓度增加,其F0值显著升高,而最大荧光(Fm)、Fv/Fm、Fv/F0则表现显著降低的规律,与本文研究一致。F0表示不参与PSⅡ光化学反应的光辐射部分,F0表明营养液中过高的铁含量致使杉木叶片PSⅡ的部分失活或伤害。植物在吸收的光能超过所利用的能量时,会启动非光合能量的耗散途径来耗散过剩的激发能以保护光合机构免受伤害[43-44],Fm、Fv/Fm、Fv/F0和Fm/F0不断下降则可能指示着叶片PSⅡ的电子传递能力变弱,光能利用率降低,PSⅡ潜在活性受到抑制,PSⅡ的反应中心的原初光能转换效率降低,抑制了光合作用的原初反应。
正常情况,植物在生长发育中所产生的活性氧自由基在保护酶的清除作用下,始终保持着一定的动态平衡,可作为有益的信号分子参与植物生理反应的调控[45],而在遭到胁迫时,该平衡的失衡导致活性氧大量产生,膜脂过氧化,膜系统被破坏,使离子外泄,从而扰乱细胞的正常代谢给植物体造成损伤[29]。MDA 作为植物膜脂过氧化的产物,其含量反映着细胞膜系统受损程度,含量越高,表明细胞受损害程度越大[46]。本研究表明除处理15 d 时T1 处理下的MDA 含量低于CK 处理,其它处理天数铁浓度处理下的MDA含量均高于CK处理,可见当营养液中铁的含量过高时,会导致杉木叶片膜脂过氧化,阻碍其叶片细胞的正常新陈代谢。研究结果与罗红艳等[13]对杉木幼苗叶片在铝胁迫下MDA含量的变化一致。为了应对因胁迫引起的氧化损伤,植物体内形成了一系列抗氧化体系,在维持植物体内活性氧的平衡,缓解植物在胁迫环境中的损伤上起着重要的作用[47],SOD、POD和CAT为植物体细胞重要的抗氧化酶,能通过协同作用避免细胞受氧化损伤。SOD 是植物体内主要的抗氧化酶,可将产生的活性氧歧化为H2O2与O2,H2O2在POD、CAT 酶的作用下被分解为H2O 和O2,有效阻止了膜脂氧,在植物遭遇轻微胁迫时,其活性往往出现提升,这是植物自身所应对逆境的生理机制[27]。在本试验中CAT、SOD和PPO活性均以CK处理最高,与其他研究结果有所差异[3-4]。本研究酶活性并未出现上升,而始终低于CK 处理可能是由于杉木幼苗对铁的浓度耐受范围较低,试验中所设置的铁处理浓度已然超过杉木幼苗的耐受极限,自身保护酶体系难以消除铁胁迫对正常代谢所造成的破坏。此外,铁在植物体内的移动性较差,通过生理代谢活动排出植物体外难度较高可能是另一重要原因。其中CK 处理下的PPO 活性在处理期间与其他处理间差异均达到显著水平,可见其视作指示杉木遭受铁毒害的重要指标。而不同处理间POD 活性差异则未有较为一致的规律,且在试验期间差异均未达到显著水平,这可能表明在杉木幼苗遭受铁胁迫时,POD 酶的功能并未受到明显阻碍。
综上所述,杉木幼苗无论从保护酶活性、叶绿素含量,还是从叶绿素荧光参数值的变化上,都表明营养液中铁含量过高时导致杉木幼苗的正常生理代谢过程受到较大阻碍。有研究表明,不同叶龄的叶片对于铁胁迫的抗性不同,新叶铁含量低,对于铁的耐性较低。本研究中供试材料为当年生叶,当营养液铁浓度达到40 mg/kg时,叶片叶绿素a和b受到铁胁迫影响显著,说明杉木林地土壤中Fe2+的积累浓度小于40 mg/kg 才有利于植物生长发育。研究目前仅从杉木内在生理的角度去探究铁对其的胁迫作用,未来可进一步从分子的角度探究杉木对于铁的运输、吸收及其防御机制,从而更好地以杉木营养学的角度为室内杉木幼苗的培养和施肥提供理论依据。
