miR-25-3p靶向NF2对恶性外周神经鞘瘤细胞增殖、迁移及侵袭的影响
2021-11-18陈少军宜昌市第一人民医院神经外科宜昌443099通讯作者mailangua1031aliyuncom
汤 华,陈少军(宜昌市第一人民医院神经外科,宜昌 443099;通讯作者,E-mail:angua1031@aliyun.com)
恶性外周神经鞘瘤(malignant peripheral nerve sheath tumour,MPNST)是一种罕见的软组织恶性肿瘤,起源于外周神经分支和神经鞘膜[1,2]。目前,手术切除是治疗MPNST的主要手段,但MPNST的高度侵袭性、早期转移和易复发等临床特征极大缩短了患者的预期寿命[3]。因此,寻找新的治疗靶点,抑制肿瘤细胞的增殖、侵袭和迁移能力对开发靶向治疗MPNST药物具有临床研究意义。微小RNA(microRNA,miRNA)是19-24个核苷酸的非编码RNA,与癌症的发生发展密切相关[4]。Ning等[5]研究显示,靶向抑制miR-25-3p表达能够显著抑制胃癌细胞的增殖、侵袭和迁移,但miR-25-3p对MPNST细胞的影响及其作用机制尚不明确。因此,本研究旨在探索miR-25-3p过表达对MPNST细胞系ST88-14增殖、迁移及侵袭的影响,并初步研究其与2型神经纤维瘤(neurofibromatosis 2,NF2)基因的靶向调控作用,为临床提供参考依据。
1 材料与方法
1.1 主要材料与仪器
恶性外周神经鞘瘤ST88-14细胞购自中国典型培养物保藏中心;RPMI-1640培养基、DMEM培养基、磷酸盐缓冲液(PBS)、胎牛血清、噻唑蓝(3-(4,5-dimethyl-2-thiazolyl)-2,5-diphenyl-2-H-tetrazolium bromide,MTT)试剂、胰蛋白酶消化液(0.25%)、Trizol试剂盒、RIPA裂解液、逆转录试剂盒、Matrigel胶、ECL发光液(北京Solarbio,货号10491、12100、P1022、11011-8611、M8180、T1350、15596-018、R0010、T2210-200T、356234、PE0010);miR-25-3p inhibitor、miR-25-3p NC由广州市锐博生物科技有限公司设计合成;miR-25-3p、U6、NF2、β-肌动蛋白(β-actin)引物均由上海生工生物工程有限公司合成;Merlin兔抗人多克隆抗体、β-actin小鼠抗人单克隆抗体、山羊抗兔lgG(H+L)二级抗体、山羊抗小鼠lgG(H+L)二级抗体(美国Thermo Fisher Scientific,货号PA5-96130、AM4302、A32731、A32723);PCR仪(德国Eppendorf公司,型号5333型);凝胶成相仪(北京麦思奇高科技有限公司,型号MSD-2000A);二氧化碳细胞培养箱(美国Thermo Fisher Scientific,型号BBD6220);酶标仪(美国Bio-Rad,型号ELX-8081U);倒置显微镜(日本Nikon,型号MA100N)。
1.2 方法
1.2.1 细胞培养 将购买的ST88-14细胞置于37 ℃、5%CO2环境中培养孵化6-8 h,胰酶消化、离心(1 200 r/min,5 min),用预热的RPMI-1640培养基重悬后,分装进培养瓶,于37 ℃、5%CO2环境中培养,培养至3-5代后,部分保种,部分继续培养、传代,收集后用于后续实验。
1.2.2 细胞分组及转染 取1.2.1培养的ST88-14细胞,接种于6孔板上(1×105个/孔),待细胞汇合至80%左右,随机分为对照组(不做任何处理)、miR-25-3p inhibitor组(转染miR-25-3p inhibitor)、miR-25-3p NC组(转染miR-25-3p NC)。按照转染说明书步骤分别用无血清DMEM培养基稀释的miR-25-3p inhibitor储存液、miR-25-3p NC储存液与lipo2000转染液对应处理以上各组ST88-14细胞,转染4 h,对照组不做任何转染处理,更换为DMEM完全培养基继续培养24 h,收集用于后续实时荧光定量(qPCR)实验检测转染ST88-14细胞中miR-25-3p的相对表达量,MTT法检测转染ST88-14细胞的活性,Annexin Ⅴ-FITC/PI实验检测转染ST88-14细胞的凋亡能力,划痕实验检测转染ST88-14细胞的迁移能力,Transwell侵袭实验检测转染ST88-14细胞的侵袭能力,蛋白免疫印迹分析实验检测靶基因Merlin表达情况。
1.2.3 实时荧光定量(qPCR)实验检测转染ST88-14细胞中miR-25-3p的相对表达量 收集1.2.2各组细胞,分别加入Trizol裂解液,提取总RNA,逆转录得cDNA,-20 ℃保存备用。以各组cDNA为模板,对各组miR-25-3p、NF2进行PCR扩增。PCR反应条件设置:95 ℃预变性3 min,95 ℃变性20 s,58 ℃退火30 s,62 ℃延伸30 s,以上步骤进行40次循环。以U6、β-actin为内参,计算各组miR-25-3p、NF2 mRNA相对表达量。miR-25-3p、NF2、U6、β-actin引物序列见表1。
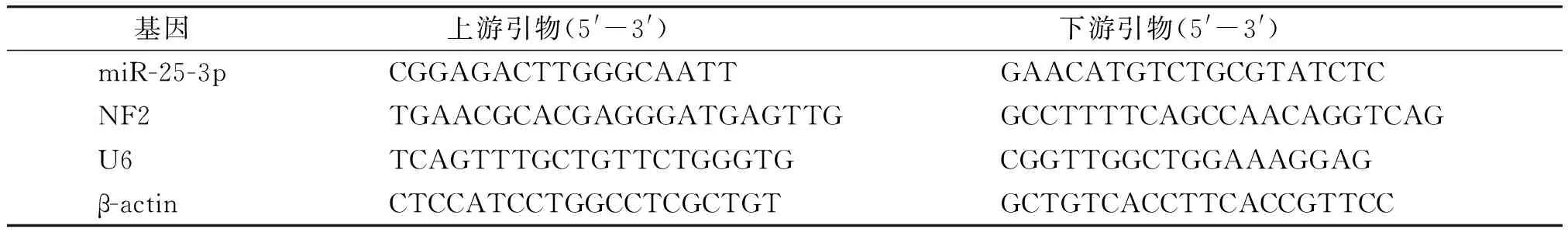
表1 miR-25-3p、NF2、U6和β-actin引物序列Table 1 Primer sequences of miR-25-3p, NF2, U6 and β-actin
1.2.4 MTT法检测转染ST88-14细胞的活性 收集1.2.2各组ST88-14细胞,接种至96孔板(5×103个/孔),每组设置6个复孔,培养24 h。每孔加入20 μl 5 mg/ml MTT溶液,孵化4 h,弃去培养液,每孔添加150 μl DMSO,摇床震荡10 min(37 ℃),利用酶标仪在波长570 nm下测量各组吸光值(OD值),并计算存活率。细胞存活率=实验孔OD值/空白对照孔OD值×100%。
1.2.5 Annexin Ⅴ-FITC/PI实验检测转染ST88-14细胞的凋亡能力 胰酶(不含EDTA)消化收集1.2.2各组ST88-14细胞,PBS洗涤2次,离心(1 000 r/min,5 min),用500 μl Binding Buffer悬浮各组细胞后,加入10 μl Annexin Ⅴ-FITC和10 μl PI,充分混匀,室温避光静置10 min,流式细胞仪检测细胞凋亡率,以上每组设置6个复孔,凋亡率(%)=凋亡早期细胞比例+凋亡晚期细胞比例。
1.2.6 划痕实验检测转染ST88-14细胞的迁移能力 收集1.2.2中各组ST88-14细胞,调整细胞悬液密度为6×105个/ml,接种于6孔板上,每孔2 ml,每组设置6个复孔,待细胞融合至90%左右,用200 μl枪头轻轻划痕,培养24 h,以上每组设置6个复孔。显微镜下观察并记录各组ST88-14细胞迁移情况,使用Image J处理,计算划痕愈合率。愈合率=(0 h划痕距离-24 h划痕距离)/0 h划痕距离×100%。
1.2.7 Transwell侵袭实验转染ST88-14细胞的侵袭能力 收集1.2.2各组ST88-14细胞,用无血清培养基调整细胞浓度为1×106个/ml,取200 μl加入预铺设Matrigel稀释液的上室中,另取500 μl含血清的培养基加入下室,孵育24 h。取出小室,4%多聚甲醛固定后(25 min),染色25 min,显微镜下随机选取不同视野观察、拍照并计数,计算侵袭细胞数均值。以上每组设置5个复孔。
1.2.8 蛋白免疫印迹分析实验检测靶基因Merlin蛋白表达情况 用预冷的PBS漂洗1.2.2各组细胞2次,每组设置6个复孔,加RIPA低温裂解,离心(12 000 r/min,20 min)收集上清蛋白样品。利用8% SDS-PAFE胶电泳,转膜后,5%脱脂牛奶封闭4 h(37 ℃),依次加入一抗Merlin、β-actin(1 ∶1 000),4 ℃孵化过夜。洗膜并加入二抗,孵化1.5 h。曝光显影,观察条带并记录。用Image-J处理各组图片,以β-actin为内参,计算Merlin/β-actin比值。
1.2.9 双荧光素酶报告基因检测实验验证靶向关系 再次培养ST88-14细胞,接种于24孔板上(2.5×105个/孔),按照1.2.2中方法将1 μg野生型NF2 3′-非翻译区(3′-untranslated region,3′-UTR)质粒(NF2-3′UTR-WT)载体和突变型NF2 3′非翻译区质粒(NF2-3′UTR-MUT)载体与miR-25-3p NC、miR-25-3p inhibitor分别转染,依次作为:NF2-3′UTR-WT+miR-25-3p NC组、NF2-3′UTR-WT+miR-25-3p inhibitor组、NF2-3′UTR-MUT+miR-25-3p NC组及NF2-3′UTR-MUT+miR-25-3p inhibitor,每组设置6个复孔,培养24 h,测定各组ST88-14细胞荧光素酶活性。
1.3 统计学方法
2 结果
2.1 各组细胞miR-25-3p表达水平情况
与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞miR-25-3p表达水平显著降低,差异有统计学意义(P<0.05,见图1)。
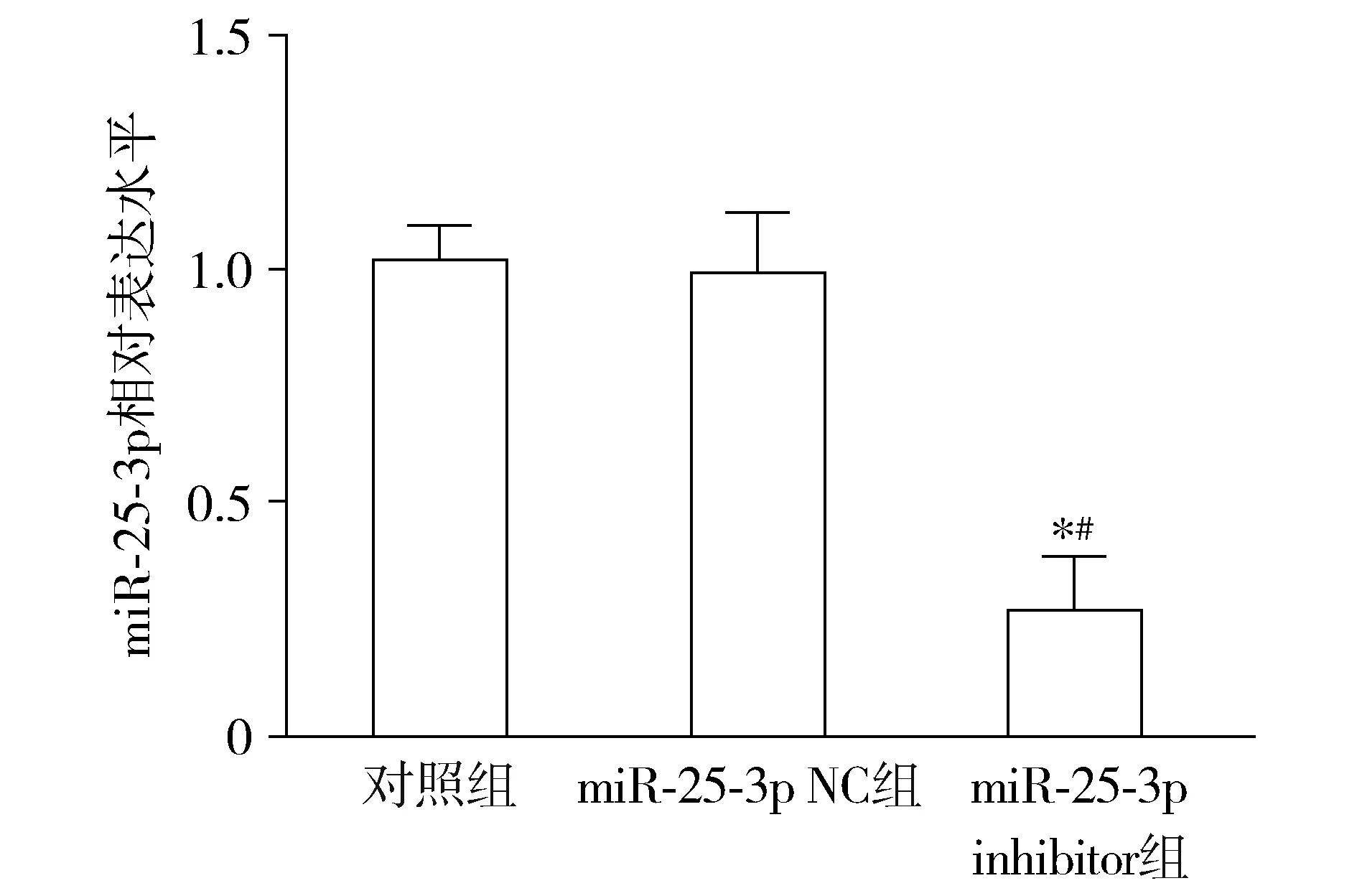
与对照组相比,*P<0.05;与miR-25-3p NC组相比,#P<0.05图1 各组细胞miR-25-3p相对表达量Figure 1 Relative expression of miR-25-3p in each group
2.2 miR-25-3p inhibitor转染对ST88-14细胞存活率的影响
与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞存活率显著降低,差异有统计学意义(P<0.05,见图2)。
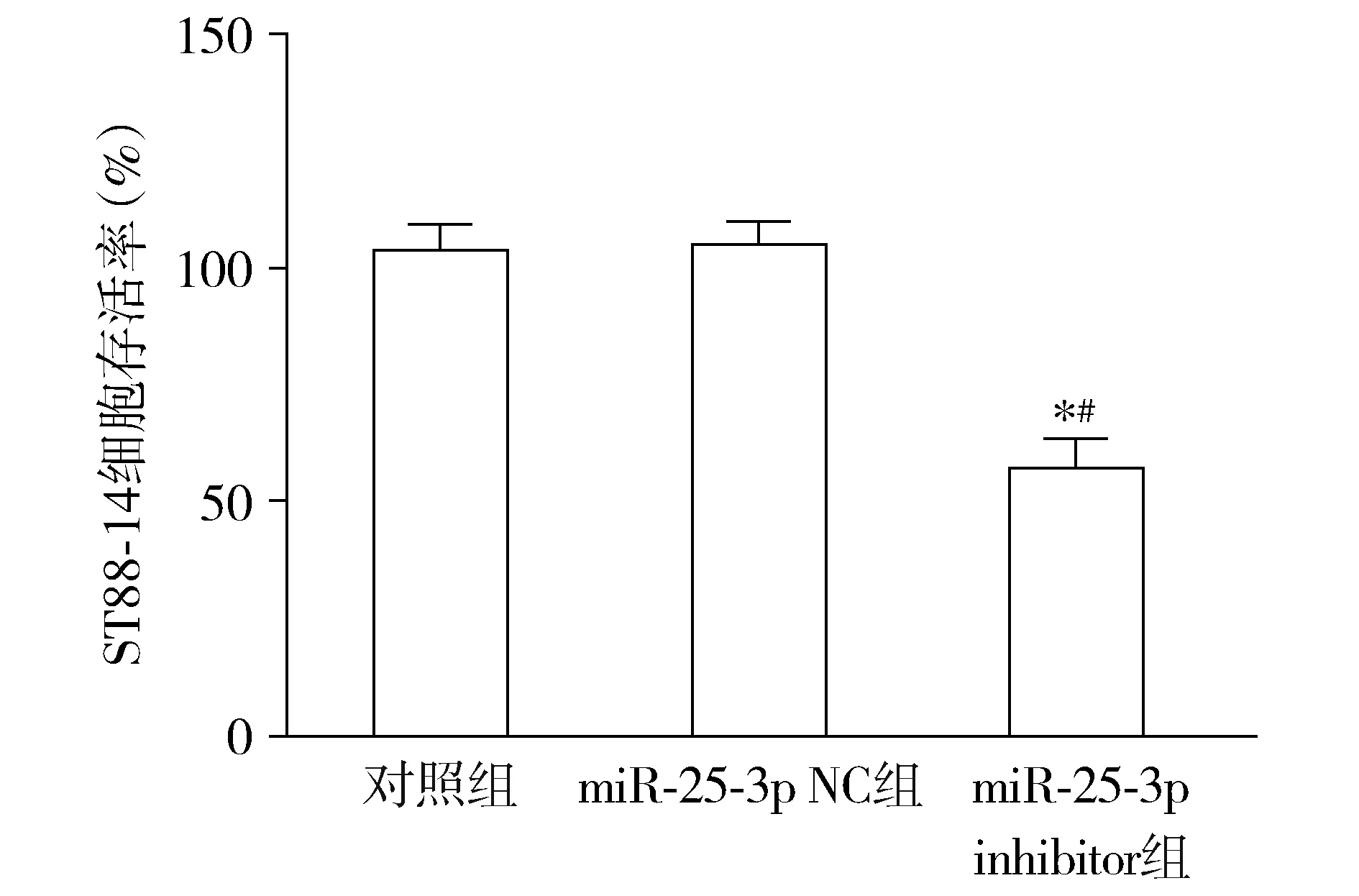
与对照组相比,*P<0.05;与miR-25-3p NC组相比,#P<0.05图2 miR-25-3p inhibitor转染后ST88-14细胞存活率变化Figure 2 Changes of survival rate of ST88-14 cells transfected with miR-25-3p inhibitor
2.3 miR-25-3p inhibitor转染对ST88-14细胞凋亡的影响
与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞凋亡率显著升高,差异有统计学意义(P<0.05,见图3)。

与对照组相比,*P<0.05;与miR-25-3p NC组相比,#P<0.05图3 流式细胞仪检测分析各组ST88-14细胞凋亡率Figure 3 Flow cytometry analysis of apoptosis rate of ST88-14 cells in each group
2.4 miR-25-3p inhibitor转染对ST88-14细胞迁移能力的影响
与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞划痕愈合率显著降低,差异有统计学意义(P<0.05,见图4)。

与对照组相比,*P<0.05;与miR-25-3p NC组相比,#P<0.05图4 划痕实验检测各组ST88-14细胞迁移率 (×100)Figure 4 Migration rate of ST88-14 cells in each group by Scratch test (×100)
2.5 miR-25-3p inhibitor转染对ST88-14细胞侵袭能力的影响
与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞侵袭数量显著降低,差异有统计学意义(P<0.05,见图5)。

与对照组相比,*P<0.05;与miR-25-3p NC组相比,#P<0.05图5 miR-25-3p inhibitor转染对ST88-14细胞侵袭能力的影响 (×100)Figure 5 Effect of miR-25-3p inhibitor transfection on invasion ability of ST88-14 cells (×100)
2.6 miR-25-3p inhibitor转染对ST88-14细胞NF2表达的影响
与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞中NF2 mRNA及Merlin蛋白表达水平显著升高,差异有统计学意义(P<0.05,见图6)。

与对照组相比,*P<0.05;与miR-25-3p NC组相比,#P<0.05图6 miR-25-3p inhibitor转染对各组细胞NF2 mRNA、Merlin蛋白表达情况Figure 6 Effects of miR-25-3p inhibitor on the expression of NF2 mRNA and Merlin protein
2.7 双荧光素酶报告基因检测系统验证miR-25-3p与NF2靶向关系
经mirtarbase数据库预测数据库预测显示,miR-25-3p与NF2 mRNA 3′UTR区有结合位点(见图7)。双荧光素酶报告基因检测结果显示,与NF2-3′UTR-WT+miR-25-3p NC组比较,NF2-3′UTR-WT+miR-25-3p inhibitor组荧光素酶活性降低,差异有统计学意义(P<0.05,见图7)。

与NF2-3′UTR-WT+miR-25-3p NC组相比,*P<0.05B.双荧光素酶报告基因检测结果图7 miR-25-3p与NF2靶向关系研究Figure 7 Study on the ralationship between miR-25-3p and NF2
3 讨论
目前,MPNST治疗手段有限,局部复发率为45%-62%,5年生存率为24%-69%,严重威胁着患者的生命安全[6]。Amirnasr等[7]研究证实,miRNA表达谱与MPNST密切相关,部分miRNA会影响MPNST细胞系的迁移和侵袭能力,寻找与MPNST发生发展有关联的miRNA,并研究其作用机制,可能有助于MPNST的临床治疗。
miRNA是细胞行为的重要调节剂,对人类癌症的发生、疾病进展和治疗具有重要作用,并已成为肿瘤发生发展的生物标记物[8]。丁元杰等[9]发现,miR-25-3p在食管鳞癌患者血清中高表达,与结肠癌的发生发展相关;在转移的结肠癌患者中,miR-25-3p表达水平显著高于未转移的结肠癌患者,可能作为转移结肠癌患者的血液生物标记[10];本研究首先构建了miR-25-3p低表达体系,结果显示,与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞miR-25-3p表达水平显著降低,提示转染成功。Liu等[11]研究发现,miR-25在非小细胞肺癌患者中高表达,过表达miR-25增强非小细胞肺癌细胞的迁移和侵袭,但对细胞的增殖和凋亡几乎没有作用。本研究结果显示,与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞存活率显著降低、凋亡率显著升高,提示抑制miR-25-3p表达能够抑制ST88-14细胞增殖,并诱导凋亡。
高转移率是造成MPNST预后不良和肿瘤复发的的重要因素,而肿瘤转移与肿瘤细胞的迁移和侵袭能力联系紧密[3,12]。研究表明,抑制miR-25能显著抑制三阴乳腺癌细胞的迁移和侵袭能力[13],此外,miR-25-3p过表达能够抑制胰腺癌细胞[14]和人肺癌细胞[15]的迁移和侵袭。本研究结果显示,与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞划痕愈合率、侵袭数量显著降低,提示抑制miR-25-3p表达水平可能抑制MPNST细胞的迁移和侵袭行为,推测miR-25-3p可能成为治疗MPNST术后肿瘤复发和转移的目标miRNA,为MPNST的临床治疗提供了新的思路。
NF2是编码Merlin蛋白的基因,是常见的肿瘤抑制因子[16,17]。Merlin蛋白能够与膜肌动蛋白细胞骨架结合,被认为是控制细胞骨架动力学的因素[18]。Den等[19]研究发现,NF2基因的失活突变是2型神经纤维瘤发病的潜在原因。另有研究显示[20],在偶发性和家族性NF2神经鞘瘤病例中,均发现NF2基因突变,但NF2与MPNST的发生发展是否存在联系尚不明确。本研究结果显示,与对照组和miR-25-3p NC组相比,miR-25-3p inhibitor组ST88-14细胞中NF2 mRNA及Merlin蛋白表达水平显著升高,提示抑制miR-25-3p表达能够促进NF2 mRNA及Merlin蛋白表达,miR-25-3p与NF2可能存在靶向关系。经mirtarbase数据库预测显示,miR-25-3p与NF2 mRNA 3′UTR区有结合位点。双荧光素酶报告基因检测结果显示,与NF2-3′UTR-WT+miR-25-3p NC组比较,NF2-3′UTR-WT+miR-25-3p inhibitor组荧光素酶活性降低,提示miR-25-3p与NF2存在靶向关系,推测miR-25-3p可能通过靶向促进NF2表达,抑制MPNST细胞的增殖、迁移和侵袭,而NF2过表达可能是MPNST发展的潜在抑癌基因。
综上所述,下调miR-25-3p表达水平可能通过靶向促进NF2表达,抑制人外周神经鞘瘤细胞的增殖、迁移及侵袭,表明miR-25-3p在MPNST转移中的潜在诊断和治疗价值,可能为临床靶向治疗MPNST提供了参考依据。但鉴于MPNST患者发病机制的复杂性,以及体内外试验研究的差异性,本文将进一步针对miR-25-3p与MPNST肿瘤疾病的调控机制进行更深入的探索。
