miR-27b调控PINK1/parkin通路参与大鼠癫痫发作的机制
2021-11-18杨子茵李佳宇高安亮成都医学院第二附属医院核工业四一六医院神经外科成都610051通讯作者mail3034240438qqcom
杨子茵,黄 军,李佳宇,曹 西,倪 艳,高安亮(成都医学院第二附属医院核工业四一六医院神经外科,成都 610051;通讯作者,E-mail:3034240438@qq.com)
癫痫作为一种常见的反复发作的顽固性疾病,其发作机制涉及突触结构、细胞死亡、神经信号传导及炎症[1,2]。研究发现,目前所用抗癫痫药物对60%的患者有效,40%患者疗效不佳,因此寻找有效的治疗方法对提高抗癫痫发作效果与生存质量极其重要[1]。微小RNA作为一个小型非编码RNA家族可通过抑制其靶基因mRNA表达及翻译来调控多种蛋白质的表达[2]。微小RNA 27b(miR-27b)与脑损伤大鼠神经细胞的凋亡密切相关,降低其表达可有效改善脑损伤,除此之外miR-27b-3p与神经退行性疾病多系统萎缩症的发生有关[3,4]。
自噬在维持细胞稳态中起重要作用,研究发现其在癫痫应激下可起到保护作用[5]。PTEN诱导性激酶蛋白1(PTEN-induced putative kinase 1,PINK1)/E3泛素连接酶(E3 ubiquitin ligase,Parkin)是一条经典的自噬相关通路,其激活可改善脑损伤大鼠的神经元损伤[6]。研究发现在HeLa宫颈癌细胞系中,miR-27b对PINK1的翻译抑制作用可显著降低溶酶体对受损线粒体的自噬清除[7]。目前,关于miR-27b及PINK1/parkin通路在癫痫中机制研究还未清楚,因此,本研究通过探究miR-27b及PINK1/parkin通路在癫痫中的作用机制,以期为疾病新治疗靶点的寻找提供参考。
1 材料与方法
1.1 实验动物
从长春市亿斯实验动物技术有限责任公司购买80只SPF级SD大鼠(245-285 g),许可证:SCXK(吉)2016-0004,于正常12 h明暗交替环境中适应性饲养1周,期间自由饮水采食,实验前禁食12 h。
1.2 主要试剂
氯化锂(货号:0416-100G)购自南京森贝伽生物科技有限公司;HE染色试剂盒(货号:G1120-100)购自北京索莱宝科技有限公司;蛋白提取试剂盒(货号:CD-13559-ML)购自武汉纯度生物科技有限公司;BCA蛋白检测试剂盒、HRP标记的山羊抗兔IgG二抗抗体(货号:HR0329-ZHV、JN0200-GLH)购自北京百奥莱博科技有限公司;兔抗β-actin、DRP1、PINK1、parkin、Beclin-1抗体(货号:4970、8570、6946、2132、3495)购自Cell Signaling Technology;兔抗LC3抗体(货号:NB100-2220)购自Novus Biologicals;TaqMan miRNA反转录试剂盒(货号:D1802)购自海基生物科技有限公司;miRNA定量试剂盒(货号:AMPR-0200)购自美国GeneCopoeia;即用型免疫组化EliVisionTMplus试剂盒(货号:KIT-9901)购自福州迈新生物技术开发有限公司;阴性对照序列(scramble)、miR-27b antagomiR序列由吉玛基因合成。
CFX384TMTouch荧光定量PCR系统购自伯乐(Bio-Rad)公司;JEM-2100F场发射透射电子显微镜购自日本电子株式会社;蛋白凝胶成像仪购自美国Bio-Rad公司。
1.3 方法
1.3.1 分组与癫痫模型构建 从80只SD大鼠中随机选取12只作为对照组;其余大鼠进行模型构建:以127 mg/kg氯化锂进行腹腔注射,之后每间隔0.5 h注射30 mg/kg匹罗卡品,直至Racine评级达到4-5级即为造模成功[8],成功60只,记录首次注射匹罗卡品至第一次出现Racine评级4级或5级癫痫发作所需时间即潜伏期,并记录1 h内发作次数;对照组在模型组同一时间点腹腔注射等量生理盐水。将60只大鼠分为模型组、miR-27b NC组、miR-27b拮抗剂组、miR-27b拮抗剂+H89组。对照组与模型组于造模前2周使用脑立体定位仪于大鼠大脑海马部双侧定位注射5 μl生理盐水;miR-27b NC组注射20 nmol/L拮抗剂阴性对照5 μl;miR-27b拮抗剂组注射20 nmol/L miR-27b拮抗剂5 μl;miR-27b拮抗剂+H89组注射20 nmol/L miR-27b拮抗剂5 μl及5 mg/kg[9]PINK1上游因子PKA抑制剂H89;实验结束后观察大鼠行为学变化。
1.3.2 实时荧光定量PCR(qRT-PCR)检测miR-27b表达水平 造模结束24 h后对大鼠进行颈椎脱臼处死,取出脑组织。每组选取3只大鼠脑组织,一部分液氮冷冻-80 ℃储存待Western blot检测,一部分置于研钵中研磨,通过Trizol法提取出脑组织样本中总RNA后检测其浓度,以所得RNA为模板反转录为cDNA,再以其为模板进行qRT-PCR扩增,检测各组组织中miR-27b的表达水平;U6作为内参,并经过2-ΔΔCt分析表达水平;引物由Primer 3.0和Oligo 7软件设计(见表1),由上海生工生物工程有限公司进行合成(miR-27b下游引物由试剂盒提供)。
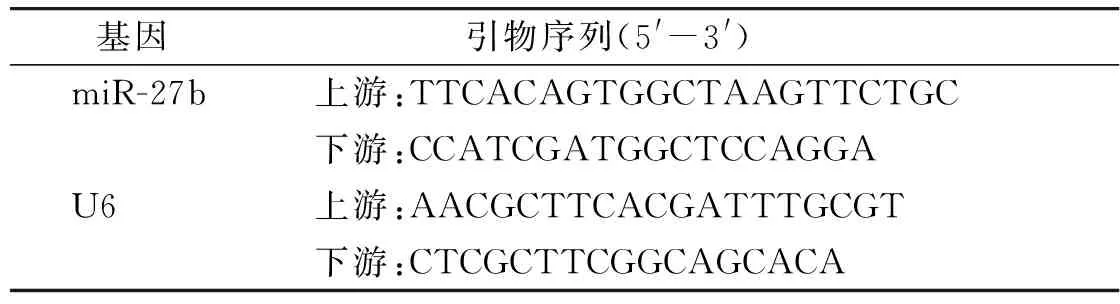
表1 实验所用qRT-PCR引物Table 1 QRT-PCR primers used in the experiment
1.3.3 HE染色观察大鼠海马组织病理学变化 每组另取5只大鼠,取其海马组织,并在4%多聚甲醛中固定(24 h)后乙醇脱水、石蜡包埋、切片(4 μm)、二甲苯脱蜡及梯度乙醇处理,再进行HE染色、脱水、封片、显微镜观察(n=5)。
1.3.4 透射电镜观察大鼠海马CA1区线粒体超微结构 取其余4只大鼠海马组织,使用戊二醛固定4 h后再使用四氧化锇固定2 h,乙醇、丙酮脱水后环氧树脂包埋,切片(0.5 μm),再使用光镜定位将其制备成超薄切片(60 nm),通过柠檬酸铝及醋酸双氧化铀染色后选取5个视野于透射电镜下观察。
1.3.5 免疫组化法检测DRP1蛋白表达情况 取2.3所得石蜡切片、梯度乙醇脱蜡、水化后加入双氧水清除内源性过氧化物酶,添加枸缘酸钠缓冲液(1 000 ml)高压修复抗原,DRP1一抗(1 ∶500)过夜,添加Envision二抗-酶标多聚物30 min后PBS清洗,经过DAB显色显微镜下观察到棕黄色颗粒、脱水干燥、中性树胶封片观察,呈棕黄色染色即为阳性。
1.3.6 Western blot检测脑组织PINK1、parkin、Beclin-1、LC3-Ⅱ/LC3-Ⅰ蛋白表达情况 将1.3.2所得3只大鼠脑组织(n=3)经苯甲基磺酰氟(phenylmethanesulfonyl fluoride、PMSF)裂解后提取总蛋白,经BCA法检测总蛋白含量;取上样缓冲液与蛋白混匀后100 ℃进行5 min变性,以每孔40 μg的量进行SDS-PAGE凝胶电泳,低温转移蛋白至PVDF膜上,5%的脱脂奶粉封闭(1 h)后,按照1 ∶1 000的稀释度例加入兔抗β-actin、PINK1、parkin、Beclin-1、LC3-Ⅱ/LC3-Ⅰ一抗孵育(4 ℃)过夜,PBS清洗3次后HRP标记的山羊抗兔IgG二抗(1 ∶3 000)孵育2 h,添加免疫印迹化学发光试剂(ECL Reagent)进行显色,蛋白凝胶成像仪观察,定量分析各蛋白含量。
2 结果
2.1 大鼠一般情况观察
对照组大鼠饮食良好、精神状态好、皮毛光洁;模型组和miR-27b NC组大鼠精神萎靡、饮食不佳、体形消瘦、皮毛光泽暗淡脏乱;与模型组相比,miR-27b拮抗剂组大鼠精神状态改善、饮食增加、皮毛恢复光泽;与miR-27b拮抗剂组相比,miR-27b拮抗剂+H89组大鼠精神状态下降、饮食减少、皮毛暗淡。
2.2 各组大鼠癫痫发作次数及发作潜伏期比较
对照组大鼠无癫痫发作。与模型组相比,miR-27b NC组大鼠癫痫发作次数及发作潜伏期差异无统计学意义(P>0.05),而miR-27b拮抗剂组发作次数显著降低,而发作潜伏期显著增加(P<0.05);与miR-27b拮抗剂组相比,miR-27b拮抗剂+H89组发作次数显著增加,发作潜伏期显著降低(P<0.05,见表2)。
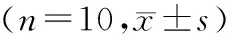
表2 各组大鼠癫痫发作次数及发作潜伏期比较Table 2 Comparison of seizure frequency and seizure latency of rats in each
2.3 各组大鼠miR-27b表达水平检测
与对照组相比,模型组脑组织中miR-27b表达水平显著增加(P<0.05);与模型组相比,miR-27b NC组miR-27b表达水平差异无统计学意义(P>0.05),而miR-27b拮抗剂组miR-27b表达水平显著降低(P<0.05);与miR-27b拮抗剂组相比,miR-27b拮抗剂+H89组miR-27b表达水平差异无统计学意义(P>0.05,见表3)。
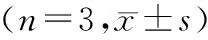
表3 miR-27b表达情况Table 3
2.4 各组大鼠海马组织神经细胞形态学观察
HE染色结果显示,对照组大鼠海马组织神经细胞排列规则、形态结构正常,而模型组和miR-27b NC组大鼠海马组织神经细胞出现肿胀、核固缩和溶解现象,排列分布不均且紊乱;与模型组相比,miR-27b拮抗剂组神经细胞肿胀、坏死现象改善,排列分布较为有序、均匀;与miR-27b拮抗剂组相比,miR-27b拮抗剂+H89组神经细胞坏死、肿胀现象加重,排列分布杂乱无序(见图1)。
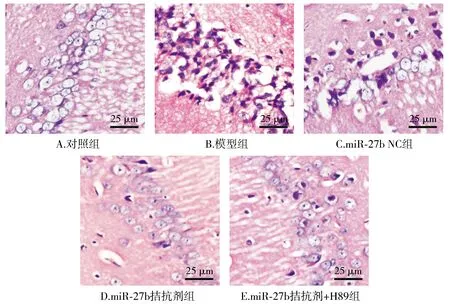
图1 各组大鼠海马组织神经细胞形态学观察 (HE,×400)Figure 1 Morphological changes of nerve cells in hippocampus of rats in each group (HE,×400)
2.5 各组大鼠海马CA1区线粒体超微结构观察
对照组大鼠海马CA1区线粒体形态结构完整、边界清晰、嵴未出现破损现象,而模型组和miR-27b NC组大鼠海马CA1区线粒体嵴和膜破损、边界模糊,出现肿胀现象;与模型组相比,miR-27b拮抗剂组线粒体肿胀及膜破损程度减轻、边界较为清晰;与miR-27b拮抗剂组相比,miR-27b拮抗剂+H89组线粒体结构破坏又见加重(见图2)。
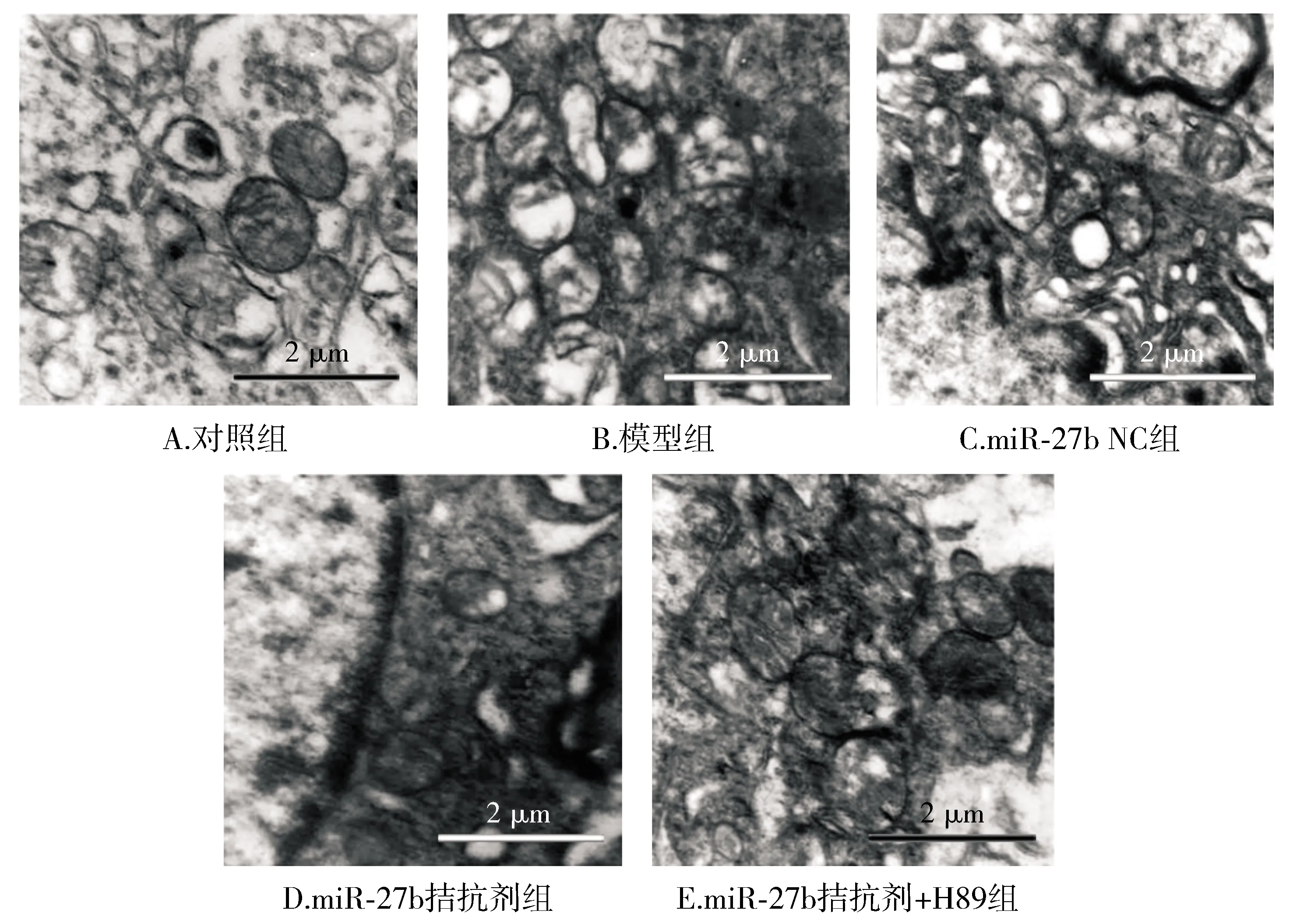
图2 各组大鼠海马CA1区线粒体超微结构观察 (×30 000)Figure 2 Observation on the ultrastructure of mitochondria in hippocampal CA1 area of rats in each group (×30 000)
2.6 各组大鼠海马区DRP1蛋白表达情况
DRP1阳性细胞表达于神经元样细胞膜上,与对照组相比,模型组DRP1阳性表达显著增加(P<0.05);与模型组相比,miR-27b NC组DRP1阳性表达差异无统计学意义(P>0.05),而miR-27b拮抗剂组DRP1阳性表达显著降低(P<0.05);与miR-27b拮抗剂组相比,miR-27b拮抗剂+H89组DRP1阳性表达显著增加(P<0.05,见图3)。
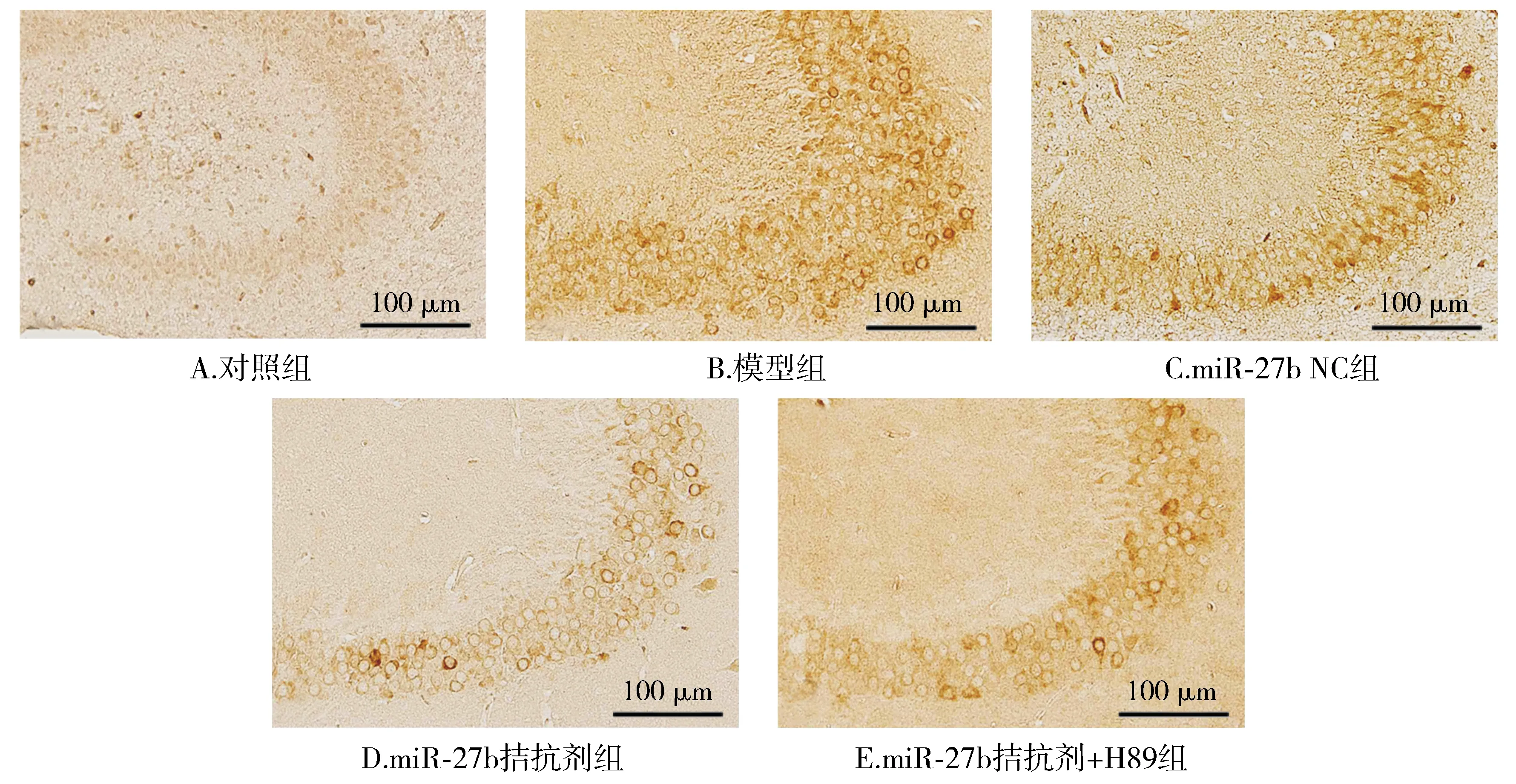
图3 大鼠海马区DRP1蛋白表达情况 (×200)Figure 3 DRP1 protein expression in the hippocampus of rats (×200)
2.7 Western blot检测大鼠海马组织中PINK1/parkin通路及自噬相关蛋白表达情况
与对照组相比,模型组海马组织中PINK1、parkin、Beclin-1、LC3-Ⅱ/LC3-Ⅰ表达水平显著降低(P<0.05);与模型组相比,miR-27b NC组PINK1、parkin、Beclin-1、LC3-Ⅱ/LC3-Ⅰ表达水平差异无统计学意义(P>0.05),而miR-27b拮抗剂组PINK1、parkin、Beclin-1、LC3-Ⅱ/LC3-Ⅰ表达水平显著增加(P<0.05);与miR-27b拮抗剂组相比,miR-27b拮抗剂+H89组PINK1、parkin、Beclin-1、LC3-Ⅱ/LC3-Ⅰ表达水平显著降低(P<0.05,见表4、图4)。
表4 大鼠海马组织中PINK1/parkin通路及自噬相关蛋白表达情况Table 4 Expression of PINK1/parkin pathway and autophagy related proteins in rat
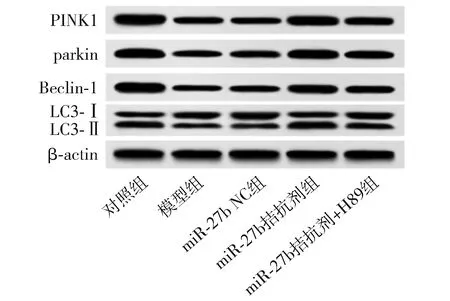
图4 Western blot检测大鼠海马组织中PINK1/parkin通路及自噬相关蛋白表达Figure 4 PINK1/parkin pathway and autophagy-related protein expression in rat hippocampus by Western blot
3 讨论
癫痫是一种慢性神经系统疾病,影响中国约7%的人口,由大脑某特定区域神经元异常引发的中枢神经系统兴奋与抑制间不平衡所导致,其发病机制十分复杂,至今仍未研究清楚[5,10,11]。随着癫痫发作时间的延长,对患者大脑神经元所造成的损伤持续加重,严重影响患者心理和生理健康,因此寻找其有效治疗方法十分重要[12]。
由于miRNA在癫痫的发生中起着至关重要的作用,因此有作为癫痫生物标记物及治疗靶标的潜能[10]。有研究表明癫痫的发作机制与炎症相关,神经炎症可导致神经系统疾病加重,miR-27b在多发性硬化症、阿尔兹海默症等几种神经炎性疾病中表达异常增加,研究发现,抑制其表达则可缓解神经炎症[1,13]。本研究发现,miR-27b在癫痫大鼠脑组织中表达异常增加,抑制其表达可改善癫痫大鼠精神、饮食、皮毛状态,神经细胞损伤程度,减少癫痫发作次数,延长发作潜伏期。上述结果表明miR-27b可能与癫痫的发生有关,抑制其表达对疾病具有改善作用,其有作为癫痫治疗靶点的潜能。
自噬是一个高度保守的细胞过程,为维持细胞稳态,可将存在功能障碍的细胞器、蛋白质等细胞成分送至溶酶体进行降解,该过程可在癫痫应激下起保护作用,自噬功能障碍与多种神经退行性疾病的发生相关[14,15]。PINK1/parkin作为经典的自噬相关信号通路在线粒体运动和大小中具有重要作用[16]。PINK1是一种主要合成于细胞质的蛋白激酶,在线粒体正常状态下,其通过线粒体膜进入线粒体内,经线粒体蛋白酶PARL剪切后被蛋白酶体降解,而当神经元受损致使线粒体膜电位下降时,PINK1被稳定于线粒体外膜上募集parkin促进自噬,清除受损细胞成分,从而保护细胞[6,16]。PINK1和parkin在神经退行性疾病及神经炎症中具有重要作用,PINK1和parkin缺乏会促进巨噬细胞中组织相容性复合物(MHC)触发高水平的线粒体抗原,从而刺激适应性免疫反应的发生[16,17]。研究发现,parkin缺乏小鼠会出现神经元丢失及运动能力降低的现象[15]。miR-27b可通过靶向抑制PINK1表达来降低受损线粒体的自噬清除能力[7]。线粒体动力相关蛋白(dynamin-related protein 1,DRP1)作为线粒体分裂的重要蛋白,其表达异常增加会打破线粒体动态平衡,致使线粒体功能损伤[18]。本研究发现抑制miR-27b表达可改善癫痫大鼠大脑海马组织线粒体损伤,降低DRP1阳性细胞数,增加PINK1、parkin、Beclin-1、LC3-Ⅱ/LC3-Ⅰ表达水平,而PINK1上游因子PKA抑制剂H89可逆转上述miR-27b抑制对癫痫大鼠损伤的改善作用。该结果与前人研究结果相似[7],这表明miR-27b沉默对癫痫大鼠脑损伤的改善作用与PINK1/parkin通路有关,miR-27b表达沉默可能通过促进PINK1/parkin通路来促进线粒体自噬,抑制神经炎症发生,以此改善大鼠癫痫程度。
综上所述,miR-27b表达沉默可通过促进PINK1/parkin信号通路改善大鼠癫痫程度。本研究不仅为癫痫治疗靶点的寻找提供参考,还对疾病发生机制的研究具有重要意义。但在未来的研究中还需对其下游通路进行深入研究。
