早期肠内营养联合肠外营养在食管癌患者术后的应用研究
2021-11-18马淑芳
马淑芳
(丹阳市人民医院临床营养科,江苏 镇江 212300)
食管癌是消化道常见的恶性肿瘤之一,其恶性程度较高,具有发病率、致死率高的特点,且其发病隐匿,大部分患者进行治疗时已到晚期,严重威胁患者的生命健康。临床上多采用手术方式治疗食管癌,但由于手术创伤较大,患者术后进食困难,容易造成机体营养不良,同时导致机体免疫功能受到抑制,影响患者术后康复,因此合理的营养支持治疗对食管癌术后患者康复具有重要意义。肠外营养可提供患者所需的营养物质,但疗效欠佳,且易出现局部红肿、动脉损伤等不良反应[1]。早期肠内营养支持可明显改善患者机体营养状况,更符合患者机体生理需求,在促进恶性肿瘤术后患者康复方面具有良好的效果[2]。本研究旨在探讨早期肠内营养联合肠外营养对食管癌患者术后营养状况和免疫功能的影响,现研究结果报道如下。
1 资料与方法
1.1 一般资料 选取2018年11月至2019年11月丹阳市人民医院收治的40例食管癌患者,按照随机数字表法分为对照组(20例)和观察组(20例)。对照组患者中男性10例,女性10例;年龄58~72岁,平均(64.68±2.72)岁;TNM分期[3]:Ⅱ期7例、Ⅲ期13例;发病部位:食管上段11例、食管中下段9例。观察组患者中男性11例,女性9例;年龄58~74岁,平均(63.48±2.56)岁;TNM分期:Ⅱ期8例、Ⅲ期12例;发病部位:食管上段12例、食管中下段8例。两组患者一般资料比较,差异无统计学意义(P > 0.05),组间具有可比性。纳入标准:符合《食管癌规范化诊治指南》[4]中的相关诊断标准,且成功行手术切除术者;肝、肾功能正常者;术前未进行放、化疗治疗者等。排除标准:合并其他部位肿瘤者;先天性营养不良者;患有胃肠道疾病者等。研究经丹阳市人民医院医学伦理委员会批准,其患者及家属均自愿签署知情同意书。
1.2 方法 对照组患者于术后第1天开始给予全静脉肠外营养支持治疗:脂肪乳氨基酸(17)葡萄糖(11%)注射液{辽宁海思科制药有限公司,国药准字H20183051,规格:1 440 mL[脂肪乳注射液(20%)255 mL;复方氨基酸注射液(17)300 mL;葡萄糖注射液(11%)885 mL]},设定每天总能量摄入为 30 kcal/(kg·d)(1 kcal=4.184 kJ),注滴速度应 < 3.7 mL/(kg·h)。观察组患者在对照组的基础上进行早期肠内营养支持治疗:患者于术前12 h与术前2 h分别口服医院营养师自行调制的肠内营养液(葡萄糖、复方氨基酸、脂肪乳、水溶性维生素、微量元素等)500 mL、200 mL。术中放置胃管与肠内营养管,于术后6 h开始输送医院营养师自行调制的肠内营养液,控制流速为40 mL/h,术后第1天营养液的输入量控制在1 000 mL以内;术后第2天,可根据患者耐受情况增加营养液的输入流速,总输入量控制在2 500 mL以内;术后3~5 d,减少营养液的输入,待排气完成后拔出胃管,予以营养液口服,也可根据患者恢复情况酌情增加流质食物的摄入。两组患者均治疗7 d。
1.3 观察指标 ①术后恢复情况。观察、记录并比较两组患者肛门排气时间、首次排便时间及住院时间。②营养指标。分别于术前、术后7 d抽取两组患者空腹静脉血5 mL,以3 000 r/min的转速离心10 min后,分离血清,采用全自动生化分析仪检测血清转铁蛋白(TRF)、白蛋白(ALB)、总蛋白(TP)水平。③免疫功能。血液采集、血清制备方法同②,采用免疫散射比浊法检测两组患者血清免疫球蛋白G(IgG)、免疫球蛋白A(IgA)及免疫球蛋白M(IgM)水平。
1.4 统计学方法 采用SPSS 21.0统计软件分析数据,计量资料、计数资料采用 (±s)、[ 例 (%)]表示,分别行t、χ2检验。以P< 0.05为差异有统计学意义。
2 结果
2.1 术后恢复情况 与对照组比,观察组患者肛门排气时间、首次排便时间及住院时间均缩短,差异均有统计学意义(均P< 0.05),见表1。
表1 两组患者术后恢复相关指标比较( ±s)
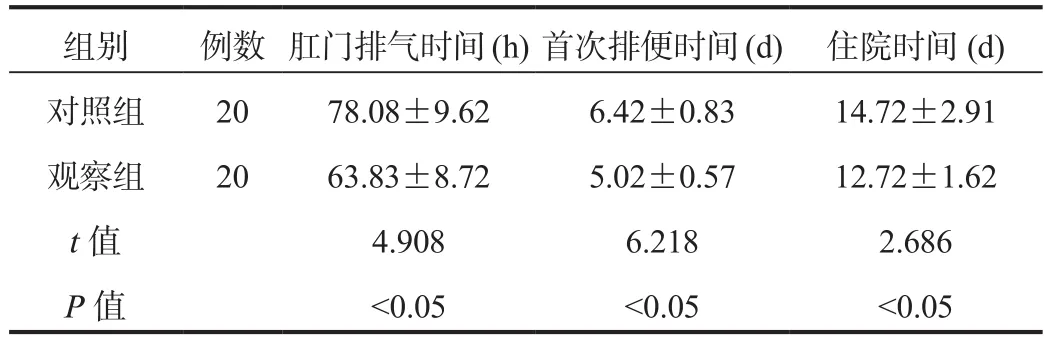
表1 两组患者术后恢复相关指标比较( ±s)
组别 例数 肛门排气时间(h)首次排便时间(d) 住院时间(d)对照组 20 78.08±9.62 6.42±0.83 14.72±2.91观察组 20 63.83±8.72 5.02±0.57 12.72±1.62 t值 4.908 6.218 2.686 P值 <0.05 <0.05 <0.05
2.2 营养指标 与术前比,术后7 d两组患者血清TRF、ALB、TP水平均降低,而观察组高于对照组,差异均有统计学意义(均P< 0.05),见表2。
表2 两组患者营养指标比较( ±s , g/L)
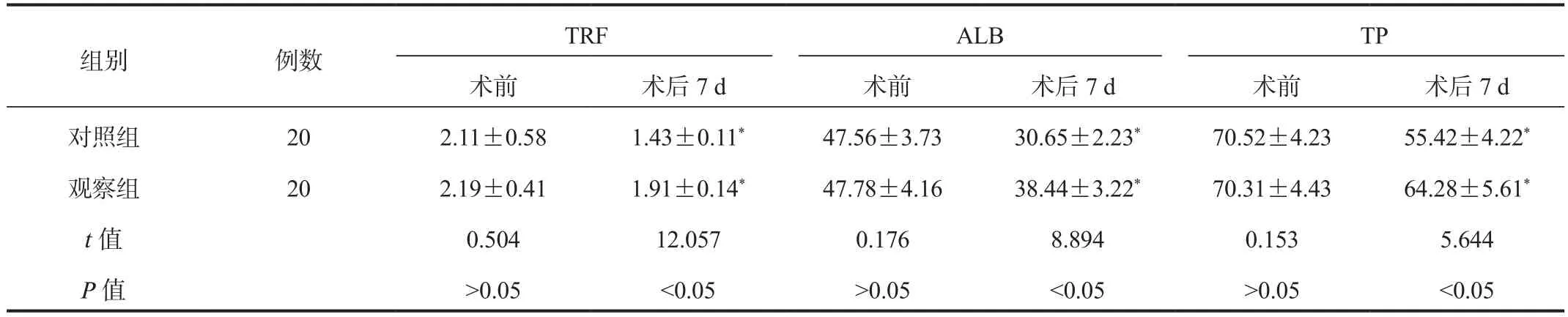
表2 两组患者营养指标比较( ±s , g/L)
注:与术前比,*P < 0.05。TRF:转铁蛋白;ALB:白蛋白;TP:总蛋白。
TRF ALB TP术前 术后7 d 术前 术后7 d 术前 术后7 d对照组 20 2.11±0.58 1.43±0.11* 47.56±3.73 30.65±2.23* 70.52±4.23 55.42±4.22*观察组 20 2.19±0.41 1.91±0.14* 47.78±4.16 38.44±3.22* 70.31±4.43 64.28±5.61*t值 0.504 12.057 0.176 8.894 0.153 5.644 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05组别 例数
2.3 免疫功能指标 与术前比,术后7 d两组患者血清IgG、IgM、IgA水平均降低,而观察组高于对照组,差异均有统计学意义(均P< 0.05),见表3。
表3 两组患者免疫功能指标比较( ±s , g/L)
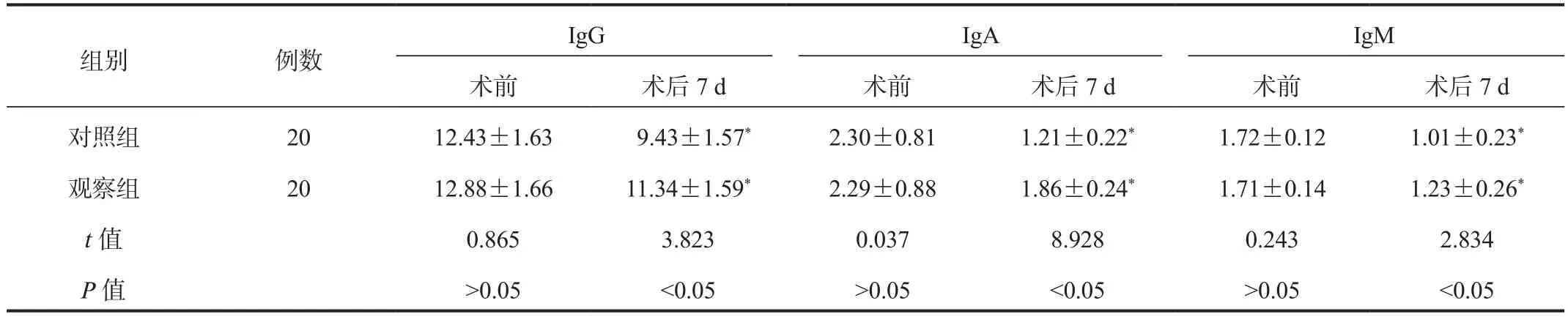
表3 两组患者免疫功能指标比较( ±s , g/L)
注:与术前比,*P < 0.05。IgG:免疫球蛋白G;IgA:免疫球蛋白A;IgM:免疫球蛋白M。
IgG IgA IgM术前 术后7 d 术前 术后7 d 术前 术后7 d对照组 20 12.43±1.63 9.43±1.57* 2.30±0.81 1.21±0.22* 1.72±0.12 1.01±0.23*观察组 20 12.88±1.66 11.34±1.59* 2.29±0.88 1.86±0.24* 1.71±0.14 1.23±0.26*t值 0.865 3.823 0.037 8.928 0.243 2.834 P值 >0.05 <0.05 >0.05 <0.05 >0.05 <0.05组别 例数
3 讨论
食管癌多发于中老年人群,以进行性吞咽困难为典型症状,通常其机体会伴有较为严重的营养不良,而术后由于高代谢反应、禁食等因素可进一步加重患者营养不良。目前临床上多采用肠外营养的方式对食管癌术后患者进行营养支持,其通过静脉输注的方式向患者机体提供营养,可减轻营养不良症状,但容易导致患者肠黏膜萎缩,肠道屏障功能降低,且易出现肠道细菌的移位,影响胃肠道功能[5]。
早期肠内营养属于快速康复外科理念的范畴,术前口服肠内营养制剂可减少术中应激、术后胰岛素抵抗的发生[6];术后进行肠内营养支持对刺激胃肠道激素分泌、肠蠕动和改善患者肠黏膜屏障功能均有良好作用,其在补充营养的同时可促进肠黏膜屏障功能修复,避免长时间禁食导致的肠黏膜屏障受损,有助于促进食管癌患者术后机体对营养物质的吸收[7]。本研究结果显示,与对照组比,观察组患者肛门排气时间、首次排便时间及住院时间均缩短,术后7 d,观察组患者血清TRF、ALB、TP水平均高于对照组,提示早期肠内营养联合肠外营养可有效缩短食管癌术后患者恢复时间,改善机体营养状况。
相关研究显示,由于长期的吞咽苦难和肿瘤的消耗,食管癌患者多存在基础的营养不良,进而导致其免疫功能较为低下,而IgG、IgA、IgM是评价机体体液免疫功能的重要指标,主要为脾、淋巴结中的浆细胞分泌,具有免疫抗体的作用,其水平降低则表明患者营养不良状况加重[8]。本研究结果显示,由于手术创伤,导致患者免疫抵抗力下降,因而术后7 d两组患者的IgG、IgA、IgM水平较术前显著降低,但术后7 d,观察组患者血清IgG、IgA、IgM水平均高于对照组,提示早期肠内营养联合肠外营养支可有效保护食管癌术后患者机体免疫功能,且效果较好。分析其原因为早期肠内营养可通过保护肠黏膜功能维持肠道内正常菌群微生态平衡,进而抑制外来病菌的入侵,减低机体免疫功能损伤;同时机体补充充足的营养有利于白细胞、吞噬细胞等免疫细胞的增殖,进而改善患者机体免疫功能[9]。
综上,早期肠内营养联合肠外营养可有效改善食管癌术后患者营养状况、提高免疫功能,且可缩短患者术后恢复时间,值得在临床进一步推广。
